外源激素和养分溶液浸种对君迁子场圃发芽的影响
周冬梅,顾 梦,李莲芳,刘 娴,张合瑶,李小军
(西南林业大学,云南昆明 650224)
君迁子(Diospyros lotus)又名黑枣、软枣,为柿科(Ebenaceae)柿属落叶乔木或小乔木,为深根性喜光树种,耐瘠薄和盐碱,抗寒和抗旱能力强,喜钙质土壤,对土壤的适应性较强,生长迅速,枝叶繁茂,可作为城市绿化的造林树种[1]。君迁子的成熟果实味甜可食,可制成柿饼;种子可入药,有止渴、去烦热等功效;果肉可制糖、酿酒等;未成熟果实可用于提制柿漆,作为医药和涂料的原料;木材坚硬,耐磨损,可用于制作纺织木梭、雕刻和制作小用具等[2-5]。君迁子属多用途树种,有较高的应用价值。
外源激素浸种可促进种子发芽,提高发芽性状。潘春柳等[6]对线叶唇柱苣苔(Chirita linearifolia)种子萌发进行研究,发现赤霉素(GA3)浸种可显著提高其发芽率和发芽势,以200 mg/L GA3处理效果最佳;袁莲珍等[7]采用100 mg/L 吲哚丁酸(IBA)溶液处理杉木(Cunninghamia lanceolata)种子1 h,种子发芽率最高(78.1%)。丁彬等[8]将君迁子种子分别置于85 ℃清水中浸泡48 h 和浓硫酸中浸泡1 min,两种处理方式下种子的发芽势和发芽率均较高;孙鹏等[9]的研究表明,采用适宜浓度的GA3处理君迁子种子,可显著提高种子发芽率(64%),促进苗高生长和叶片发育;谢志兵等[10]采用0.2 g/L 乙烯利和清水浸泡君迁子种子8 h,结果显示0.2 g/L乙烯利处理可提高君迁子种子的发芽率(67.68%),促进幼苗生长和侧根发育,但抑制主根生长。君迁子种子发芽文献较少,且内容较分散。本研究采用L9(34)正交试验设计,研究GA3、IBA 和磷酸二氢钾(KH2PO4)不同浓度组合对君迁子种子发芽的影响,丰富该树种种子发芽资料,为其苗木培育提供参考。
1 材料与方法
1.1 试验地概况与材料
试验在西南林业大学林学院苗圃(102°45′E,25°03′N)内的塑料温棚中进行。该地海拔约为1 890 m,属亚热带低纬度高原山地季风气候,日照长,霜期短,年均气温约14.7 ℃,年均降水量1 035 mm,年均相对湿度68.2%,年均日照时长2 200 h;土壤类型为山地红壤[11-14]。利用温棚的增温和保温功能,在冬季进行发芽试验;试验期间,塑料温棚内晴天和阴天的平均温度约为24和12 ℃。
2019年,在宜良县国有禄丰村林场尖山林区(102°45′E,25°03′N)采集君迁子种子。试验时(2020年11月),种子在室内干燥环境中放置1年,饱满且无病虫害,千粒重为84.52 g。
1.2 试验设计
试验包括GA3(A)、IBA(B)和KH2PO4(C)3 个因素,每因素3 水平,采用L9(34)正交试验设计进行试验(表1)。

表1 因素水平表与L9(34)正交试验设计Tab.1 Factor levels and L9(34)orthogonal design
试验共10 个处理,包括9 个激素处理和1 个对照(CK)。每处理12个无纺布容器(14 cm×16 cm),每容器播种5 粒种子,3 次重复,共360 个无纺布容器,1 800粒种子。
试验前平整苗床,将采集的森林土壤暴晒后,敲碎装入容器中。采用0.5% KMnO4溶液对基质和苗床进行消毒,自然晾晒干后播种。种子按60 粒/组用纱布包裹,置于40 ℃(初始温度)温水中浸泡,每12 h 换1 次室温清水(22 ℃),时长70 h;将浸泡后的种子取出,吸干表面水分,按GA3、IBA 和KH2PO4的顺序分别置于相应浓度的溶液中浸泡2、2 和6 h,共10 h;从每一溶液中取出后,均擦干表面水分再浸入下一溶液。CK 处理为种子按60 粒/组用纱布包裹,置于40 ℃(初始温度)温水中浸泡80 h,每12 h 换1次常温清水。浸种结束后,将种子播入容器中,播种后均匀覆盖一层0.5 cm基质,再覆盖一层松针,用0.5% KMnO4溶液将基质浇透。为保证种子发芽所需的温度和湿度,播种后搭建塑料拱棚。发芽期间,定期浇水、除草。
种子发芽后,每天记录1次种子发芽数;发芽结束后,计算发芽势(%)、发芽率(%)、平均发芽时间(d)和发芽指数(粒/d)[15]。

式中,N0为日发芽种子数达到最高峰时正常发芽的种子数;N为置床的种子数。
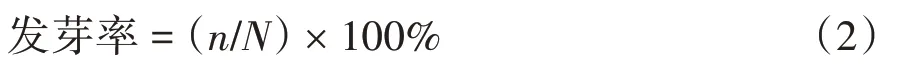
式中,n为测定时间内正常发芽的种子数。
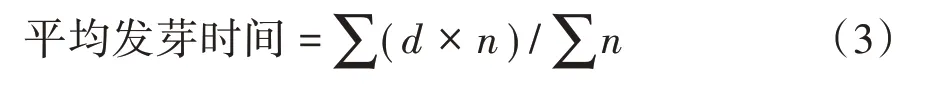
式中,d为从播种之日算起的天数;n为相应各日正常发芽的种子数。

式中,n为相应各日正常发芽的种子数。
1.3 数据处理
采用Excel 2010 和SPSS 22.0 软件进行数据整理和分析;为满足方差分析的齐性要求,如有数据≤30%或≥70%,进行反正弦变换后再进行方差分析;处理和因素水平间若呈现显著或极显著差异,采用Duncan's法进行多重比较[16]。
2 结果与分析
2.1 君迁子种子发芽过程
种子在播种后的第30 天开始发芽,第68 天发芽结束;除处理1外,其他处理在播种后的第39 ~57天均出现发芽高峰,发芽率峰值为31.67% ~50.00%;处理1 的发芽高峰延迟至第63 天,发芽率仅为10.00%(图1)。CK 的发芽率在第39 天前较高,之后下降,其他处理在整个发芽过程中均出现几次不同程度的发芽高峰,表明不同处理对君迁子种子发芽过程有不同的影响。
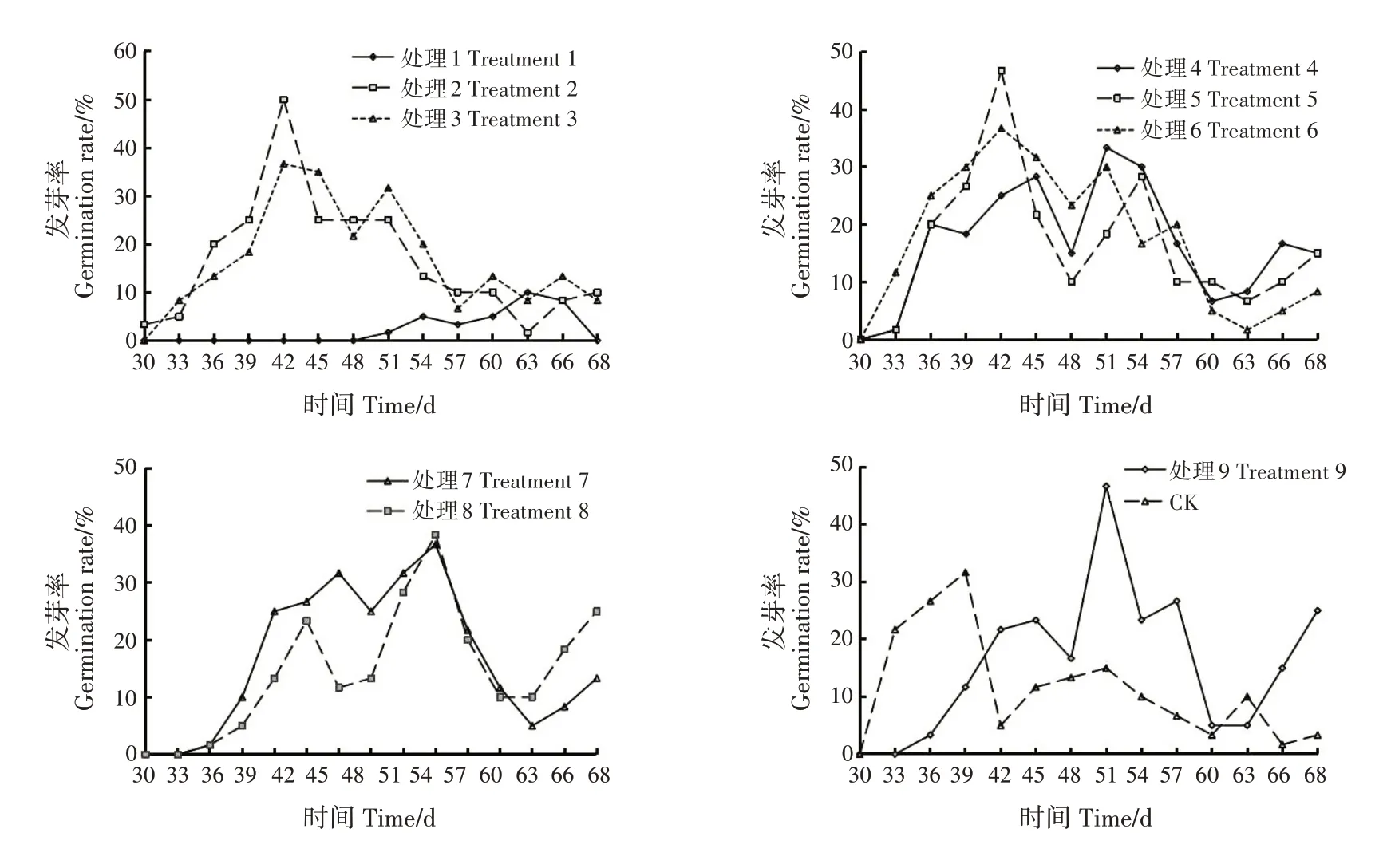
图1 君迁子种子发芽过程Fig.1 Germination process of D.lotus seeds
2.2 君迁子种子发芽率和发芽势
各激素处理的发芽率和发芽势均值分别为11.11% ~82.78%和5.00% ~52.78%,CK 的发芽率和发芽势均值分别为53.33%和18.89%;除处理1外,其他激素处理的发芽率和发芽势均值均高于CK(表2)。低浓度的GA3和IBA 共同处理(处理1)下,种子的发芽率和发芽势较低,但较低浓度GA3和IBA 结合KH2PO4溶液处理(处理4)可极显著提高发芽率(P<0.01),并促进种子发芽整齐;相对高浓度的GA3和IBA 共同处理种子(处理6 和8),也可极显著或显著提高发芽率和发芽势(P<0.01,P<0.05)。因此,可采用相对高浓度的GA3和IBA 共同处理,或结合KH2PO4进行处理,均可提高君迁子种子发芽率和发芽势。虽然君迁子种子属易发芽的类型,但外源激素和养分溶液处理可提高其种子发芽率和发芽势,生产实践中可根据具体条件选择处理2 ~9中的任何一种措施处理种子。
发芽率随GA3、IBA 和KH2PO4浓度升高呈升高趋势;0.15、0.20 g/L GA3和0.30、0.45 g/L IBA 处理的发芽率极显著高于0.10 g/L GA3和0.15 g/L IBA 处理(P<0.01),与低浓度GA3和IBA 处理下发芽率较低的结果一致;影响发芽率的主导因子为GA3和IBA的交互作用(A×B);理论优水平组合为0.15 g/L GA3、0.45 g/L IBA 和0.50% KH2PO4(A2B3C3),与实际优水平组合处理7(A3B1C3),除KH2PO4溶液浓度一致外,其他两个因素的水平不一致(表3)。发芽势也随3种溶液浓度升高呈升高趋势;影响发芽势的主导因子也是GA3和IBA 的交互作用(A×B);理论优水平组 合 为0.20 g/L GA3、0.30 g/L IBA 和0.50% KH2PO4(A3B2C3),与实际优水平组合处理7,除IBA 溶液浓度不一致外,其他两个因素的水平一致。
2.3 君迁子种子发芽指数和发芽时间
各激素处理的平均发芽时间和发芽指数均值分别为16.53 ~30.95天和0.22 ~4.40粒/天;CK 的平均发芽时间和发芽指数均值分别为14.70 天和3.74粒/天;各激素处理的平均发芽时间均值均高于CK;处理2和6的发芽指数均值均高于CK(表2)。CK发芽较快是因为生活力较强的部分种子发芽迅速,但发芽率和发芽势较低;外源激素和养分溶液处理可激活生活力略弱的种子,此部分种子发芽较慢,平均发芽时间增加。处理6 的发芽率、发芽势和发芽指数均较高,发芽较快,生产实践中可采用此措施处理种子,综合提高发芽性状,为苗木培育奠定良好的基础。
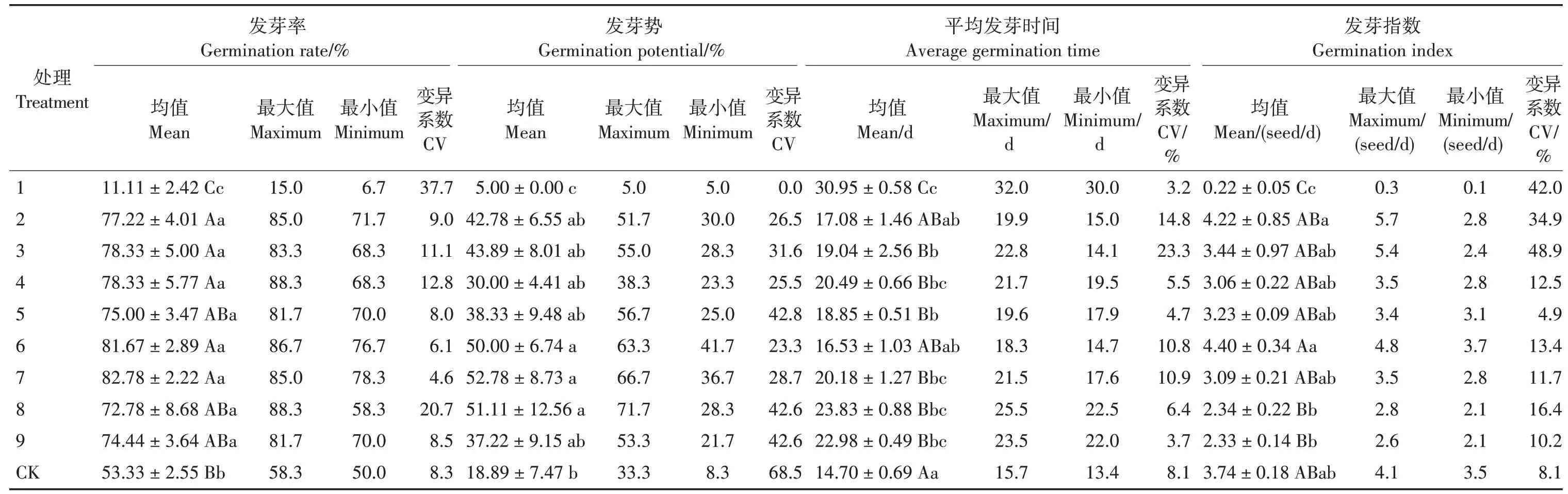
表2 君迁子种子发芽指标Tab.2 Germination indexes of D. lotus seeds
平均发芽时间随IBA 和KH2PO4浓度升高而缩短,相对高浓度的IBA 和KH2PO4处理可极显著缩短发芽时间(P<0.01);0.15 g/L GA3处理的平均发芽时间极显著短于0.10 和0.20 g/L 处理(P<0.01),即在低或高浓度GA3处理下,种子的平均发芽时间较长,种子对GA3浓度较敏感(表3)。影响平均发芽时间的主导因子为GA3和IBA 的交互作用(A×B);理论优水平组合为0.15 g/L GA3、0.45 g/L IBA 和0.50%KH2PO4(A2B3C3),与实际优水平组合CK不一致。发芽指数随IBA 和KH2PO4浓度升高而升高,相对高浓度的IBA 和KH2PO4处理可显著提高发芽指数(P<0.05);0.15 g/L GA3处理的发芽指数显著高于0.10和0.20 g/L处理(P<0.05)。影响发芽指数的主导因子为GA3和IBA 的交互作用(A×B);理论优水平组合为0.15 g/L GA3、0.45 g/L IBA 和0.25% KH2PO4(A2B3C2),与实际优水平组合处理6(A2B3C1),除KH2PO4溶液浓度不一致外,其他两个因素的水平一致。

表3 发芽性状的极差分析Tab.3 Range analysis of germination indexes
2.4 GA3和IBA 交互作用对君迁子种子发芽率和发芽势的影响
GA3和IBA 的交互作用对种子各发芽性状均有最大的影响,发芽率和发芽势是种子发芽的关键指标,故仅对这两个指标的交互作用进行分析。IBA 浓度为0.15 g/L 时,GA3浓度从0.10 g/L 上升至0.15 g/L时,发芽率升高的速度较快,从0.15 g/L上升至0.20 g/L 时,发芽率升高的速度变缓,与前述君迁子种子对GA3浓度较为敏感的结果相一致(图2a)。0.15 g/L IBA 分别与0.10、0.15和0.20 g/L GA3共同处理时,发芽率随GA3浓度升高而升高;0.30 g/L IBA分别与0.10、0.15 和0.20 g/L GA3共同处理时,发芽率随GA3浓度的升高极缓慢下降;0.45 g/L IBA 分别与0.10、0.15 和0.20 g/L GA3共同处理时,发芽率随GA3浓度的升高呈先缓慢上升后下降的趋势。0.20 g/L GA3与0.15 g/L IBA 共同处理时,发芽率最高,表明低浓度IBA 与高浓度GA3共同处理对提高种子发芽率效果较好。
0.15 g/L IBA 分别与0.10、0.15 和0.20 g/L GA3共同处理时,发芽势随GA3浓度的升高而升高;0.30 g/L IBA 分别与0.10、0.15 和0.20g/L GA3共同处理时,发芽势随GA3浓度的升高呈先缓慢下降后上升的趋势;0.45 g/L IBA 分别与0.10、0.15 和0.20g/L GA3共同处理时,发芽势随GA3浓度的升高呈先缓慢上升后下降的趋势(图2b)。0.20 g/L GA3与0.15 g/L IBA共同处理时,发芽势最高。
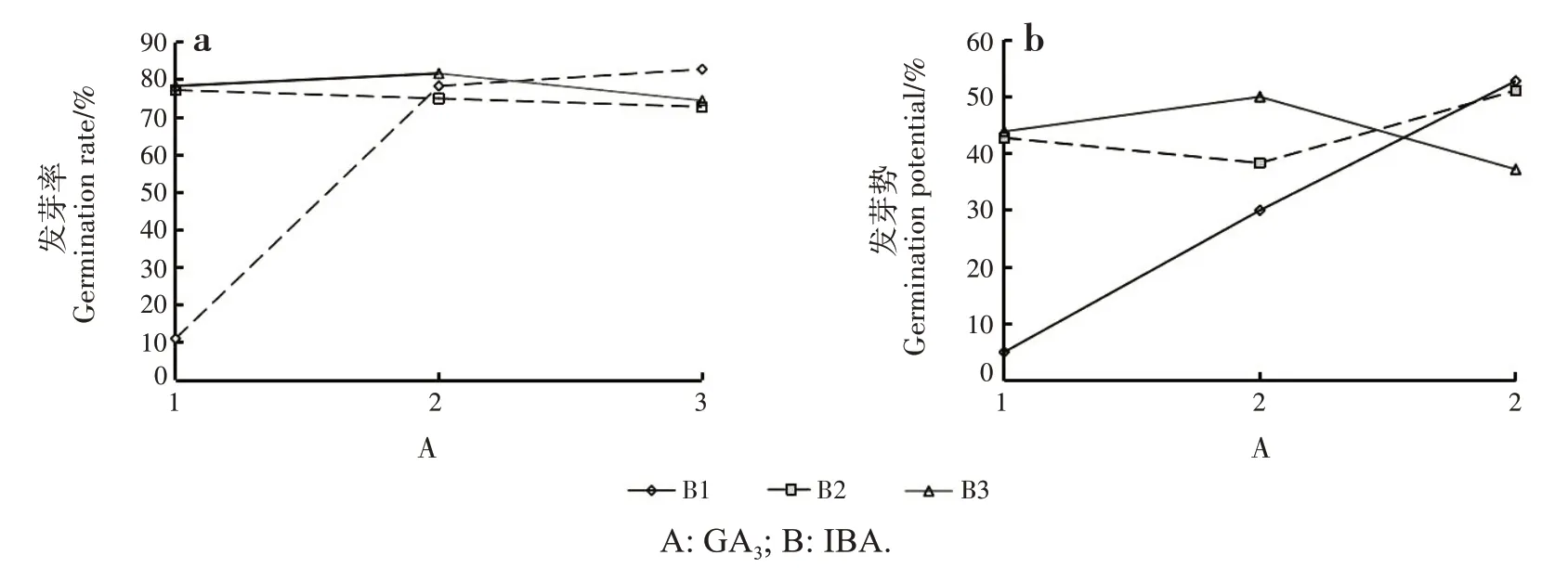
图2 GA3和IBA的交互作用对发芽率和发芽势的影响Fig.2 Effects of GA3 and IBA interaction on germination rate and germination potential
发芽率和发芽势交互作用分析结果证实,发芽指标的理论优水平组合与实际优水平组合间的差异主要是因为IBA 和GA3的交互作用,两种溶液适宜浓度组合处理可显著或极显著提高种子发芽性状。
3 讨论与结论
3.1 讨论
已有试验表明,GA3对种子发芽有重要影响[17]。陈婷等[18]对杜鹃(Rhododendronspp.)种子进行处理,发现300 ~700 mg/L GA3对5 种晚花的小白杜鹃(R.maculatum)、大白杜鹃(R.decorum)、桃叶杜鹃(R.an⁃nae)、长蕊杜鹃(R. stamineum)和九龙山杜鹃(R. ji⁃ulongshanense)种子的发芽率均有不同程度促进作用。闫艳华[19]进行曼陀罗(Datura stramonium)种子萌发试验,90 mg/L GA3处理种子24 h后,栽培和野生曼陀罗种子的发芽率均显著提高。GA3对薰衣草(La⁃vandula mairei)[20]、野生山樱桃(Cerasus serrulata)[21]、罗勒(Ocimum basilicum)[22]和金莲花(Trollius chinen⁃sis)[23]等多种植物种子发芽均有不同程度的促进作用。本研究中,不同浓度GA3溶液浸种对君迁子种子发芽率的影响与文献结论类似;0.15 g/L GA3浸种2 h 能极显著提高发芽率,进一步证实GA3可改变种子发芽性状,适宜浓度有益于种子发芽。
IBA 作为一种植物生长调节剂,也被应用于许多种子的发芽试验研究中。朱丽菲等[24]在盐胁迫下进行水稻(Oryza sativa)种子发芽试验,10 μmol/L IBA 处理能有效促进种子发芽。李秋等[25]在罗勒种子发芽试验中发现,25 mg/L IBA 浸种后,种子发芽率提高26.6%。赵莹等[26]发现,100 mg/L IBA浸泡长白松(Pinus syluestriformis)种子2 h,其发芽率和发芽势分别为53.66%和12.33%,是发芽最优的处理。IBA 还广泛应用于苦瓜(Momordica charantia)和葫芦(Lagenaria siceraria)[27]等多种植物的种子萌发试验中。本研究中,特定浓度的IBA 可极显著提高君迁子种子发芽率,与文献结论类似,揭示IBA对种子发芽的影响具有共同特性。君迁子种子发芽率随IBA 浓度升高而升高,本研究设置的最高浓度为0.45 g/L,继续提高IBA 浓度对种子发芽率的影响需开展进一步的试验研究。
王文俊等[28]指出,低浓度IBA(0.25 g/L)和高浓度GA3(1.00 g/L)与40 ~60 ℃温水组合依次浸种,可极显著提高催吐萝芙木(Rauvolfia vomitoria)种子的发芽率和发芽势。刘笛[29]研究指出,50 mg/L IBA 和50 mg/L GA3共同处理关苍术(Atractylodes japonica)种子,可有效提高其发芽率、发芽势和种子活力。翁琳琳等[30]研究表明,20 mg/L 6-BA 和300 mg/L GA3浸种36 h,七叶一枝花(Paris polyphylla)种子的发芽率高且胚根健壮。本试验的研究结果与文献结论类似,进一步说明GA3和IBA 共同处理可改变种子发芽性状,适宜浓度处理有益于种子发芽。除处理1 外,本研究中其他激素处理的君迁子种子发芽率均高于孙鹏等[9]和谢志兵等[10]单一外源激素处理,支持2 或3 种激素共同处理种子较单一激素处理更有益于种子发芽的结论。
KH2PO4是一种磷钾高效肥,可有效促进植物光合作用。目前,有关KH2PO4对种子发芽影响的报道较少,其主要用作叶面喷肥,可促进水稻[31-32]、枸杞(Lycium chinense)[33]和白花油茶(Camellia oleifera)[34]等多种植物苗期的生长。本试验中,结合KH2PO4溶液浸种的处理,发芽指标均较好;0.50% KH2PO4溶液浸种6 h 可极显著提高发芽率,此养分浸种对种子发芽性状的影响可继续开展试验研究。
君迁子种子发芽的文献较少,建议从多方面开展种子发芽和苗木培育试验,为树种壮苗培育奠定基础。
3.2 结论
采 用L9(34)正交试验设计,开展GA3、IBA 和KH2PO4不同浓度组合对君迁子种子发芽影响的试验。不同处理的发芽率、发芽势、平均发芽时间和发芽指数均值分别为11.11% ~82.78%、5.00% ~52.78%、14.70 ~30.95天和0.22 ~4.40粒/天,处理间各指标均呈现显著和极显著差异,处理2 ~9均有较好的效果;GA3和IBA 的交互作用是影响发芽指标的主导因子;极差分析显示,GA3、IBA 和KH2PO4分别为0.15 g/L、0.45 g/L 和0.50%,分别浸种2、2 和6 h,可提高种子发芽率。

