大豆GmSg-5 基因的克隆、序列分析及表达分析
沈悦,谈美霞,范姝姝,高浩竣,武文娟,王敏,杜维俊,赵晋忠,岳爱琴*
(1.山西农业大学 农学院,山西 太谷 030801;2.山西农业大学 基础部,山西 太谷 030801)
大豆皂苷是大豆生长发育过程中形成的一类重要次生代谢产物,根、茎、叶和种子等中均有分布。国内外研究表明,大豆皂苷不仅在植物中可引起植物自身的防御反应,使植物体具有抗菌、抗病毒和抗虫等抗性[1-3];而且具有抑癌[4]、抗氧化[5]等多种对人体有益的生理功能,可开发成药品或保健品。
大豆皂苷属于三萜类齐墩果酸型皂苷,由2 种皂苷元(大豆皂醇A 和大豆皂醇B)和β-D-葡萄糖、β-D-半乳糖等6 种糖基以及其乙酰化糖基等组成[6]。大豆皂苷根据其苷元不同分为A 类、DD⁃MP 类、B 类和E 类4 类[7-8]。其中A 类具有苦涩味,而且其生理活性低于DDMP 类、B 类和E 类皂苷[9-10]。因此,进一步解析A 类皂苷的代谢机制有利于改进大豆食品的口感和提高皂苷生物活性。大豆皂苷通过异戊二烯途径合成[11],首先通过甲羟戊酸途径合成大豆皂苷的结构单元异戊烯二磷酸(isopentenyl pyrophosphate,IPP),然后在环化酶、细胞色素P450、尿苷二磷酸糖基转移酶的催化作用下生成大豆皂苷[12]。其中细胞色素P450 多催化羟化反应,大豆皂苷元骨架β-香树脂醇在细胞色素P450 家族成员CYP72A61 和CYP93E1 的催化下,分别将β-香树脂醇C-22、C-24 位羟基化,形成大豆皂醇B[13-14]。大豆皂醇B 进一步在GmSg-5基因编码的CYP72A69 酶的催化作用下将C-21位羟基化从而形成大豆皂醇A[15]。因此,对大豆皂醇A 合成的关键酶基因GmSg-5的启动子序列和表达模式进行研究,可以为今后有目的改变大豆皂苷的组成提供理论基础。
目前对于大豆GmSg-5基因在大豆A 类皂苷合成途径中的序列分析及表达模式研究较少,因此,本文以晋遗30 为试验材料,利用生物信息学手段对大豆GmSg-5基因蛋白理化性质和启动子序列进行分析;采用荧光定量PCR 方法对GmSg-5基因组织表达模式、激素和胁迫诱导表达模式进行分析,为今后深入研究A 类大豆皂苷的合成及大豆品质改良提供参考。
1 材料与方法
1.1 试验材料
由山西农业大学大豆遗传育种课题组提供的大豆材料晋遗30 为研究对象。
2018 年种植大豆材料晋遗30 于山西农业大学农作站,开花期开花时间相同且在同一部位的花进行挂牌标记,分别取开花后25、32、40、50、60、70 d 籽粒,立即置于液氮,−80 ℃保存备用。
在25 ℃恒温培养箱中(光照16 h,黑暗8 h)水培养大豆材料15 d 至三叶完全展开,分别取根、茎、叶各2 份,1 份迅速置于液氮,−80 ℃保存用于组织表达分析,另1 份冷冻干燥用于测定A 类皂苷含量。
选取生长状态一致的大豆幼苗进行茉莉酸甲酯(MeJA)(450 μmol·L-1)、ABA(200 μmol·L-1)、NaCl(150 mmol·L-1)、H2O2(330 mmol·L-1)、PEG-6000(100 mmol·L-1)胁迫处理,同时以相同培养条件不进行胁迫处理的幼苗作为对照。MJ、ABA、H2O2、PEG 分别在处理后0、3、6、9、12、24、36、48 h取幼苗根、叶;NaCl 处理参照孙雪丽等[16]方法在0、4、8、12、24、48、72 h 取根、叶。每个样品3 次生物学重复。取样后立即置于液氮速冻,−80 ℃保存备用。
1.2 试验方法
1.2.1GmSg-5基因克隆
采用TRIzol 法提取总RNA,参照TransS⁃cript®One-Step gDNA Removal and cDNA 试剂盒进行反转录获得cDNA,参照NCBI 公布的GmSg-5基因序列(Glyma15g243300),利用Primer Pre⁃mier 5 设 计 引 物(GmSg-5-F1:5′-ATG⁃GAAGCAGCATGGGTCA-3′,GmSg-5-R1:5′-TTATTCATATTTCT-CCACCTTATGTAGA-3′)。以合成的cDNA 为模板,PCR 反应体系为总体积为15 μL,其 中2.1 μL cDNA 模 板(20 ng·μL-1),3 μL 5×buffer,引物各0.3 μL(10 μmol·L-1)、0.4 μL dNTP(10 μmol·L-1),0.3 μLTransStart FastP⁃fu(5 U),8.6 μL ddH2O。PCR 程 序 为95 ℃5 min;95 ℃1 min,52 ℃45 s,72 ℃2 min,32 次 循环;72 ℃10 min,15 ℃保存。在1.2%琼脂糖凝胶中检测扩增产物,回收目标片段,连接pEASYBlunt 载体并送生工测序。
1.2.2GmSg-5基因生物信息学分析
利 用GenBank Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行基因序列检索;利用Ex⁃PASy-Protparam(https://web.expasy.org/cgibin/protparam/protparam)分析GmSg-5 蛋白质理化性质;利用SOPMA(http://bip.weizmann.ac.il/bio tools/faq.html)进行蛋白质二级结构分析;利 用Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html)进行三级结构分析;利用Clustalw 软件对GmSg-5基因编码蛋白的氨基酸序列进行多序列比对;利用MG2C2.0(http://mg2c.iask.in/mg 2c_v2.0/)进行染色体定位;利用NetPhos3.1(http://www.cbs.dtu.dk/services/NetPhos/)进行蛋白质磷酸位点预测分析;利用在线软件Plant⁃CARE(http://bioinformatics.psb.ugent.be/webt⁃ools/plantcare/html/)预测启动子的顺式作用元件。
1.2.3 A 类皂苷的提取及测定
参考岳爱琴等[17]测定大豆皂苷的方法,采用HPLC-ESI-MS/MS 测定A 类皂苷各组分含量,样品中A 类皂苷含量为Aa、Au、Ax、Ay、Ae、Ag、Ab、Ac、Ad、Az、Af、Ah、A0-αg、A0-βg、A0-αa、A0-βa、A0-γg、A0-γa 各组分含量之和。
1.2.4GmSg-5基因表达分析
利用Bio-Rad CFX96 实时荧光定量PCR 仪,采 用 全 式 金TransStart®Tip Green qPCR Super⁃Mix 试剂盒进行荧光定量PCR。根据GmSg-5基因的序列,利用Primer Premier 6 软件设计实时荧光 定 量 PCR 引 物(GmSg-5-qF2:5′-TGCT⁃GATACTGATACTGGCTCT-3′,GmSg-5-qR2:5′-AATGTCTCC-TTCGTGTCCC-3′),Tubulin为 内参 基 因(GmTubulin-qF:5′-AACCTCCTCCT⁃CATCGTA-CT-3′,GmTubulin-qR:5′-GACAG⁃CATCAGCCATGTTCA-3′)。qRT-PCR 反应总体积为20 μL,含10 μL 2×Tip Green qPCR Super⁃Mix,0.4 μL dNTPs(2.5 mmol·L-1),引 物 各0.4 μL(10 μmol·L-1),ddH2O 6.8 μL,2 μL cDNA 模板。qRT-PCR 程 序 为94 ℃30 s;94 ℃5 s,60 ℃15 s,72 ℃10 s,45 次循环,3 次重复。采用2-△△CT法计算GmSg-5的相对表达量。
2 结果与分析
2.1 GmSg-5 基因的克隆
利用GmSg-5-F1/GmSg-5-R1 引物对GmSg-5基因进行扩增,电泳检测结果在1200~2000 bp之间有1 条清晰明亮的条带(图1)。序列分析结果显示,目的基因序列长度为1787 bp,包括107 bp 5′-UTR、1536 bp CDS 序列和144 bp 3′-UTR,编码511 个氨基酸,具有ECKLFY、WQAR、EVLR和PERF 基序(图2)。根据GmSg-5基因在染色体上的位置信息,绘制GmSg-5基因染色体分布图(图3),GmSg-5基因位于15 号染色体上。

图1 大豆GmSg-5 基因的克隆Fig.1 Amplified fragment of GmSg-5 gene in soybean

图2 大豆GmSg-5 蛋白与其他植物氨基酸序列的多序列比对Fig.2 Multiple alignment results of GmSg-5 proteins from different plant

图3 GmSg-5 基因的染色体定位分析Fig.3 Chromosome localization analysis of GmSg-5 gene
2.2 GmSg-5 基因编码蛋白理化性质分析
蛋白基本理化性质分析结果显示,GmSg-5基因编码蛋白质相对分子量为58.6 kD,理论等电点(pI)为8.95,不稳定指数为39.97,属于稳定蛋白。平均亲水性系数为−0.219,推测为亲水性蛋白。
GmSg-5 蛋白质二级结构预测结果显示,α-螺旋占得比例最大为52.25%,无规则卷曲占30.53%,延伸链和β-折叠分别占11.94% 和5.28%(图4)。三级结构分析结果显示GmSg-5蛋白质主要由HEME 和CPR 两个结构域构成(图5),CPR 结构域催化NAD(P)H 与H+反应失去电子生成NAD(P)+,HEME 结构域催化大豆皂醇B的C21 位R-H 与O2反应,将大豆皂醇B 的C21 位羟基化从而生成大豆皂醇B。磷酸化位点预测结果显示,该蛋白质含有22 个丝氨酸,11 个苏氨酸,5个酪氨酸磷酸位点(图6)。

图4 GmSg-5 蛋白的二级结构Fig.4 Prediction of secondary structure of GmSg-5
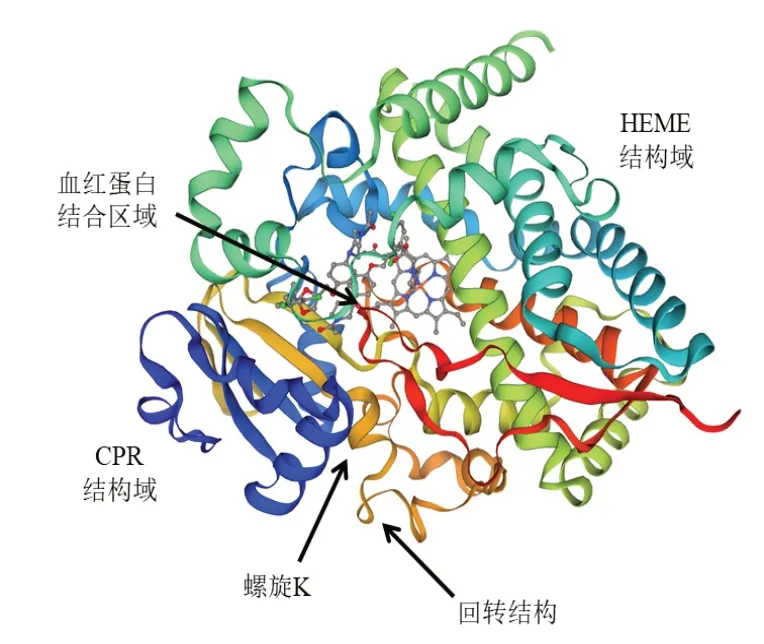
图5 GmSg-5 蛋白的三级结构Fig.5 Predicted tertiary structure of GmSg-5

图6 GmSg-5 磷酸化位点预测Fig.6 Pridiction of phosphorylation sites in GmSg-5
2.3 GmSg-5 启动子顺式作用元件分析
对GmSg-5基因起始位点ATG 上游2 000 bp的启动子序列进行了顺式作用元件的预测和分析,结果显示GmSg-5基因启动子有ARE、MYB、WUN-motif 等 逆 境 响 应 元 件,CGTCA-motif、TGA-element、TGACG-motif 等 激 素 响 应 元件(表1)。

表1 GmSg-5 启动子中的顺式作用元件Table 1 Cis-acting elements in GmSg-5 promoter
2.4 GmSg-5 基因的表达分析
2.4.1GmSg-5基因不同组织表达模式分析
采用HPLC-ESI-MS/MS 法对根、茎、叶不同组织A 类皂苷含量进行测定。结果显示根中A 类皂苷含量最高为19.4 mg·g-1,显著高于茎中A 类皂苷含量(图7)。

图7 不同组织中A 类皂苷含量Fig.7 The content of group A saponins in different organs
GmSg-5基因的组织表达模式结果表明GmSg-5基因在根、茎、叶中均有表达,其中根中相对表达量最高,叶次之,茎最低(图8),与根、茎、叶中A 类皂苷含量趋势一致。
2.4.2GmSg-5基因籽粒发育过程表达模式分析
采用HPLC-ESI-MS/MS 法对不同发育时期大豆籽粒A 类皂苷含量进行测定。结果显示A 类皂苷含量呈先增高后降低的趋势,开花后40 d 和50 d 籽粒中A 类皂苷含量最高(图9)。

图9 不同时期大豆籽粒中A 类皂苷含量Fig.9 The content of group A saponins in different periods
对GmSg-5基因在晋遗30 不同发育时期籽粒中的表达进行分析(图10)。GmSg-5基因在籽粒不同发育时期的表达呈现先增高后降低的趋势,在开花后50 d 籽粒中GmSg-5基因表达量最高。不同发育时期GmSg-5基因表达差异与A 类皂苷含量差异趋势一致。
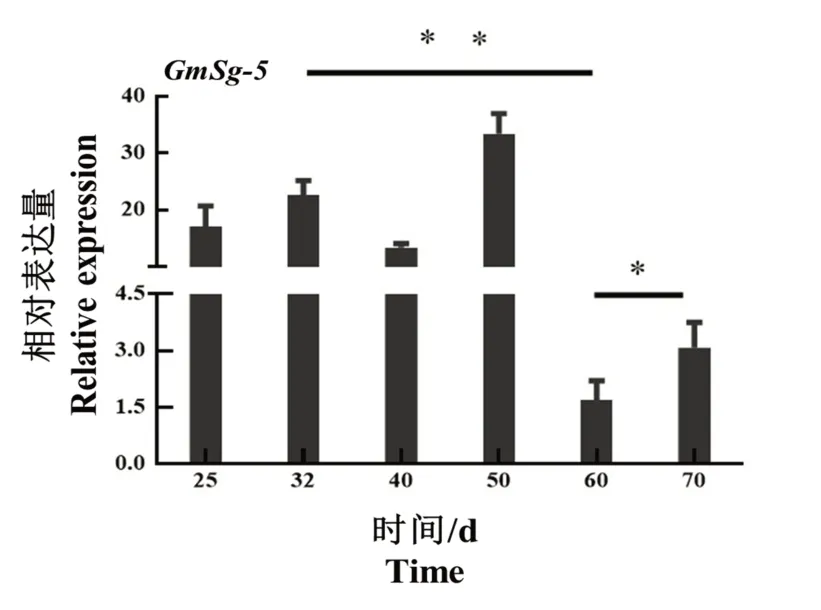
图10 GmSg-5 在籽粒不同发育时期的表达分析Fig.10 Expression analysis of GmSg-5 in seeds at different devel⁃opmental stages
2.4.3GmSg-5基因对胁迫的响应分析
为探究GmSg-5是否与激素和逆境响应相关,对大豆幼苗进行MJ、ABA、H2O2、PEG 和NaCl 胁迫处理,检测处理不同时间该基因的表达情况。
MJ 处理后,根中GmSg-5基因相对表达量呈持续上调趋势,处理3 h 和6 h 时表达量显著高于对照,3 h 上调最显著,6 h 达到峰值,约为对照的2.4 倍(图11A)。叶中GmSg-5基因相对表达量呈先升后降的趋势,3 h 显著高于对照,6 h 和9 h 显著低于对照(图11B)。
ABA 激素处理条件下,根中GmSg-5基因呈持续上调趋势,36 h 达峰值,约为对照的225.4 倍(图11C);而叶中相对表达量受到显著抑制(P<0.05),48 h 达最 低值,约为对照的0.05 倍(图11D)。
H2O2处理下,根和叶中GmSg-5基因相对表达量均呈先抑制后上调的趋势。其中根中胁迫3 h时GmSg-5基因表达显著下调,24 h 开始显著上调,48 h 达到峰值,约为对照的5.7 倍;叶中H2O2胁迫呈持续上调的趋势,24 h 达到峰值,约为对照的36.5 倍(图11E,图11F)。
PEG 处理下,胁迫3、12 h 时根中GmSg-5基因表达显著下调,6 h 后相对表达量无明显的变化趋势(图11G);叶中相对表达量呈持续上调的趋势,12 h 显著上调(P<0.05)并达到峰值,约为对照组的228.6 倍(图11H)。
NaCl 处理下该基因相对表达情况显示,根中GmSg-5基因相对表达量呈持续显著上调趋势,24 h 最大约为对照组的41.5 倍(图11I);叶中相对表达量呈先下调后上调趋势,48 h 达最大值,约为对照组的15.4 倍(图11J)。

图11 激素及非生物胁迫处理下GmSg⁃5 基因表达分析Fig.11 Relative expression of GmSg-5 gene under hormone treatment and abiotic stress
3 讨论
GmSg-5基因是大豆A 类皂苷合成的关键酶,Yano 等[15]通 过 遗 传 定 位 分 析 发 现 大 豆15 号 染 色体上的GmSg-5基因编码的细胞色素蛋白CYP72A69,可以将大豆皂醇B 的C21 位羟基化,合成大豆皂醇A,但未对GmSg-5基因蛋白质结构进行分析。本研究对GmSg-5基因蛋白质结构分析发现其二级结构主要由α-螺旋和无规则卷曲构成,三级结构主要由HEME 和CPR 两个结构域构成。张玲玲等[18]通过研究细胞色素P450 脂肪酸单加氧酶P450BM3 结构与功能的关系,也发现真核细胞中的细胞色素蛋白大多含有HEME 和CPR两个结构域。GmSg-5基因蛋白质磷酸位点预测结果显示含有38 个磷酸位点,推测该基因可能在这些磷酸化位点处发生磷酸化,从而调节该蛋白质的活性。
通过qRT-PCR 分析GmSg-5基因组织差异模式,结果显示该基因在根中相对表达量最高,其次是叶、茎,这结果与前人的研究结果相符[19]。Rehman 等[19]分 析 了 来 自 大 豆 中 的11 个CYP72A基因在花、茎顶端分生组织、叶、根、根毛、豆荚和结节中的相对表达情况,发现这些基因在根中的表达量最高,在花、叶、茎顶端分生组织中的表达量最低。对GmSg-5基因籽粒不同发育时期的表达进行分析,结果显示GmSg-5基因的表达呈现先增高后降低的趋势,在开花后50 d 籽粒中GmSg-5基因表达量达到最大。籽粒不同发育时期GmSg-5基因的表达与A 类皂苷的积累基本一致,本研究进一步说明GmSg-5基因在A 类皂苷代谢中起着关键作用。
研究发现植物中皂苷含量水平受外界因素影响显著,如温度,光照,水等[20]。Mao 等[21]在研究拟南芥中细胞色素CYP709B亚族中的CYP709B 1、CYP709B2和CYP709B3的突变体对盐胁迫的响应时,发现盐胁迫诱导了CYP709B3基因的表达。Koo 等[22]研究发现CYP94B 和CYP94C 可被干旱、盐胁迫等胁迫诱导。但目前还没有关于大豆A 类皂苷合成的关键酶基因GmSg-5应对非生物胁迫及激素诱导下响应情况的相关研究。本研究对GmSg-5基因的启动子序列进行了顺式作用元件的预测和分析发现该基因的启动子含有胁迫响应、伤害响应、激素响应等多种顺式作用元件,表明GmSg-5基因可能参与调控复杂的非生物胁迫响应。进一步利用qRT-PCR 方法分析激素和胁迫诱导表达模式分析发现H2O2、PEG 和NaCl 胁迫处理均诱导了根和叶中GmSg-5基因的表达;激素MJ、ABA 处理诱导根中GmSg-5基因的表达,且抑制叶中该基因的表达。本研究结果表明GmSg-5基因在逆境胁迫及激素诱导中起正调节因子的作用。
4 结论
GmSg-5基因编码蛋白主要由HEME 和CPR两个结构域构成,共检测到38 个磷酸位点。GmSg-5基因启动子有ARE、MYB、CGTCA-mo⁃tif 等逆境响应和激素响应元件。GmSg-5基因在苗期不同组织和籽粒不同发育时期均有表达,其表达与A 类皂苷含量基本一致。GmSg-5基因参与 响 应H2O2、PEG 和NaCl 非 生 物 胁 迫 及MJ、ABA 激素诱导。

