哺乳动物胚胎滞育及其调控机制研究进展
刘俊 张培君 李松海
(1 中国科学院深海科学与工程研究所,海洋哺乳动物与海洋生物声学研究室,三亚 572000)
(2 中国科学院大学,北京 100049)
1 胚胎滞育的生物学意义及外部环境诱导因素
胚胎滞育是动物在着床前胚胎发育可逆性暂停的一种状态,也称为不连续发育,迄今已有160 多年的研究历史,胚胎滞育在早期研究中称为“延迟着床”(Delayed implantation) (Lopeset al.,2004)。Ziegler (1843) 和Bischoff (1854) 发现欧洲狍(Capreolus capreolus) 交配后,与正常的胚胎发育过程不同(图1),在胚胎着床前会有很长一段时间的“静止期”,“静止期”内囊胚几乎停止发育,度过这段“静止期”后,囊胚正常着床,因此有了“延迟着床”一说。

图1 哺乳动物胚胎发育模式示意图(参考Renfree and Fenelon,2017;Shahbazi,2020)Fig. 1 Schematic diagram of mammalian embryo development (re‐ferred from Renfree and Fenelon,2017;Shahbazi,2020)
在1980 年第二届胚胎滞育研讨会上,科研人员一致决定统一采用“胚胎滞育”来描述这个状态(Flint and Renfree, 1981)。胚胎滞育主要分为两种类型,兼性滞育和专性滞育。兼性滞育通常发生于幼仔出生后哺乳期与交配期重叠的物种中,如有袋目(Marsupialia)、啮齿目(Rodentia) 和鼩鼱科(Soricidae) 中(Hill, 1900; Brambell, 1935; Sel‐wood, 1980; Renfree, 1981; Gilbert, 1984; Nelson and Goldstone, 1986; Hodaraet al., 1989; Ward,1990; Newkirket al., 1997; Smith, 1998; Johnson and Delean, 1999; Delean and Johnson, 2002);专性滞育通常出现于有着严格季节性繁殖的物种中,主要受季节性光周期影响,如美洲水貂(Neovison vison)、欧洲狍和绝大多数的海狮科(Otariidae)、海豹科(Phocidae) 动物等(Ziegler, 1843; Bischoff,1854; Harrison, 1963;Atkinson, 1997)。但专性滞育也有特殊案例——翼手目(Chiroptera)。某些翼手目动物,如伏翼(Pipistrellus pipistrellus)、大鼠耳蝠(Myotis myotis) 和肿鼻蝠(Corynorhinus rafin‐esquei),其胚胎滞育受温度调控(Mead,1993)。胚胎滞育广泛存在于啮齿目、食肉目(Carnivora) 和有袋目中,偶存于鲸偶蹄目(Cetartiodactyla)、真盲缺目(Eulipotyphla)、披毛目(Pilosa)、翼手目和有甲目(Cingulata),目前科研人员已在130 余种哺乳动物中发现了胚胎滞育现象(表1)。
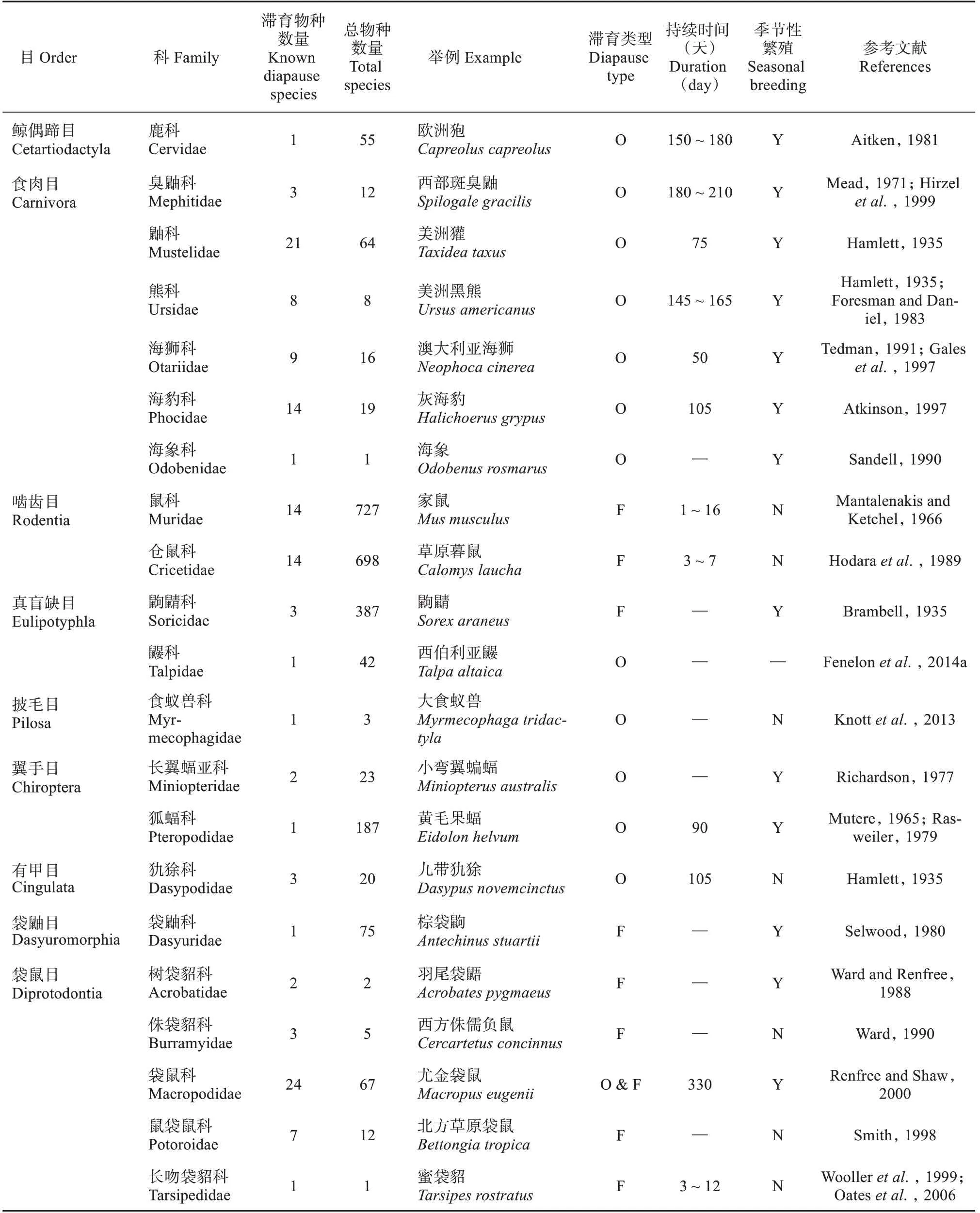
表1 已知有胚胎滞育的哺乳动物(数据主要参考Fenelon et al.,2014a;Renfree and Fenelon,2017;Deng et al.,2018)Table 1 Mammals that were reported to have embryonic diapause(Data is mainly referred and modified from Fenelon et al.,2014a;Renfree and Fenelon,2017;Deng et al.,2018)
胚胎滞育的生物学意义是让后代出生在最有利于生存的环境下,以提高后代的存活率(Fenel‐onet al., 2014a; Renfree, 2015)。兼性滞育的小鼠(Mus musculus) 在哺乳期发生交配受精,为了保证胚胎营养供给不受哺乳影响,早期胚胎会在较高水平的催乳素刺激诱导下进入胚胎滞育状态(Renfree and Fenelon, 2017);专性滞育的欧洲狍利用胚胎滞育度过寒冷和缺乏食物的冬天,让后代出生在万物复苏的春季以保证幼兽在生长过程中的食物供给,提高后代存活率(Mead,1993)。
胚胎滞育的外部诱导因素主要包括哺乳、营养、应激、光周期和温度等。兼性滞育一般由哺乳引起,滞育时间长短取决于吮吸母乳幼仔的数量,一般持续1~14 d (Weichert, 1940; Mantal‐enakis and Ketchel, 1966; Pritchett-Corninget al.,2013)。此外,如果生存环境压力增大,如生活环境拥挤或者引入新的雄性竞争者,激发了动物的本能应激反应,也会诱发啮齿动物的兼性滞育(Marois, 1982)。光周期是专性滞育的重要调控因素。如春分后,白昼的延长会诱导北半球的鼬科(Mustelidae) 动物终止胚胎滞育(Pear‐son and Enders, 1944)。然而,光周期调控对不同物种的作用也可能相反,如随着日照时间逐渐减少,海豹科动物则会选择终止其胚胎滞育(At‐kinson, 1997)。也有研究证明,光周期调控与松果体密切相关,松果体(分泌褪黑激素,抑制垂体促卵泡激素和黄体生成素的分泌) 的活动随着光照的变化表现出明显的周期性。Bonnefond 等(1990) 通过切除松果体并人为控制褪黑素持续时间的实验证实了松果体在维持美洲水貂胚胎滞育中具有重要作用。同时,温度在调控翼手目胚胎滞育中具有显著作用(Wimsatt, 1975);而食物营养则会对欧洲獾(Meles meles) 的滞育时间产生影响(Fergusonet al., 1996)。
2 胚胎滞育的激素调控
通过大量研究,科研人员已初步建立滞育物种的激素调控网络,认为胚胎滞育的发生、维持和再激活取决于催乳素、孕酮或者雌激素的相对水平。但存在一个特殊案例——欧洲狍,其胚胎滞育不受催乳素、孕酮和雌激素相对水平的调节(Drewset al., 2019)。不同哺乳动物物种间胚胎滞育的激素调控方式存在明显差异,下面本文通过模式物种来讨论两种滞育类型的调控机制。
2.1 兼性滞育的激素调控
兼性滞育在啮齿动物中较为常见(表1),研究的模式物种为小鼠和大鼠(Rattus norvegicus)。雌性小鼠通常会在分娩后继续与雄性交配,受精卵在交配后的第4 天发育至囊胚阶段(Mclaren,1968;Harper, 1982),母鼠哺乳会引起催乳素水平升高,催乳素的增加会抑制怀孕小鼠雌激素的激增,导致囊胚进入滞育(Psychoyos, 1974; Renfree and Fe‐nelon,2017)(图2)。

图2 小鼠兼性滞育的激素调控Fig.2 Hormone regulation of facultative diapause in mouse
在怀孕小鼠雌激素激增之前,人工切除卵巢和注射雌激素受体抑制剂都会导致囊胚延迟着床(Weitlauf and Greenwald, 1968; Pariaet al., 1993) 。小鼠囊胚的再活化(终止胚胎滞育) 也可通过人工手段实现,有3 种方式:(1) 通过注射多巴胺激动剂溴隐亭(Bromocriptine),抑制催乳素的释放,使囊胚再活化(Flint and Renfree,1981);(2)通过移除幼仔使卵巢中出现短暂的雌激素激增,刺激囊胚再活化(Psychoyos, 1974; Deyet al., 2004);(3) 注射雌二醇也能使囊胚再活化(Yoshinaga and Adams,1966;Mclaren,1968)。虽然催乳素和雌激素都是小鼠和大鼠胚胎滞育的重要调控因子,但只有雌激素能激活滞育的囊胚。
2.2 专性滞育的激素调控
专性滞育在食肉动物中较为常见(表1)。专性滞育研究的模式物种是美洲水貂(Fenelonet al.,2017a,2017b)。美洲水貂为驯化物种,相比其他专性滞育的食肉动物,如海豹科、熊科(Ursidae) 动物和野生鼬等,更容易获得实验样本,控制实验操作。
在迄今发现的大多数专性滞育动物中,胚胎滞育主要受光周期的季节性变化调控(Pearson and Enders, 1944; Mead, 1971;Atkinson, 1997)。美洲水貂的交配时间大约在每年2 月底到3 月初,此时昼短夜长,而夜间动物褪黑激素水平较高,导致催乳素水平低,囊胚进入滞育;春分后随着日照时间增加,褪黑激素水平降低,催乳素增加,随后卵巢孕酮合成增加,滞育终止(Murphy and James,1974;Murphyet al.,1981)(图3)。研究发现只有催乳素能实验性终止美洲水貂滞育,孕酮和雌二醇不具有相同效果(Papkeet al.,1980;Murphyet al.,1981; Stouffletet al., 1989)。由此说明,催乳素是控制美洲水貂胚胎滞育的关键激素。

图3 食肉动物专性滞育的激素调控(参考自Lopes et al., 2004;Murphy,2012;Deng et al.,2018,有修改)Fig.3 Hormone regulation of obligate diapause in carnivore(referred and modified from Lopes et al., 2004; Murphy, 2012; Deng et al.,2018)
2.3 两种滞育模式同时存在的激素调控
与其它有袋动物不同,生活在南半球的尤金袋鼠(Macropus eugenii) 是有袋动物胚胎滞育中最特殊的物种,同时具有兼性滞育和专性滞育2种类型,这2 种类型的滞育分布在不同的时间段(Tyn‐dale-Biscoe and Renfree, 1987)。尤金袋鼠2 种类型的滞育都是由高浓度水平的催乳素引起(Hinds,1989;Hinds and Tyndale-Biscoe,2013)。滞育时,首先启动的是兼性滞育。尤金袋鼠通常在1月(南半球)交配和妊娠,哺乳幼仔会促进母体催乳素的释放,高水平的催乳素会抑制黄体分泌孕酮,囊胚进入滞育。若在1—5 月幼仔丢失,这种催乳素抑制作用消除,黄体释放孕酮重新激活胚胎(Hinds and Tyndale-Biscoe, 1982, 2013; Hinds, 1989)。兼性滞育结束后,胚胎仍会处于滞育状态,此时进入光周期诱导的专性滞育模式,直到南半球夏至日(12月21—22日)之后,日照时间慢慢缩短,褪黑素浓度增加,催乳素浓度受到抑制,孕酮抑制解除,囊胚再激活,滞育时间长达11 个月(Renfree,1994)(图4)。

图4 尤金袋鼠滞育模式的激素调控(参考自Lopes et al., 2004 和Deng et al.,2018,有修改)Fig.4 Hormone regulation of embryonic diapause in tammar wallaby(referred and modified from Lopes et al.,2004;Deng et al.,2018)
尽管催乳素在美洲水貂和尤金袋鼠的胚胎滞育中起关键调控作用,但在2 个物种中的作用却相反。在美洲水貂中,催乳素在滞育期间刺激黄体分泌孕酮;而在尤金袋鼠中,催乳素抑制黄体分泌孕酮(Murphy and James, 1974; Murphyet al.,1981; Hinds, 1989; Hinds and Tyndale-Biscoe,2013)。
3 胚胎滞育的分子调控
3.1 概述
胚胎滞育的分子调控主要涉及子宫内膜和囊胚之间多种因素和信号通路的协调,非常复杂。目前胚胎滞育研究大部分停留在生化层面,分子调控方面的研究有限,胚胎滞育的启动、维持和囊胚再激活的分子机制尚不明确(Shaw and Ren‐free, 1986; Renfree and Shaw, 2000, 2014; Murphy,2012;Fenelonet al.,2014a),不足以系统阐述胚胎滞育的调控机制。最新研究表明,子宫分泌物中的多种小蛋白,包括营养物质、蛋白酶、激素、细胞因子、生长因子和转录因子,都有可能调控胚胎发育,使胚胎进入或退出滞育(Renfree and Fenelon, 2017)。随着转录组学开始应用于胚胎滞育分子机制研究,Hamatani 等(2004) 分析了小鼠囊胚在滞育期和胚胎再激活时的基因差异表达情况,结果表明在20 000个基因中,存在229个差异表达基因,其中有80个基因在滞育期高表达,149个基因在囊胚激活时高表达,这些差异性表达基因的功能主要跟细胞周期、细胞信号和能量代谢途径有关;研究还发现了一些特定信号通路,如肝素结合表皮生长因子(heparin-binding epidermal growth factor, HB-EGF) 信号通路。在对美洲水貂胚胎滞育和早期再激活两个时期转录组比较中,发现了94 个基因在囊胚激活时高表达(Fenelonet al.,2016)。
目前胚胎滞育分子机制的研究主要集中在3个物种:小鼠、美洲水貂和尤金袋鼠,分别代表了3 种不同类型的滞育方式。下面本文将从诱导和维持滞育、囊胚再激活和着床两个方面分别阐述已有研究结果中不同分子因素的调控作用。
3.2 诱导和维持滞育
许多基因在胚胎的发育和滞育中起着重要作用。研究发现在小鼠、美洲水貂和尤金袋鼠中都存在两个潜在的候选基因:叉头框O(forkhead box O,FOXOs) 亚家族和周期素依赖性激酶抑制因子1A (cyclin dependent kinase inhibitor 1A,CDKN1A)(图5) (Hamataniet al., 2004; Fenelonet al., 2017b;Renfree and Fenelon,2017)。Lopes等(2004)推测细胞周期调控机制是通过有丝分裂阻滞控制哺乳动物囊胚进入滞育状态,并通过有丝分裂的重新启动控制滞育的激活,滞育的启动和维持由CD‐KN1A表达引起,这种抑制因子会干扰细胞周期蛋白(E-cdk2) 的形成,可能诱导细胞在G0 或G1 期停止有丝分裂,并且FOXOs亚家族转录因子通过上调CDKN1A的表达维持这种作用。
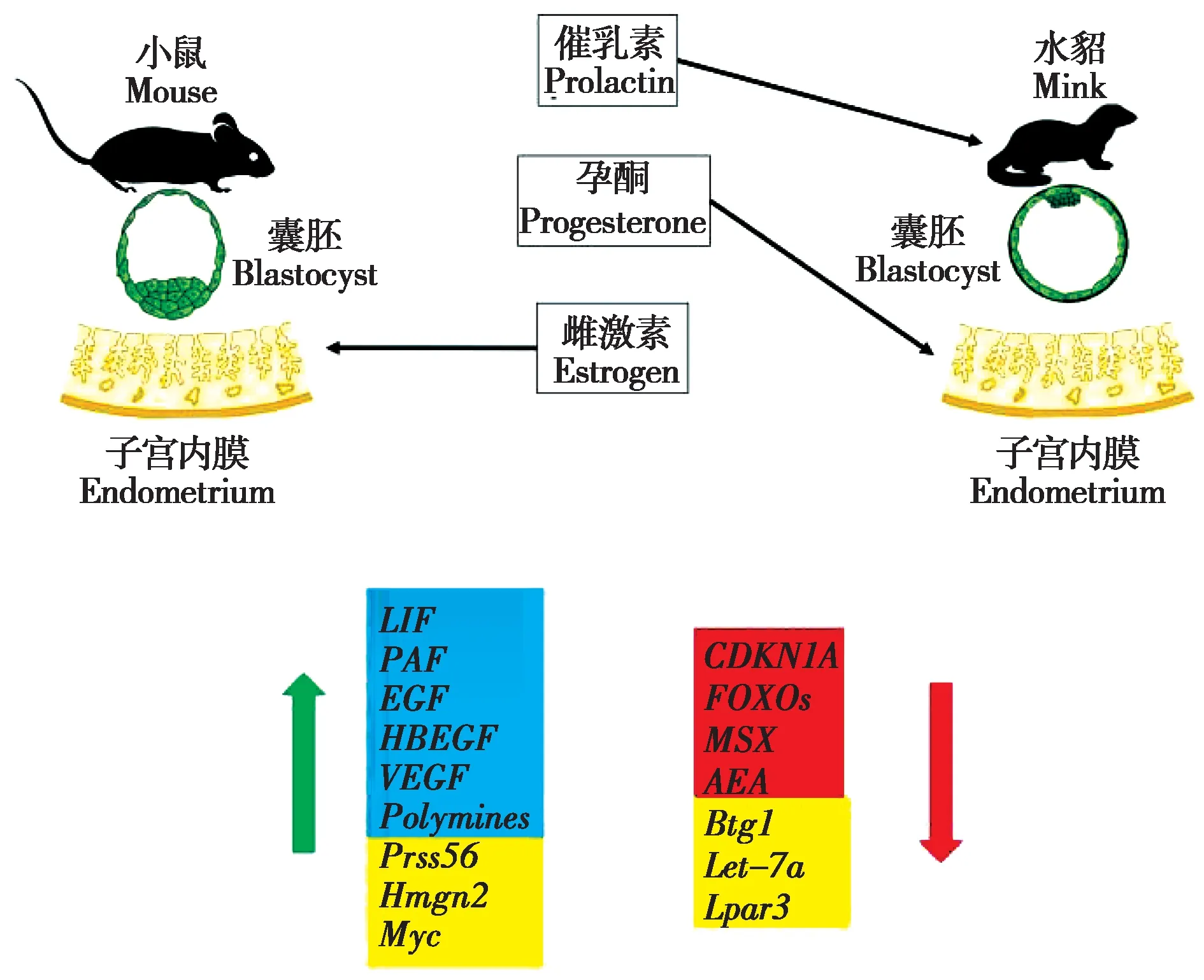
图5 胚胎滞育激活时子宫与囊胚之间分子信号的变化. 黄色区域的分子只在小鼠实验中验证,蓝色和红色区域的分子在小鼠和美洲水貂中已实验验证;绿色箭头表示上调,红色箭头表示下调(参考Liu et al., 2012, 2017; Cha et al., 2013; Diao et al., 2015; Scog‐namiglio et al., 2016; Fenelon et al., 2017b; Li et al., 2017; Renfree and Fenelon,2017)Fig. 5 Changes in molecular signals between uterus and blastula dur‐ing activation of embryonic diapause. Molecules in the yellow region have been tested only in mice, while those in the blue and red regions have been tested in mice and minks. The green arrow means up-regula‐tion and the red arrow means down-regulation (referred from Liu et al., 2012, 2017; Cha et al., 2013; Diao et al., 2015; Scognamiglio et al., 2016; Fenelon et al., 2017b; Li et al., 2017;Renfree and Fenelon,2017)
古老又高度保守的肌节同源盒基因Msx1和Msx2是调控滞育的两个关键因素,Msx1和Msx2基因的表达与子宫腔上皮细胞极性改变有关,并通过Wnt5a(wnt family menber 5A) (Wnt 家族中的重要成员之一,Wnt 信号通路参与成体细胞增殖、分化和凋亡过程)的介导来影响钙粘附蛋白(E-cad‐herin)和b-连环蛋白(b-catenin)的形成,从而影响子宫接受能力(Daikoku,2011)。在小鼠、美洲水貂和尤金袋鼠胚胎滞育期间,Msx1或Msx2基因在胚胎滞育期持续表达,囊胚再激活和着床后表达量迅速下调(图5),并且小鼠子宫中Msx1和Msx2基因被条件性敲除后,小鼠将不能进入滞育和再次激活(Chaet al.,2013)。
miRNA 通过与mRNA 的交互作用间接影响基因表达,因此也可能参与调控胚胎滞育。研究发现在小鼠胚胎滞育期间和重新激活后至少有45 个miRNA 差异表达,其中38 个miRNA 在滞育期表达上调(Liuet al., 2012)。值得注意的是小鼠通过增加Mirlet7a-1(microRNA let7a-1) 的丰度来调控Dicer 酶(核酸内切酶) 和整合素b3 (Integrin-b3) 的表达,从而达到抑制囊胚着床的目的(Liuet al.,2012; Cheonget al., 2014) (图5) ,并且Mirlet7a-1的靶基因参与调控细胞增殖(Gurtanet al.,2013)。
溶血磷脂酸受体3 蛋白(LPAR3) 是溶血磷脂酸(lysophosphatidic acid, LPA) 的第三个G 蛋白偶联受体,研究显示Lpar3基因的缺失会导致孕酮信号(雌激素信号) 的比例增加,使小鼠囊胚延迟着床(Diaoet al.,2015)(图5)。
3.3 囊胚再激活和着床
表皮生长因子(epidermal growth factor, EGF)家族在囊胚的再激活过程中起着重要作用。肝素结合表皮生长因子(HB-EGF) 是EGF 家族成员之一,已有研究显示HB-EGF在小鼠滞育后激活时期的子宫内膜中有表达(Daset al., 1994)。近几年,新的研究发现EGF 和HB-EGF 都会在美洲水貂和尤金袋鼠这两个物种中表达,与滞育状态相比,在胚胎再激活时HB-EGF 和EGF 的表达水平均显著上调(Fenelonet al.,2017b)(图5)。
血小板活化因子(platelet-activating factor,PAF)是一种通过血小板活化因子受体(platelet acti‐vating factor receptor,PTAFR) 发出信号的磷脂(Fe‐nelonet al.,2014b)。PAF普遍存在于已研究的真兽亚纲(Eutheria)动物中,在胚胎着床前通过胚胎合成并释放,如小鼠、兔子、羊、仓鼠、人和有袋动物(Ammit and O’Neill, 1991; Battyeet al., 1991;Minhaset al., 1993;Velasquezet al., 1995; O’Neill,2005;Fenelonet al.,2014b)。子宫内膜PAF 的释放受孕酮和雌二醇控制(Chamiet al.,1999),PAF 和PTAFR可能参与囊胚的再激活(图5) (Fenelonet al.,2014b)。
血管内皮生长因子(vascular endothelial growth factor, VEGF) 是一种具有旁分泌机制的细胞生长因子,能特异作用于血管内皮细胞,促进其增殖及新生血管的形成,同时还有增加血管通透性的作用(Kecket al., 1989;Ferrara and Davis-Smyth,1997)。在美洲水貂子宫中VEGF亚型及其受体Flt-1和KDR在滞育激活后期和着床时表达量会显著上调(图5),而且VEGF 的激活受前列腺素E2(PGE2)的调控(Lopeset al.,2003,2006)。VEGF 在小鼠囊胚着床前胚胎发育过程中起着关键作用,对囊胚细胞数量、着床率及胎儿肢体发育均有积极的影响(Binderet al.,2014)。
子宫内膜蜕膜化和胚胎着床是成功生殖的关键。丝氨酸蛋白酶基因(Prss56) 在滞育期间不表达,仅在胚胎再激活时在子宫蜕膜化位置高表达(图5),HB-EGF 可在蜕膜化过程中通过表皮生长因子受体(epidermal growth factor receptor, EGFR)通路诱导Prss56基因的活化,参与小鼠子宫的蜕膜化(Liuet al.,2017)。
小鼠子宫中高迁移率族核小体结合结构域2(high mobility group nucleosomal binding domain 2,Hmgn2) 是非组蛋白Hmgn 家族成员,与Prss56相似,Hmgn2基因在着床过程中表达增加(图5)。在子宫腔上皮细胞中,通过特异性siRNA 沉默Hmgn2基因可降低黏附分子钙粘蛋白1(Cdh1)、神经钙黏附蛋白(Cdh2)和β-连环素(Ctnnb1)的表达,而构建性激活Hmgn2则表现出相反的效果,提示Hmgn2参与胚胎着床过程中的粘附反应(Liet al.,2017)。此外,高迁移率族蛋白b1 (Hmgb1) (Aika‐waet al.,2019)、可溶性抗性相关钙结合蛋白(Sor‐cin) (Guptaet al., 2018)、促微管蛋白聚合蛋白3(TPPP3) 和β-连环蛋白(β-catenin) (Shuklaet al.,2018)也是着床和建立妊娠所需的重要蛋白。
着床窗口期开关的调节是哺乳动物成功妊娠的关键因素。孕酮通过上调转录因子Hand2(心脏和神经嵴衍生物表达转录本2)的表达通过一系列反应最终抑制小鼠子宫腔上皮细胞增殖,使小鼠子宫对囊胚具有接受性。囊胚附着在子宫腔上皮后,子宫内膜蜕膜化开始,着床部位开始局部产生雌激素,然后通过胰岛素样生长因子结合蛋白3(Igfbp3) 的作用进一步加强胰岛素样生长因子1(Igf1)的功效,促进子宫腔上皮细胞增殖,使小鼠子宫转变为非接受态,着床窗口关闭(Kobayashiet al.,2017)。
多胺(Polyamines)是广泛存在于哺乳动物组织细胞中的小分子有机化合物,其代谢的变化可能在诱导或维持滞育状态上发挥作用(Fenelon and Murphy, 2019)。多胺来源丰富,可从氨基酸、肠道细菌、脱落的肠细胞和食物等途径获得,包括精胺、亚精胺、胍丁胺和腐胺等,它们都参与调控胚胎滞育。多胺在子宫腔上皮细胞增殖、生长和分化过程中发挥着重要作用。胚胎滞育期间,多胺的产量会受到抑制,从而抑制子宫腔上皮细胞的增殖分化,维持滞育。相反人为降低多胺的含量会使结束滞育的美洲水貂胚胎重新进入滞育状态(Fenelonet al.,2016;Hussainet al.,2017)。科研人员发现参与多胺合成的3 种酶的基因(ODC1、AZIN1和SAT1)在美洲水貂滞育期间的子宫和胚胎中表达水平都较低,从而抑制多胺的产生(Lefevreet al.,2011;Fenelonet al.,2016),另有研究发现多胺的产生会受到鸟氨酸脱羧酶(ornithine decarbox‐ylase,ODC,是多胺生物合成途径中的第一个限速酶,能催化细胞内鸟氨酸脱羧转化成腐胺)的调控(Bachrach, 2010)。用二氟甲基鸟氨酸(difluoro‐methylornithine, DFMO) 抑制ODC1,可导致囊胚重新进入滞育状态(Lefevreet al., 2011)。在最近的一项美洲水貂研究中,科研人员发现催乳素通过磷酸化信号传导及转录激活因子1 (pSTAT1) 或雷帕霉素靶蛋白(mTOR,一种丝氨酸/苏氨酸激酶,mTOR 信号通路具有促进物质代谢、参与细胞凋亡、自噬等功能)来诱导ODC1基因在子宫内表达上调,从而提高子宫中多胺水平来结束滞育(Fe‐nelonet al.,2016)。此外,科研人员通过全局基因表达分析和腐胺离体实验证实了多胺对胚胎滞育的影响。同时,在小鼠中,科研人员发现通过抑制ODC1基因可以减少多胺合成(Fenelon and Mur‐phy, 2017),且当雌激素诱导胚胎重新激活时,多胺合成相关基因如ODC1、SAT1、SAMDC、AZI、SMS和SMOX在子宫基质中上调(图5) (Zhaoet al., 2008)。这些研究结果表明,子宫中多胺的代谢是胚胎滞育的关键影响因素。
内源性大麻素(Endocannabinoid) 在调节小鼠胚胎滞育再激活过程中也有重要作用。有证据表明,大麻素(Anandamide/AEA,一种主要的内源性大麻素)可通过大麻素受体(CB1)调节丝裂原激活蛋白激酶信号和钙离子通道活性来调节囊胚的植入。低水平的大麻素能在不影响钙离子通道活性的前提下通过丝裂原活化蛋白激酶(mitogen-acti‐vated protein kinase, MAPK) 信号激活囊胚,而高水平的大麻素则会抑制钙离子通道活性,不能激活囊胚(图5)(Wanget al.,2003)。在绵羊(Ovis ari‐es)中大麻素通过CB1控制细胞凋亡并抑制细胞增殖,使绵羊囊胚无法着床(Turcoet al., 2008)。另外大麻素还可以调节白血病抑制因子(leukemia in‐hibitory factor,LIF)水平(Maccarroneet al.,2002)。
LIF 是一种非常重要的细胞因子,该细胞因子参与滞育激活和囊胚着床的调控。在小鼠中,由于LIF的表达受雌激素控制,可以用它代替雌激素注射来诱导胚胎的着床和子宫脱膜化(Chenet al.,2000)。雌激素诱导LIF 调控子宫腔上皮的接受能力,LIF 结合跨膜受体复合物[由白血病抑制因子受体(LIFR) 和糖蛋白130 (GP130) 组成],从而激活酪氨酸激酶-信号转导与转录激活因子(janus ki‐nase-signal transducer and activator of transcription,JAK-STAT) 信号通路来调控囊胚着床(Rosarioet al., 2014)。同时,LIF 可调控肌段同源盒基因Msx1,诱导一个对生殖至关重要的动态、复杂的调控网络(Rosarioet al.,2014;Rosario and Stewart,2016)。科研人员实验发现小鼠子宫在缺乏LIF 的情况下,囊胚会进入滞育,而缺乏GP130 的囊胚不能存活(Stewartet al., 1992; Nicholset al.,2001)。子宫内膜的LIF 在滞育期表达水平非常低,但在囊胚再激活期间,LIF 的表达水平会增加(图5) (Bhattet al., 1991; Stewartet al., 1992; Songet al.,1998;Passavantet al.,2000)。
近些年,科研人员还发现了很多与囊胚发育和着床相关的分子。小鼠胚胎干细胞具有无限增殖而不丧失多能性的能力,而致癌基因Myc的缺失能使小鼠胚胎干细胞进入一种休眠状态,这让人联想到胚胎滞育(Shu and Pei, 2016)。致癌基因Myc在表达时会影响小鼠胚胎发育和胚胎干细胞功能,Myc缺失的小鼠胚胎干细胞表现出可逆的生物合成休眠和增殖停滞,并且在激素诱导的滞育胚胎中Myc表达量显著降低(图5)。含有致癌基因Myc突变的小鼠胚胎干细胞与滞育的胚胎有相似的特征,如代谢和生物合成减少等(Scognamiglioet al., 2016)。此外,在人工小鼠滞育模型中,朊病毒蛋白(PrPC)在囊胚着床时表达量显著提高,PrPC的表达可被孕酮抑制而被雌激素上调,因此PrPC也可能在胚胎着床中起重要作用(Dinget al.,2018)。
4 结论与展望
胚胎滞育的产生机理及激素调控网络已经比较明确。随着分子生物学的发展,关于胚胎滞育分子机制的研究越来越多。现有研究认为哺乳动物胚胎滞育的分子调控是子宫内膜与囊胚之间多种信号分子复杂协调的结果。虽然已经发现了很多与启动、维持和胚胎再激活相关的候选基因(Hamataniet al., 2004; Lopeset al., 2004; Zhaoet al., 2008; Chaet al., 2013; Fenelonet al., 2014b,2017b; Diaoet al., 2015; Hussainet al., 2017),但胚胎滞育分子机制研究还处于入门及基础知识的积累阶段。要明确胚胎滞育的分子调控机制,需要有更多的实验性基因和物种支持。胚胎滞育策略是部分物种对所处生活环境适应的结果,同时也是物种趋同进化的一种体现。物种趋同进化的分子机制一直都是科研工作者研究的热点,如翼手目和齿鲸(Odontoceti) 的回声定位策略(Shenet al.,2012;Marcovitzet al.,2019)、海洋哺乳动物的水环境适应策略等(Footeet al., 2015; Liuet al.,2019; McGowenet al., 2020)。但到目前为止,胚胎滞育的研究方向主要集中在胚胎滞育不同时期调控因子的转录水平和蛋白水平上(如Hamataniet al., 2004; Zhaoet al., 2008; Lefevreet al., 2011;Rosarioet al.,2014;Fenelonet al.,2016,2017b;Ro‐sario and Stewart,2016),尚未开展相关分子机制趋同研究。本文在回顾总结归纳哺乳动物胚胎滞育研究现状的基础上提出以下几个较为迫切的研究方向:
(1)研究物种的扩展。胚胎滞育的研究目前主要集中于几个代表性的模式生物中(小鼠、美洲水貂、尤金袋鼠),另外还包括两个特殊类群——欧洲狍和翼手目动物。现有的激素调控理论及认知是否能够完全应用于其它物种,尚不可知,因此需要进行更多物种的研究,尤其是大型哺乳动物,如熊科、海豹科动物等。
(2)胚胎滞育趋同进化分子机制研究。表型的趋同往往是基因趋同进化的结果。高通量测序技术的快速发展为生物趋同进化分子机制研究提供了良好的技术支持。研究哺乳动物胚胎滞育分子进化机制及分子趋同,也为揭示物种进化的环境适应机制和分子调控机制提供参考。
(3)实验验证。在充分分析、探讨、总结归纳胚胎滞育分子调控机制理论的基础上,找到胚胎滞育各个环节(胚囊发育的停滞、维持、再激活)的关键基因及各基因的作用,通过基因编辑或敲除等手段实验验证胚胎滞育的分子调控理论,形成完整的理论体系。

