鹅p21基因克隆、启动子分析及转录调控研究
陈 哲,杨鹏霞,雷明明,陈佳彬,闫乐艳
(1.江苏省农业科学院畜牧研究所,南京 210014;2.农业农村部长江中下游设施农业工程重点实验室,南京 210014;3.泰州市金鹏鹅业专业合作社,泰州 225319)
细胞周期是细胞生命活动的基本过程,对维持机体组织、器官功能完整性具有关键作用。细胞周期受细胞周期素(Cyclin)、细胞周期素依赖性蛋白激酶(CDKs)和细胞周期素依赖性蛋白激酶抑制因子(CKIs)的共同调控。p21基因是最早被发现具有CKIs活性的转录因子,通过特异性失活CDKs调控细胞周期停滞,是抑制细胞增殖、调节细胞分化的中心事件[1]。研究证明,p21基因在家禽卵泡发育[2]、哺乳动物卵子成熟[3]和胚胎发育[4-5]过程中具有重要调节作用。
p21是多个信号通路的中间节点[6],其基因功能及转录调控机制非常复杂,启动子区多个调控元件(如Sp1、C/EBP、STATs等)参与p21基因的转录调控[7-8]。体外试验发现,lncRNA SYISL可以通过与p21及肌肉特异性基因启动子结合,沉默肌细胞生成素(myogenin,MyoG)和肌球蛋白重链4(myosin heavy chain 4,MYH4)的表达,促进成肌细胞增殖并抑制其分化[9]。p21基因发挥作用还受到p53和转化生长因子-β(transforming growth factor-β,TGF-β)的调控[10]。目前,关于p21基因与各转录调控因子的相互作用还不明确。p21基因在肌肉发育中的调控作用得到越来越多的关注,肌肉发生过程受到一系列转录因子的调控,这些因子在肌细胞的生长、分化、细胞周期运转及细胞凋亡中都起到重要作用[11]。p21在多个信号通路中发挥作用,参与成肌细胞、肌管和肌纤维等多个阶段的分化停滞,与生肌过程相关,参与调控小鼠肌肉卫星细胞由静息状态转向细胞激活和增殖[12],p21基因敲除(p21-/-)小鼠表现出肌肉分化延迟的症状,同时生肌决定因子(myogenic determinant,MyoD)和MyoG在肌肉中的表达量显著降低[1]。
中国是肉鹅生产和消费大国,鹅肉是理想的高蛋白、低脂肪、低胆固醇的健康食品,近年来的消费量日趋上涨。目前,针对鹅肉的发育调控机制已经做了大量研究工作,胚胎期是畜禽肌纤维形成的关键时期,挖掘影响胚胎期肌肉发育的关键候选基因,从而更有效调控鹅肌肉发育是可行的方案。本研究对鹅p21基因全长及启动子区序列进行克隆与分析,筛选核心启动子区并初步明确核心转录调控因子,为进一步分析p21基因在鹅胚胎期肌肉发育中的作用、阐明鹅肌肉发育的遗传机制提供理论基础。
1 材料与方法
1.1 材料
1.1.1 样品采集 泰州鹅种蛋来自泰州金鹏鹅业专业合作社,孵化第28天采集鹅胚腿肌组织样,一部分置于液氮中速冻,-80 ℃保存备用;另一部分用于提取组织DNA。
1.1.2 主要试剂 SMARTer®RACE 5′/3′ Kit购自Clontech公司;PrimeScript 1st Strand cDNA Synthesis Kit、TksGflex DNA Polymerase、T4 DNA连接酶、pMD19-T载体、大肠杆菌DH5α感受态细胞和琼脂糖凝胶DNA回收试剂盒均购自TaKaRa公司;限制性内切酶NheⅠ及XhoⅠ均购自NEB公司;动物组织DNA提取试剂盒和无内毒素质粒小量提取试剂盒均购自鼎国生物公司;荧光素酶报告质粒pGL3-Enhancer、pRL-TK、pGL3-Basic及Dual-luciferase Assay System试剂盒均购自Promega公司;DNA Marker购自生工生物工程(上海)股份有限公司;Mut Express®Ⅱ Fast Mutagenesis Kit V2定点突变试剂盒购自Vazyme公司;胎牛血清、PBS、胰蛋白酶及Opti-MEM培养基均购自Gibco公司;Trizol Reagent和Lipofectamine LTX均购自Invitrogen公司;小鼠成肌细胞(C2C12)由农业农村部种养结合重点实验室保存。
1.2 方法
1.2.1 总RNA提取 采用Trizol法提取鹅胚腿肌总RNA,取1 μL进行1.0%琼脂糖凝胶电泳检测,核酸分析仪测定总RNA的纯度和浓度,选用D260 nm/D280 nm值为1.8~2.0的RNA为模板,按照PrimeScript 1st Strand cDNA Synthesis Kit说明书进行反转录合成cDNA,按照SMARTer®RACE 5′/3′Kit说明书反转录合成RACE所需cDNA,-20 ℃保存备用。
1.2.2 鹅p21基因中间片段扩增 根据鸭(Anasplatyrhynchos)p21基因序列(GenBank登录号:NW_004677468)信息查询CDS区序列(453 bp,编码151个氨基酸),使用Oligo 7.0软件设计巢式引物扩增p21基因中间片段,其中pF1和pR1为第一轮PCR引物,pF2和pR2为第二轮PCR引物,引物序列见表1。引物均由生工生物工程(上海)股份有限公司合成。

表1 p21基因全长序列引物
第一轮PCR扩增体系50 μL:TksGflex DNA Polymerase 1 μL,2×Gflx PCR Buffer 25 μL,DNA模板1 μL,上、下游引物各0.5 μL,ddH2O 22 μL。第一轮PCR扩增条件:98 ℃预变性5 min;98 ℃变性10 s,55 ℃退火15 s,68 ℃延伸3 min,共30个循环;68 ℃延伸10 min;9 ℃保存。以鉴定正确的第一轮PCR产物为模板进行第二轮PCR扩增,反应条件与第一轮PCR一致,对第二轮PCR产物进行电泳检测,回收纯化后送生工生物工程(上海)股份有限公司测序。
1.2.3 鹅p21基因3′-RACE 利用pF3和UPM Primer为上、下游引物进行Outer PCR扩增。PCR扩增体系50 μL:cDNA 1 μL,2×Gflex PCR Buffer 25 μL,Tks Gflex DNA Polymerase (1.25 U/μL) 1 μL,pF3(20 μmol/L)1 μL,UPM(10×) Primer 5 μL,灭菌ddH2O补足体系。PCR反应条件:94 ℃预变性1 min;98 ℃变性10 s,55 ℃退火15 s,68 ℃延伸60 s,共30个循环;68 ℃延伸10 min;4 ℃保存。将反应产物稀释50倍作为模板,利用pF4和UPS Primer作为上、下游引物进行Inner PCR扩增。PCR扩增体系50 μL:Outer PCR 反应液 1 μL,2×Gflex PCR Buffer 25 μL,Tks Gflex DNA Polymerase (1.25 U/μL) 1 μL,上、下游引物(10 μmol/L)各1 μL,灭菌ddH2O补足体系。PCR反应条件同Outer PCR一致。2次PCR扩增3′-UTR序列,产物通过1.0%琼脂糖凝胶电泳检测,对鉴定正确的PCR产物纯化回收后使用引物pF4进行测序,测得3′-端出现套峰,进行TA克隆测序。将纯化回收产物加A处理后,使用DNA Ligation连接到pMD19-T载体,转化大肠杆菌DH5α感受态细胞,涂布平板过夜培养,挑选阳性单克隆菌落送生工生物工程(上海)股份有限公司测序。
1.2.4 鹅p21基因5′-RACE 利用pR5和UPM Primer为上、下游引物进行Outer PCR扩增。PCR扩增体系50 μL:cDNA 1 μL,2×Gflex PCR Buffer 25 μL,Tks Gflex DNA Polymerase (1.25 U/μL) 1 μL,pR5(10 μmol/L)1 μL,UPM(10×) Primer 5 μL,灭菌ddH2O补足体系。PCR反应条件:94 ℃预变性1 min;98 ℃变性10 s,55 ℃退火15 s,68 ℃延伸60 s,共30个循环;68 ℃延伸10 min;4 ℃保存。将反应产物稀释100倍作为模板,利用pR6和UPS Primer作为上、下游引物进行Inner PCR扩增。PCR扩增体系50 μL:Outer PCR 反应液 1 μL,2×Gflex PCR Buffer 25 μL,Tks Gflex DNA Polymerase (1.25 U/μL) 1 μL,上、下游引物(10 μmol/L)各1 μL,灭菌ddH2O补足体系。PCR反应条件同Outer PCR一致。2次PCR扩增5′-UTR序列,产物通过1.0%琼脂糖凝胶电泳检测,对鉴定正确的PCR产物纯化回收后使用引物pR6进行TA克隆测序。
1.2.5 鹅p21基因5′-侧翼区片段PCR扩增 以泰州鹅胚腿肌cDNA为模板,结合已经获得的鹅p21基因序列和鸭(Anasplatyrhynchos)p21基因(GenBank登录号:NW_004677468)侧翼区序列信息,设计引物p21F/R扩增p21基因5′-侧翼区序列获得P1片段,并进行生物信息学分析,针对转录因子结合位点存在区域设计5条上游引物(P1F、P2F、P3F、P4F、P5F)以及共同的下游引物PR,递减扩增启动子区片段,对所有上游引物引入NheⅠ限制性酶切位点及保护碱基,下游引物引入了XhoⅠ酶切位点及对应的保护碱基,引物序列见表2。引物均由生工生物工程(上海)股份有限公司合成。

表2 p21基因启动子序列引物
PCR扩增体系50 μL:Tks Gflex DNA Polymerase 1 μL,2×Gflx PCR Buffer 25 μL,DNA模板1 μL,上、下游引物各0.5 μL,ddH2O 22 μL。PCR反应条件:98 ℃预变性5 min;98 ℃变性10 s,60 ℃退火15 s,68 ℃延伸3 min,共30个循环;68 ℃延伸10 min;4 ℃保存。PCR扩增产物经1.0%琼脂糖凝胶电泳检测,对鉴定正确的PCR产物回收纯化后连接到pMD19-T载体上,重组质粒经NheⅠ和XhoⅠ酶切鉴定正确后,送生工生物工程(上海)股份有限公司测序。
1.2.6 生物信息学分析 对所获片段进行克隆、测序和拼接,得到鹅p21基因全序列,采用NCBI的ORF Finder程序分析开放基因阅读框(ORF)及所编码的氨基酸序列;利用ClustalX软件与鸭(登录号:XP_038024143)、原鸡(登录号:NP_989727)、火鸡(登录号:XP_010722537)、家猪(登录号:XP_013833312)、犬(XP_038539267)、马(登录号:XP_023480611)、猕猴(登录号:NP_001181651)、黑猩猩(登录号:XP_003950875)、人(登录号:NP_000380)、小鼠(登录号:NP_031695)、大鼠(登录号:NP_542960)、仓鼠(登录号:XP_035312869)和斑马鱼(登录号:NP_001121892)p21基因氨基酸序列进行相似性比对;采用Mega 7.0软件构建系统进化树。
使用Primer Premier 6.0软件中的motif模块对鹅p21基因5′-侧翼区序列进行TATA-box、CAAT-box和GC-box元件分析;采用GPMiner在线软件(http:∥www.fruitfly.org/seq_tools/promoter.html)预测p21基因5′-端转录起始位点(TSS);使用TFSEARCH在线软件(http:∥mbs.cbrc.jp/research/db/TFSEARCH.html)预测p21基因启动子区内潜在转录因子结合位点。
1.2.7 鹅p21基因启动子报告基因载体构建及鉴定 利用表2所列引物进行PCR扩增鹅p21基因递减长度的启动子片段,对扩增片段进行NheⅠ和XhoⅠ双酶切,经琼脂糖凝胶电泳回收、T4 DNA连接酶连接后,定向克隆到同样双酶切的pGL3-Enhancer载体中,连接产物转化大肠杆菌DH5α感受态细胞,挑选阳性单克隆菌落进一步测序鉴定。 利用NheⅠ和XhoⅠ双酶切和测序验证,筛选构建正确的鹅p21基因pGL3-P1(-1 114~+96 bp)、pGL3-P2(-723~+96 bp)、pGL3-P3(-444~+96 bp)、pGL3-P4(-292~+96 bp)、pGL3-P5(-35~+96 bp)和pGL3-P6(+37~+96 bp)重组双荧光素酶报告基因质粒。将启动子报告载体及对照质粒pGL3-Basic分别转染至C2C12细胞,检测启动子活性。
1.2.8 鹅p21基因突变位点报告基因载体的构建 结合启动子活性检测结果,对启动子核心区转录因子结合位点进行预测。 利用点突变技术对转录因子结合位点进行敲除,设计并合成引物MutF/R,引物序列见表2。 点突变试验以pGL3-P5(-35~+96)质粒为模板,突变引物PCR扩增整个质粒,回收扩增片段,加入DpnⅠ酶,去除模板质粒后再次回收,回收产物加T4 DNA Ligase连接,转化大肠杆菌DH5α感受态细胞,涂布平板过夜培养,挑取阳性克隆进行PCR鉴定,对鉴定正确的菌液测序后挑选序列正确的质粒进行克隆,构建突变位点报告基因载体pGL3-MyoD-p21。
1.2.9 细胞培养、转染和双荧光素酶活性检测 C2C12细胞复苏后,均匀等量接种于24孔板中,当细胞生长至汇合度达70%~80%时,将构建的重组双荧光素酶报告载体转染到细胞内作为试验组,转染pGL3-Basic为阴性对照组,pRL-TK为内参质粒。质粒瞬时转染后连续培养24 h,收集细胞裂解,检测双报告基因荧光素酶活性。
1.2.10 数据分析 运用GraphPad Prism软件进行单因素方差分析,使用SPSS 17.0软件对数据进行Duncan’s多重比较,P<0.05为差异显著;P<0.01为差异极显著。
2 结 果
2.1 鹅p21基因的扩增
鹅胚腿肌总RNA样品用1.0%琼脂糖凝胶电泳检测,条带清晰,可满足试验要求。鹅p21基因cDNA全长扩增结果见图1。由图1可知,分别得到中间片段(313 bp)、5′-RACE(438 bp)和3′-RACE(1 618 bp)产物,序列长度与预期片段大小相符。利用DNAMAN软件对所有片段的测序结果进行拼接,最终获得鹅p21基因全长序列1 943 bp,其中CDS区为453 bp,5′-UTR为125 bp,3′-UTR为1 365 bp。
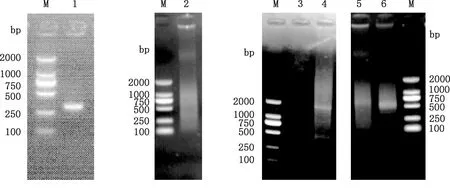
M,DL2000 DNA Marker;1,部分CDS区PCR产物(313 bp);2,3′-RACE Outer PCR产物;3,3′-RACE Outer PCR产物稀释10倍;4,3′-RACE Inner PCR产物(1 618 bp);5,5′-RACE Outer PCR产物;6,5′-RACE Inner PCR产物(438 bp)
2.2 鹅p21基因5′-侧翼区PCR扩增
琼脂糖凝胶电泳结果显示,鹅p21基因5′-侧翼区扩增片段P21长1 210 bp(图2A),系列缺失启动子片段P1、P2、P3、P4、P5和P6分别长1 242、851、572、420、163和92 bp(图2B),均符合预期长度。利用DNAMAN将p21基因5′-侧翼区测序结果与鹅p21基因全长cDNA序列进行拼接,获得鹅p21基因编码启动子ATG前约1 100 bp的侧翼区序列。
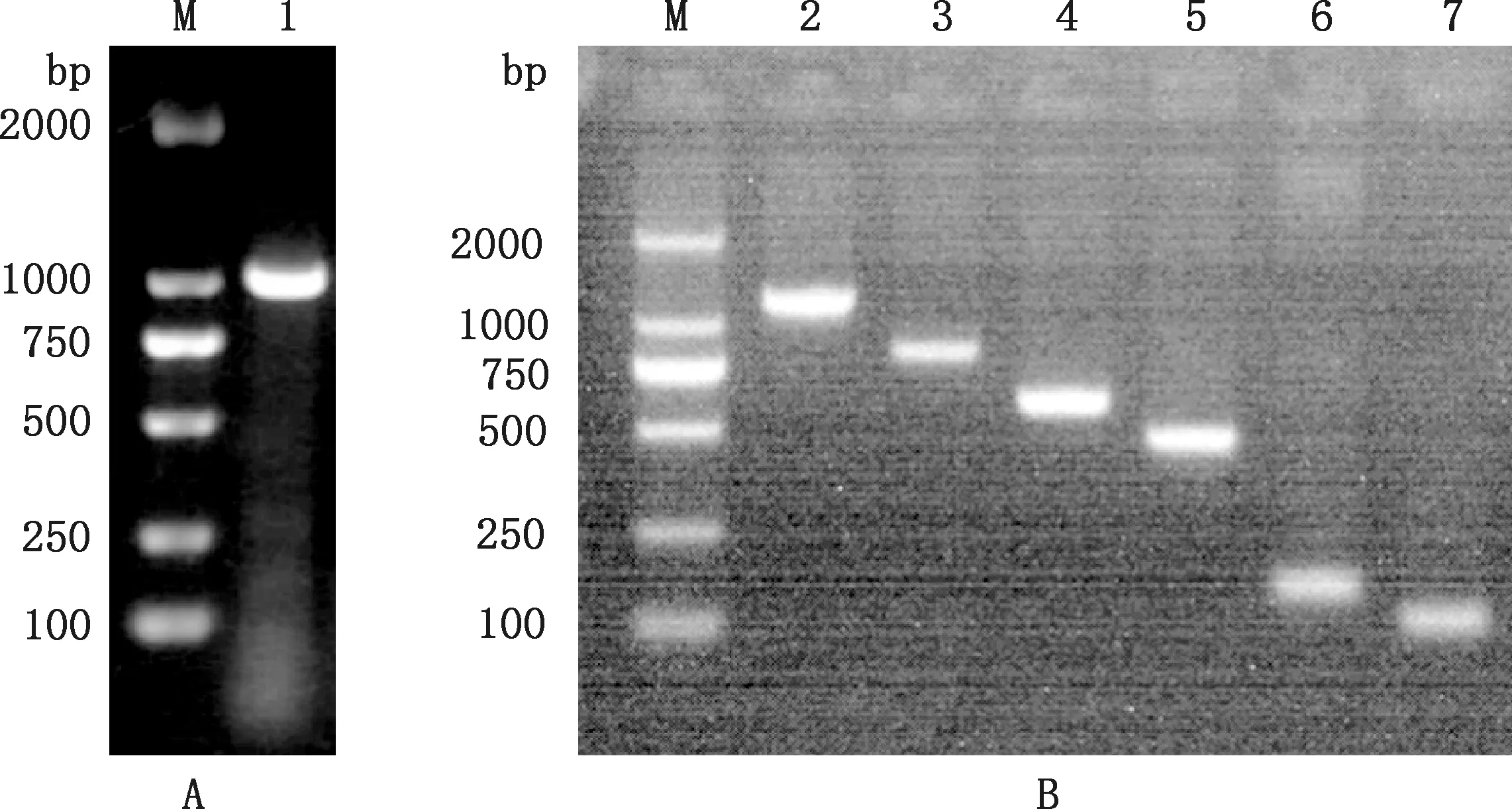
M,DL2000 DNA Marker;1~7,p21(1 210 bp)、P1(1 242 bp)、P2(851 bp)、P3(572 bp)、P4(420 bp)、P5(163 bp)和P6(92 bp)引物片段
2.3 生物信息学分析
2.3.1 鹅p21基因序列分析 ORF Finder程序分析显示,鹅p21基因全长序列存有符合Kozak规则的完整开放阅读框,编码区位于126-578 bp,长453 bp,编码151个氨基酸。利用NCBI Conserved Domains在线工具进行结构域分析发现,p21基因编码蛋白具有CDI(cyclin-dependent kinase inhibitor)家族的保守结构域,位于21-66位氨基酸处。不同物种p21蛋白的氨基酸序列相似性比对发现,鹅p21基因与鸭的相似性达到93.4%,与鸡和火鸡的相似性均为75.5%,与其他物种相似性均较低(图3),说明p21作用机制在禽类中相对保守。
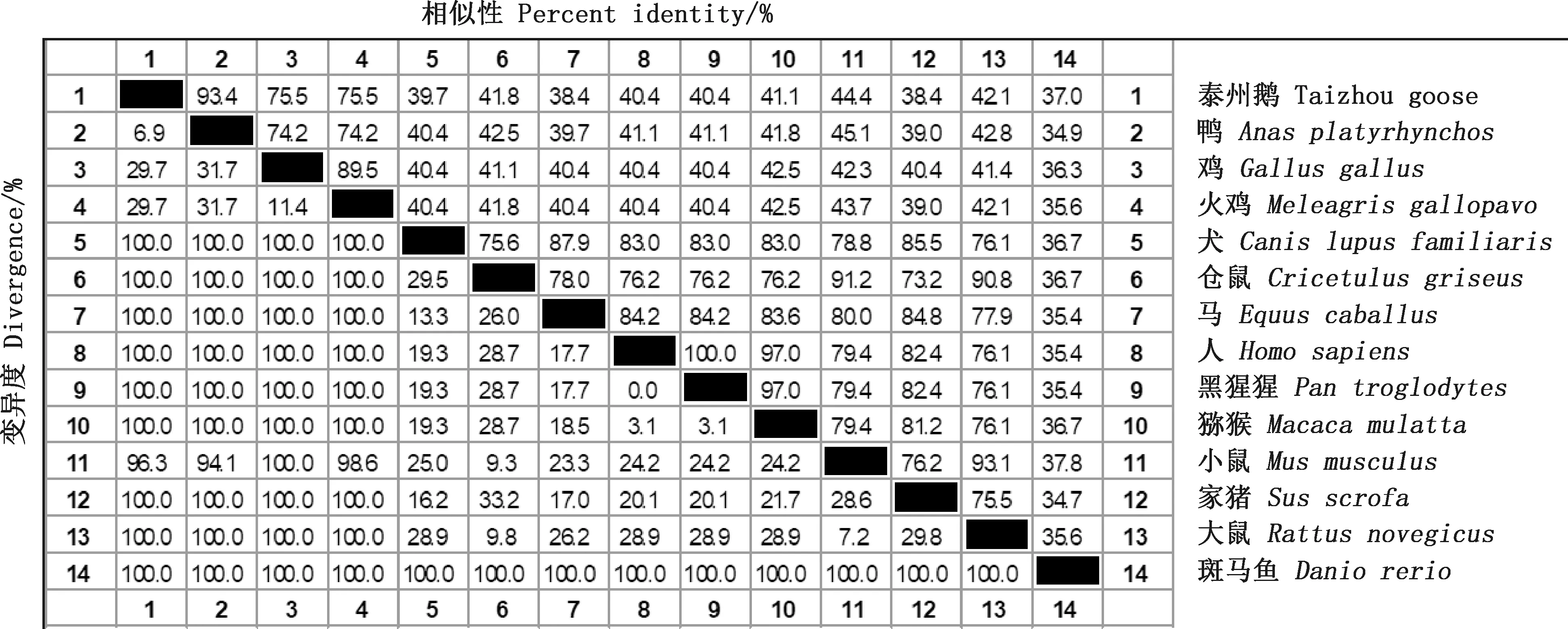
图3 不同物种p21蛋白的氨基酸序列比对
2.3.2 系统进化树构建 根据不同物种的p21蛋白氨基酸序列,利用Mega 7.0软件构建系统进化树,结果显示,鹅与鸭的亲缘关系最近,且与同纲的鸡、火鸡成簇,猪、人等哺乳动物成簇,斑马鱼单独成簇,最后3个物种相聚成簇(图4)。
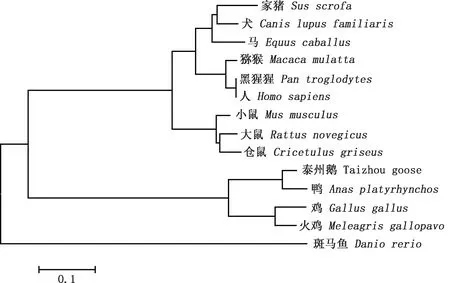
图4 p21氨基酸序列系统进化树
2.3.3 鹅p21基因5′-侧翼区序列分析 对鹅p21基因5′-侧翼区序列进行启动子元件分析,结果显示,5′-侧翼区序列存在1个CAAT box和1个GC box,无TATA box,BDGP在线预测鹅p21基因转录起始位点(TSS)位于-11 bp处。利用TFSEARCH预测转录因子结合位点,结果显示,鹅p21基因启动子区存在多个潜在转录因子结合位点,包括C/EBP、Sp1和MyoD等(图5)。表明鹅p21基因上游1.1 kb序列是启动子区,具有调控基因转录活性的潜在功能。

图5 鹅p21基因启动子区转录因子结合位点预测
2.4 双荧光素酶报告载体构建及活性分析
双荧光素酶报告基因检测结果表明,不同长度启动子在C2C12细胞均具有活性,6个启动子片段的活性依次呈现先增高后降低的趋势,以pGL3-P4(-292~+96 bp)的荧光素酶相对活性最高,当缺失p21基因启动子区-35/+37 bp序列后,双荧光素酶报告载体pGL3-P6(+37~+96 bp)较pGL3-P4(-292~+96 bp)、pGL3-P5(-35~+96 bp)活性极显著降低(P<0.01),分别下降了88.89%和83.58%(图6)。推测-35~+96 bp是鹅p21基因核心启动子区,在-35~+37 bp启动子区域存在核心顺式调控元件。
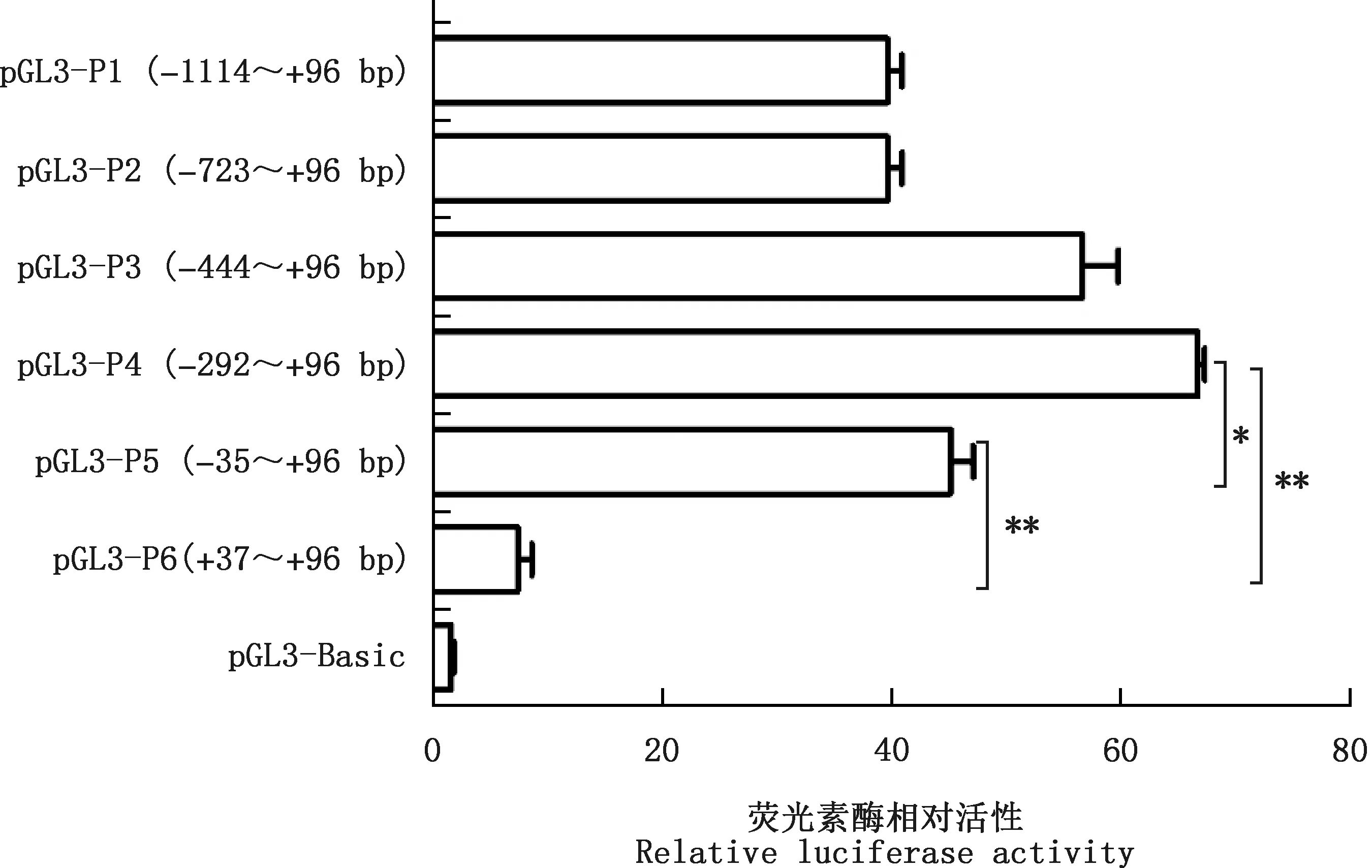
*,差异显著(P<0.05);**,差异极显著(P<0.01)。下同
2.5 突变载体构建及核心调控元件验证
以pGL3-P5(-35~+96 bp)为模板,对核心启动子区潜在转录因子结合位点MyoD(+25~+36 bp)进行点突变扩增,扩增产物加T4 DNA Ligase连接、克隆,挑取单克隆提取质粒进行测序验证,结果表明,试验成功构建转录因子结合位点突变载体pGL3-MyoD-p21(图7A)。将构建好的突变位点报告基因载体pGL3-MyoD-p21和对照载体pGL3-P5(-35~+96 bp)分别转染至C2C12细胞,双荧光素酶报告基因检测结果表明,突变位点报告基因在C2C12细胞中有活性,突变位点报告基因的荧光素酶相对活性极显著低于pGL3-P5(-35~+96 bp)(P<0.01)(图7B)。推测MyoD是调控鹅p21基因启动子活性的核心顺式调控元件。
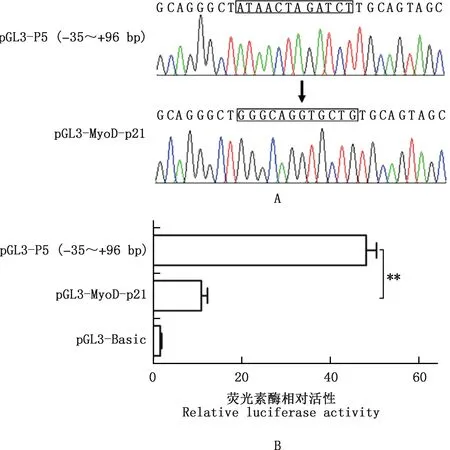
方框内表示转录因子结合位点突变比对
3 讨 论
家禽肌肉的形成起始于胚胎期,由肌祖细胞定向增殖、分化成成肌细胞,成肌细胞进一步分化、融合形成肌管,最终形成肌纤维[13]。肌纤维的数量在出雏前已经固定,后期肌肉量的增加主要依靠肌纤维的肥大[14]。肌肉含量是家禽关键经济性状之一,因此挖掘影响禽胚胎期肌纤维发育的关键基因具有重要的经济价值。
3.1 鹅p21基因序列克隆及分析
肌肉发育过程需要许多调控因子的参与,研究表明,细胞周期调控基因在鸭胚孵化中期表达下调,减缓胸肌细胞的增殖,为孵化后期肌细胞融合和分化提供必要条件[15]。对鸡胚研究发现,p21基因mRNA在孵化期的表达模式与成肌细胞增殖、分化规律一致[16-17],推测细胞周期调控基因(如p21基因)在调控禽胚胎期肌肉发育中具有重要作用。本研究获得了鹅p21基因全长序列和部分5′-侧翼区序列,生物信息学分析表明,鹅p21基因编码蛋白含有高度保守的CDI家族结合位点。系统进化树分析表明,p21蛋白在不同物种间具有较高的保守性,与禽类相似性较高,与鸭进化关系最近,推测其在功能上也存在一定的相似性。
鹅p21基因启动子区包含CAAT box和GC box等典型的真核生物转录调控元件,但缺失TATA box。TATA box是基因转录起始调控开关,主要功能是保证转录的正确定位[18]。研究发现,人分泌成分(secretory component,SC)基因启动子区缺少TATA box,但位于编码区(+8~+21 bp)的IRF-E元件补偿了TATA box缺失效应,通过构建起始前复合物可激活基因转录[19]。这与生肌调节因子(myogenic regulatory factors,MRFs)家族调控机制相似,MyoD通常以二聚体形式与E-box元件结合[20],进而激活基因转录,推测MyoD(+25~+36 bp)元件可能同样具有补偿TATA box缺失效应的作用,还需要进一步试验验证。
3.2 鹅p21基因启动子活性及调控元件分析
本研究构建了6个不同长度启动子片段的报告基因载体,双荧光素酶检测结果显示,-35~+96 bp区域是鹅p21基因核心启动子区,在-35~+37 bp启动子区域存在核心顺式调控元件。MatInspector分析发现,-35~+37 bp区域内存在MyoD(+25~+36 bp)结合位点,利用点突变技术对该位点进行敲除,构建双荧光素酶重组载体,转染至C2C12细胞,对突变位点报告基因载体进行活性检测,结果显示,MyoD转录因子突变载体pGL3-MyoD-p21的活性极显著下降,推测MyoD是鹅p21基因的核心转录调控因子。转录调控元件一般位于启动子区,但一些重要的调控元件也存在于编码区内,小鼠多个组蛋白基因的转录调控元件位于编码区[21],人Pax5基因关键转录调控元件位于第1外显子[22],本研究结果表明,鹅p21基因转录调控也存在同样相似的机制。
MyoD是MRFs家族一员,是成肌分化的决定因子[23]。在动物胚胎期,MyoD可以诱导肌祖细胞向生肌细胞系转变[24],体外试验也发现,MyoD可以将其他类型的细胞转变为肌细胞[25]。胚胎期肌细胞的分化需要肌肉特异性基因的表达和细胞周期终止共同调节[20],研究表明,MyoD和p21基因在此过程中发挥重要作用,一方面,MyoD诱导前成肌细胞分化发育形成肌纤维;另一方面,通过诱导p21基因表达上升,进而实现细胞周期终止在G0阶段[26]。
肌肉特异性基因启动子区大都存在E-box元件,MRFs的二聚体可与之结合,以调节下游基因的转录[27-28]。本研究结果发现,p21基因启动子区含有E-box元件,且位于MyoD转录因子结合位点内,核心序列为CAGGTG,MyoD可直接调控p21基因转录活性,这是首次在分子水平揭示MyoD对p21基因的转录调控作用。下一步可以通过染色质免疫共沉淀(EMSA)和凝胶阻滞分析试验等方法验证MyoD调控鹅p21基因转录活性的功能,并进一步研究其作用机制。
4 结 论
本试验成功克隆泰州鹅p21基因全长及启动子序列,鹅p21基因与鸭进化关系最近。启动子活性检测发现,-35~+96 bp区域是核心启动子区,-35~+37 bp区域存在核心顺式调控元件。对核心区转录因子进行定点突变,构建转录因子突变表达载体后测定活性,表明MyoD是启动子核心顺式调控因子。

