射干的研究进展及其质量标志物的预测分析
凌 悦,陈金鹏,叶 晴,刘怡妙,徐 旭,田成旺*
射干的研究进展及其质量标志物的预测分析
凌 悦1,陈金鹏2, 3, 4,叶 晴1,刘怡妙1,徐 旭2, 3, 4,田成旺2, 3, 4*
1.天津中医药大学,天津 300193 2.天津药物研究院,天津 300301 3.天津市中药质量标志物重点实验室,天津 300301 4.释药技术与药代动力学国家重点实验室,天津 300301
射干是我国常用的中药材,资源丰富,分布较广,具有广阔的开发利用前景。射干中化学成分类型较为丰富,主要为黄酮类、三萜类、挥发油、甾体类等,一般认为异黄酮为其主要药效成分。在射干化学成分、药理作用综述的基础上,根据中药质量标志物(quality marker,Q-Marker)理论,从化学成分与传统功效、传统药性、可测成分、不同产地和采收时期、入血成分及不同配伍环境几方面对射干Q-Marker成分进行预测分析,发现以鸢尾苷、鸢尾黄素、野鸢尾黄素、白射干素、芒果苷表现最为显著,为明确射干Q-Marker和制定科学的质量标准提供理论基础。
射干;异黄酮;质量标志物;鸢尾苷;鸢尾黄素;野鸢尾黄素;白射干素;芒果苷
射干为鸢尾科射干属植物射干(L.) DC.的干燥根茎[1]。又名乌扇、野萱花、蝴蝶花等。主要分布于中国湖北、山东、江苏及云南等省、自治区。其味苦、性寒、有小毒,归肺、肝经,具有清热解毒、祛痰利咽、散结消炎、消肿止痛等功效。临床上主要用于治疗扁桃腺炎、支气管炎、肝脾肿大及腰痛等疾病。现代药理研究表明,射干具有抗炎、清除自由基、抗菌、抗病毒、抗肿瘤、雌激素样作用以及抗血栓等作用[2]。射干所含化学成分类型较为丰富,主要为异黄酮、三萜、挥发油类型。然而,《中国药典》2020年版仅对其中的次野鸢尾黄素进行含量限定,因此,同许多中药材一样,射干也存在着质控指标单一等问题。随着对射干化学成分、药理作用及临床研究的逐步深入,其活性部位及有效成分的研究也逐渐受到关注。本文对射干化学成分、主要药理活性进行系统性总结,并基于中药质量标志物(quality marker,Q-Marker)的概念要求,对中药射干的Q-Marker进行预测分析,为其质量控制研究及Q-Marker的选择提供依据。
1 化学成分
射干中化学成分类型多,主要包括黄酮类、三萜类、甾体类、醌类、挥发油等成分,此外还包含有机酸以及微量元素等。其中异黄酮为主要活性成分。
1.1 黄酮类化合物
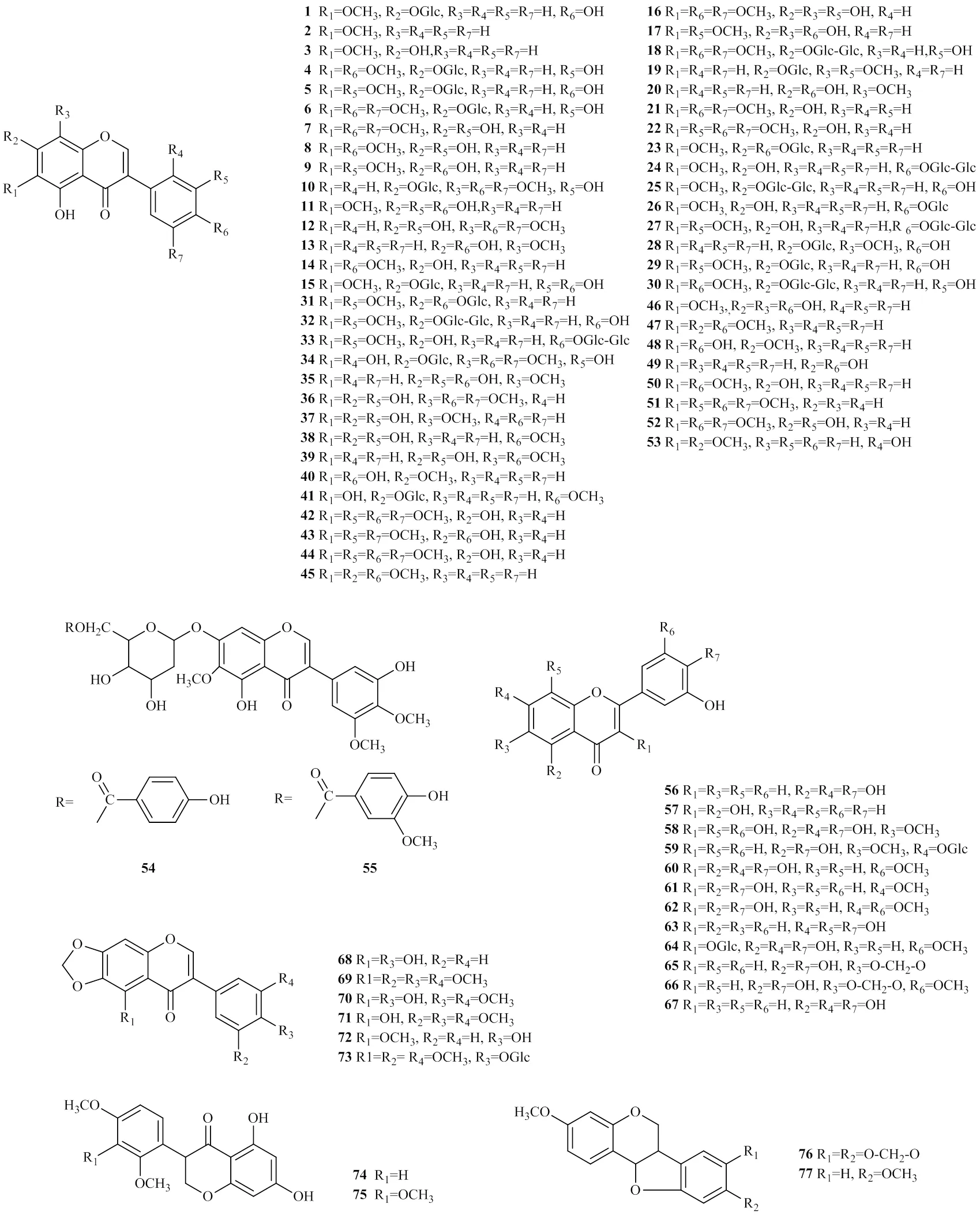
黄酮类物质是射干中的主要生物活性成分,并且与射干的药理药效密切相关,目前从射干中分离出来的黄酮类化合物有86种,主要有黄酮、异黄酮、黄酮醇等,这些化合物是从射干根茎中获得,以亲脂性苷元、亲水性更强的糖苷或其多甲氧基化衍生物的形式存在。其中以异黄酮类化合物活性最强,其他还包括二氢黄酮以及双苯吡酮等。黄酮类化合物名称见表1,成分结构见图1。
1.2 三萜类化合物
射干中三萜类成分含量相对较高。目前,已经从射干中分离鉴定出多种萜类化合物,其中从射干根茎中分离出12个虹膜型三萜[35-39],分别为28-deacetylbelamcandal(87)、(6,10,11)-26- hydroxy-(13)-oxaspir-oirid-16-enal(88)、(6,10, 11,14,26)-26-hydroxy-15-methyli-dene-spiroird-16- enal(89)、iridobelamalA(90)、16--acetyl- isoiridogermanal(91)、isoiridogermanal(92)、anhydrobelachinal(93)、epianhy-drobelachina(94)、isoanhydrobelachinal(95)、iristectoreneB(96)、3--tetradecanoyl-16--acetylisoiridogermanal(97)、3--decanoyl-16--acetylisoiridogermanal(98)。有研究报道,从射干根的醋酸乙酯和乙醇提取物中发现了多个五环三萜类的化合物,如熊果酸(99)、桦木素(100)、桦木酸(101)、betulone (102)以及cycloartanol(103)[40]。最近,有研究者在射干的种子中发现了4种新型三萜类化合物belamchinanes A-D(104~107)[41]。其成分结构见图2。

表1 射干中黄酮类化合物
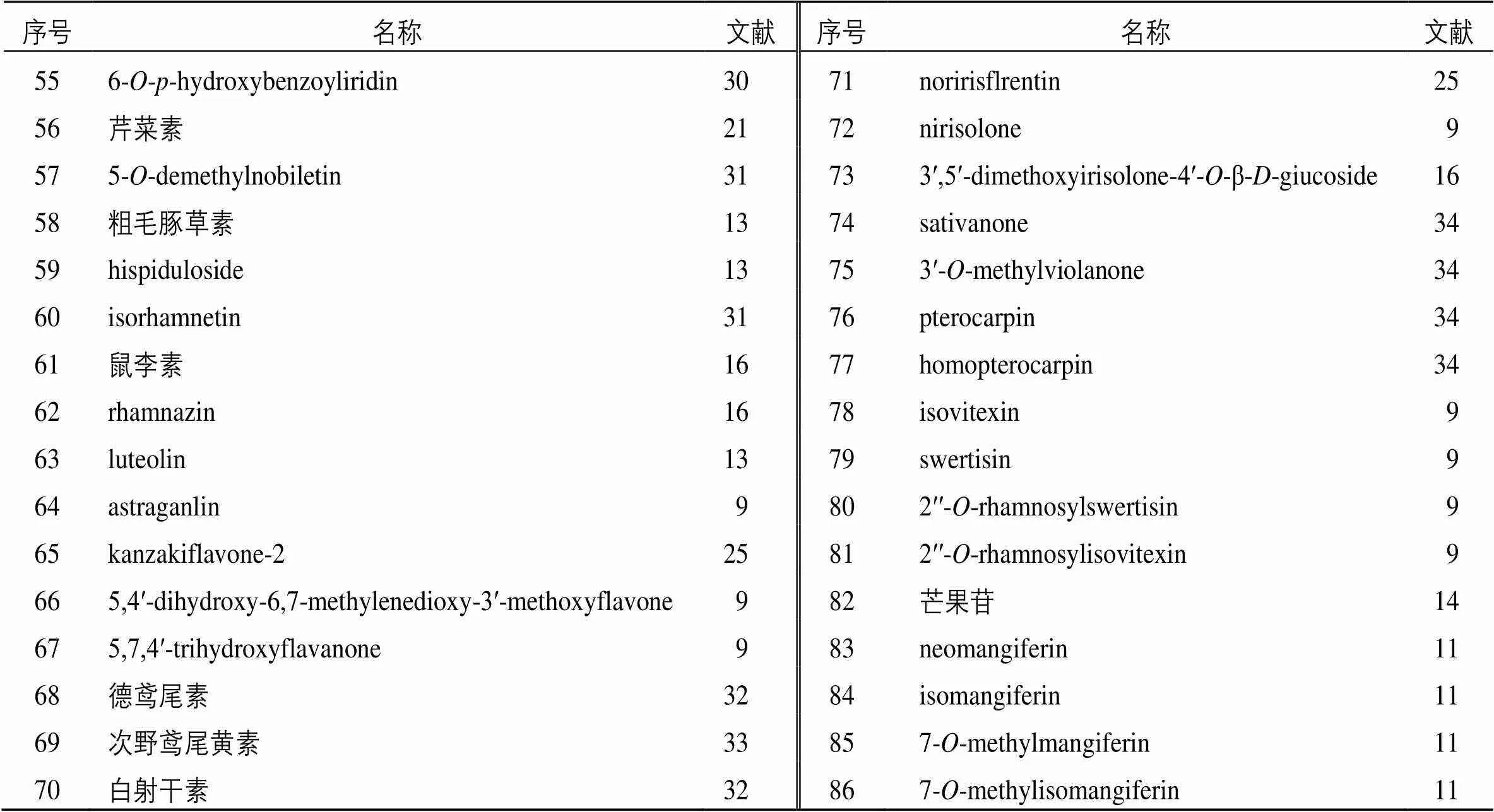
续表1
1.3 醌类化合物
目前,从射干种子种发现了9种化合物[42-44],分别为belamcandol A(108)、belamcandol B(109)、belamcandaquinone A(110)、belamcandaquinone B(111)、belamcandone A-D(112~115)以及ardisianone A(116)。其成分结构见图3。
1.4 甾体类化合物
迄今,研究者们在射干中分离出5种甾醇类化合物[45]分别为豆甾醇(117)、β-谷甾醇(118)、β-胡萝卜苷(119)、维他命苷(120)、豆固醇(121)。其成分结构见图4。
1.5 有机酸类化合物
从射干根茎的醋酸乙酯提取物中发现多种有机酸类化合物,分别为[46-49]iriflophenone(122)、belalloside A(123)、belallo-side B(124)、白芦藜醇(125)、belamphenone(126)、乙酰香草醛(127)、莽草酸(128)、没食子酸(129)、阿魏酸(130)以及香草酸(131)。其成分结构见图5。
1.6 其他类化合物
射干中除了上述常见的化合物之外还含有其他的一些化合物[50-52],到目前为止,从射干中分离到4个酮类化合物,包括belamcandaphenol(132)、4-hydroxy-acetophenone(133)、sheganone(134)、apocynin(135);秦民坚等[51]已从射干根茎中提取到多个挥发油,如桉叶醇(136)、十四酸(137)、5-庚基二氢呋喃酮(138)、5,8-diethyl-dodecame(139)、hexadecanoic acid(140)、橙花醇乙酸(141)。同时,段玉峰等[52]建立ICP发射光谱测定射干中的微量元素,从中发现镁、铁、钒、铬、锰、钴、镍、铜、锌、硼、锡、铋、铅等。
2 药理作用
现代药理研究表明,射干对治疗支气管炎、慢性支气管哮喘、肺间质纤维化、呼吸窘迫综合征和急性咽炎以及各种炎症具有良好的临床疗效,并且含有的黄酮、三萜及其苷类、挥发油等活性成分起到抗炎镇痛、清除自由基、抗菌、抗病毒等作用。
2.1 抗炎、镇痛作用
鸢尾科射干中的主要成分及提取物具有明显的抗炎及镇痛的活性。李欣妍等[53]发现白射干素(70)是射干药材抗炎止咳的药效物质基础成分,尤其对枸橼酸引起的豚鼠咳嗽次数有显著的抑制作用。赵金明等[54]的研究发现射干提取液中化合物鸢尾黄素(2)及鸢尾苷(1)可以抑制组织多肽抗原(tissue polypeptide antigen,TPA)或胡萝卜素(thapsigargin)对环氧化酶-2的诱导作用有和抑制前列腺素E2的产生,并认为射干的抗炎机制可能与此关[55]。李国信等[56]通过实验对射干提取物中鸢尾苷(1)和鸢尾黄素(2)在大鼠体内药动学进行研究,发现ig给予相当于32倍临床等效剂量即10.8 g/kg鸢尾黄素(2)比鸢尾苷(1)在体内的抗炎药效发挥更持久。汪天青[57]对射干活性组分进行分子对接实验,实验过程中发现射干药材主要是通过干预花生四烯酸环氧化酶-2(cyclooxygenase-2,COX-2)、细胞色素P450(cytochrome P450,CYP450)信号通路达到抗炎、止咳作用。卞娅等[58]在实验中发现射干的根茎、叶片提取物的高、中、低浓度剂量(2.37、1.19、0.60 g/kg)组均对涂抹二甲苯(0.02 mL)小鼠耳肿胀有抑制作用,证明了其具有一定的抗炎作用。刘雨娟等[59]在研究射干对河西走廊地区沙尘所致大鼠慢性咽炎的保护作用时。通过实验发现射干可通过肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)受体介导的信号转导途径、下调核转录因子-κ(nuclear transcription factor-κ,NF-κ)的表达水平,阻断沙尘损伤咽部组织。
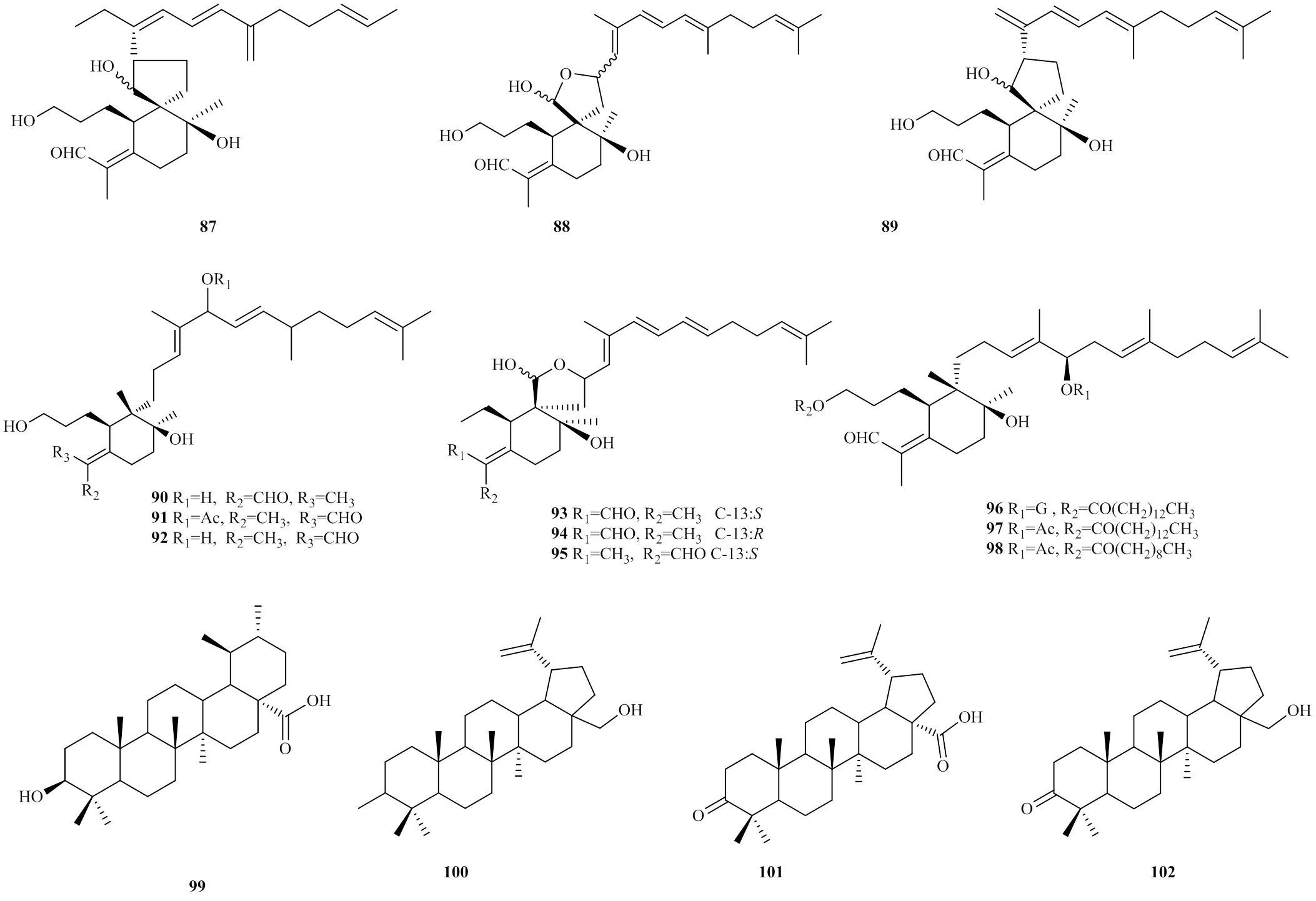
图2 萜类成分的结构
Fig.2 Structure skeleton of terpenoids
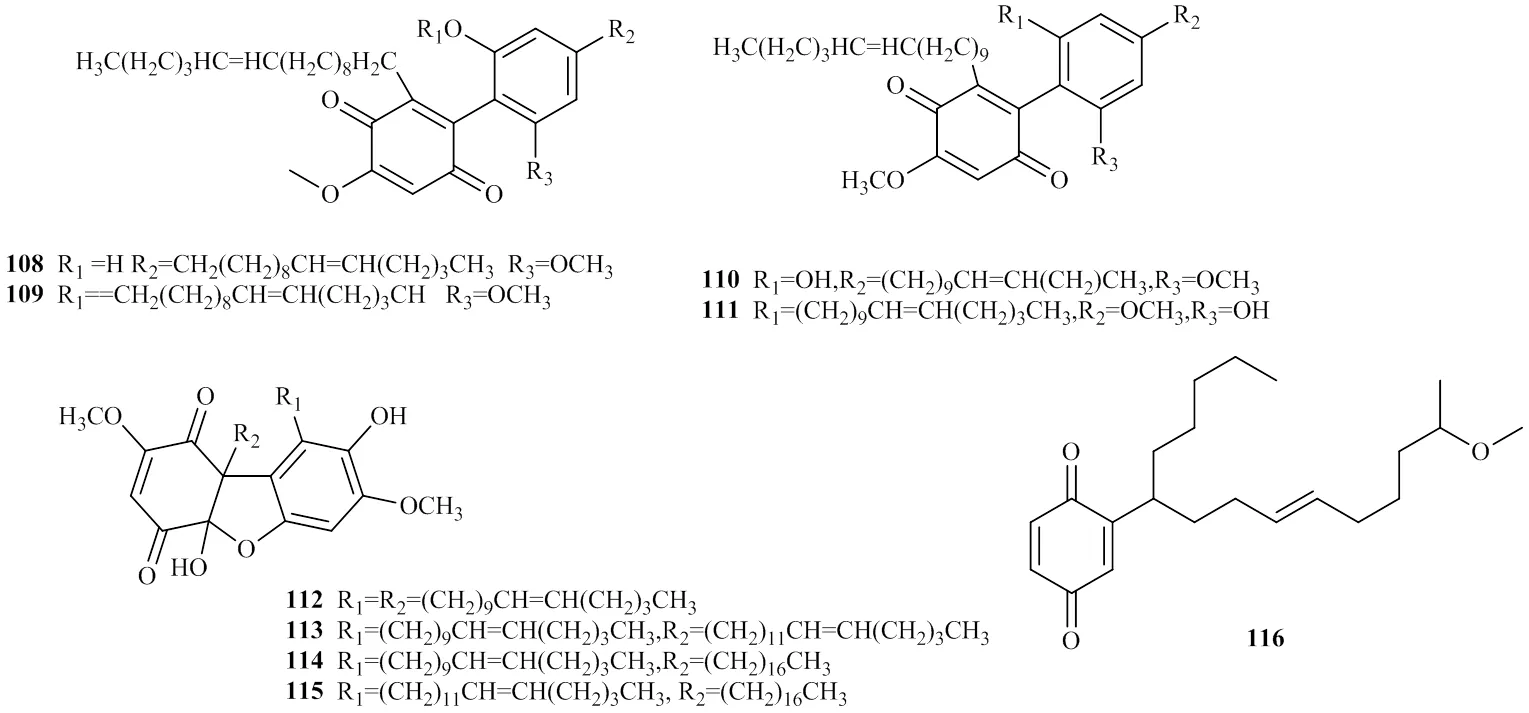
图3 醌类成分的结构
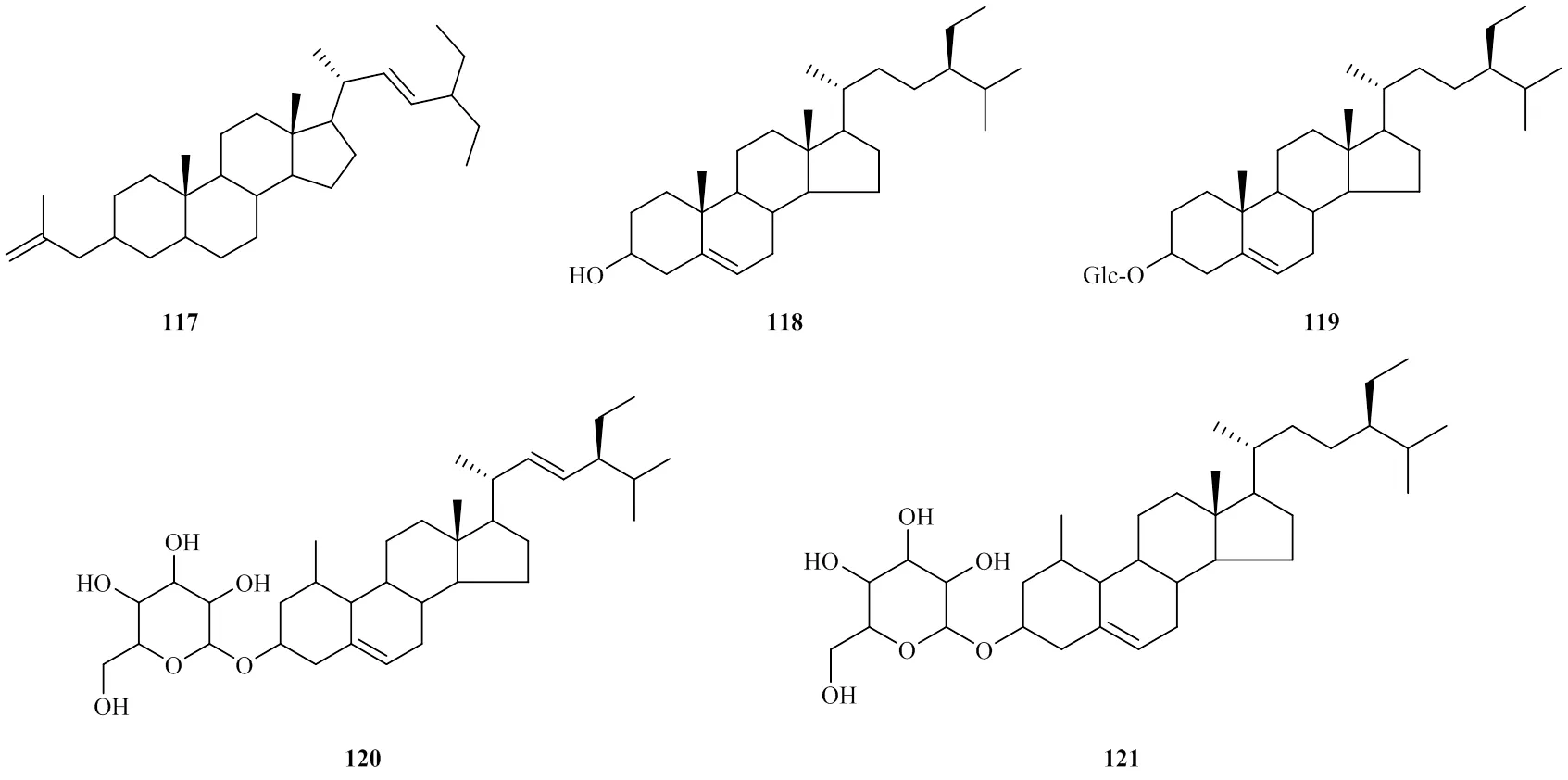
图4 甾体类成分的结构
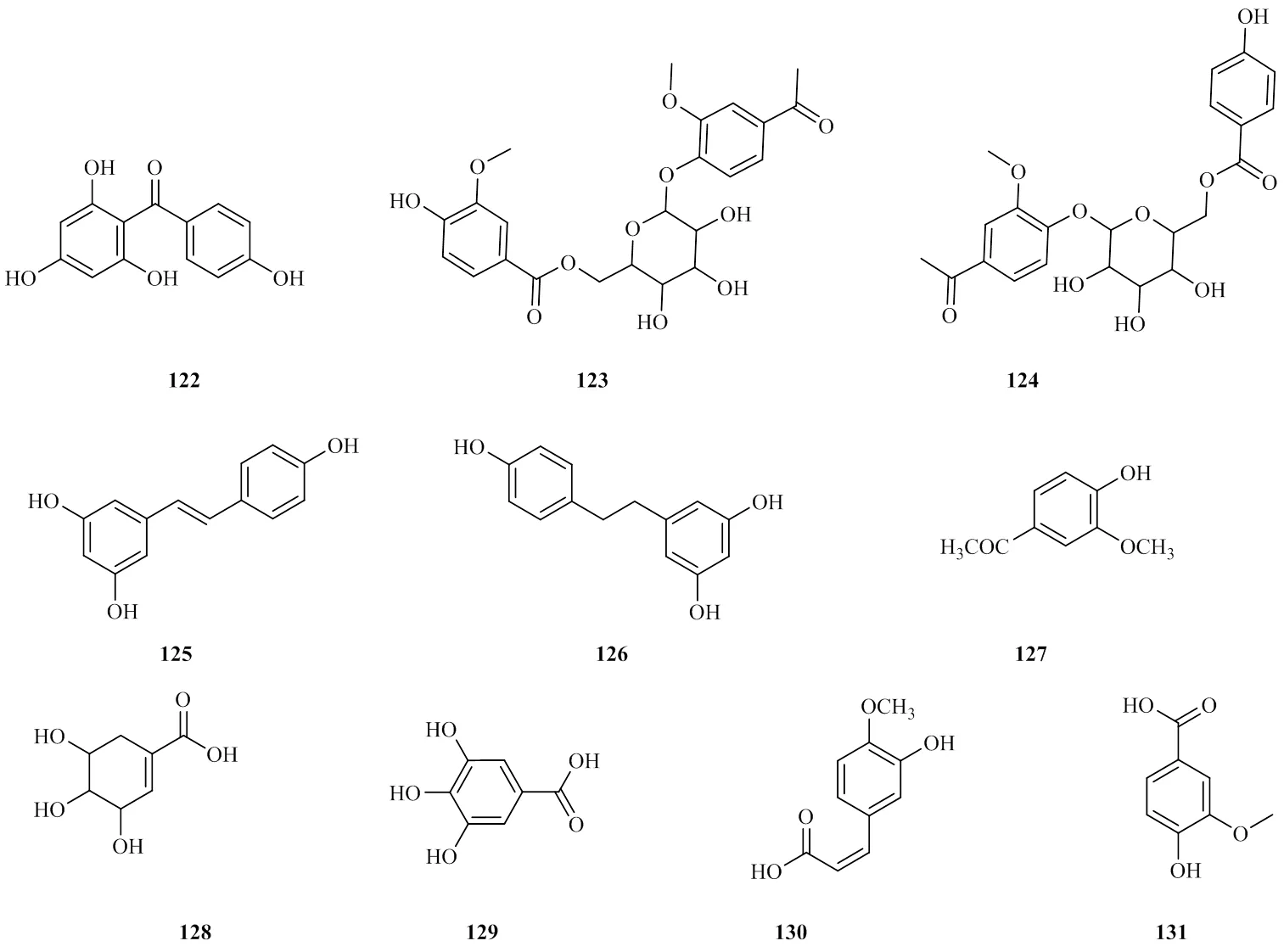
图5 有机酸类成分的结构
除了典型的异黄酮类成分外,射干属植物中的一些其他成分同样具有抗炎活性。张玉奎等[60]在射干叶中发现新成分芒果苷(82),可抑制肥大细胞介导的炎症反应,同时减轻由花生四烯酸和佛波醇肉豆蔻酸乙酸酯(phorbol diester phorbol myristis acetate,PMA)引起的小鼠耳浮肿。异丹叶大黄素、白藜芦醇(125)和茶叶花宁对5-脂氧合酶(5-lipoxygenase,5-LO)和环氧化酶(cyclooxygenase,COX)有较强的抑制作用。综上分析,射干中主要脂溶性成分[61],如鸢尾黄素(2)、鸢尾苷(1)、芒果苷(82)、白藜芦醇(125)和茶叶花宁、异丹叶大黄素等均具有抗炎活性。
2.2 抗病毒作用
射干作为我国传统清热解毒类中药,现代药理研究表明其具有抗病毒的药理作用。目前有研究发现[62-63],射干有效成分鸢尾苷(1)、鸢尾黄素(2)、野鸢尾苷(6)、野鸢尾黄素(7)、德鸢尾苷(68)、次野鸢尾黄素(69)在组织细胞培养方法下对疱疹I、呼吸道合胞病毒、柯萨奇16、腺病毒3型、疱疹II及腺病毒7型等病毒具有抑制作用。向谈婷等[64]采用实时定量PCR对禽传染性支气管炎病毒N基因(infectious bronchitis virus-N,IBV-N)和干扰素-β(interferon-β,IFN-β)mRNA的表达量进行检测,以及采用Western blotting法对IBV-N蛋白的表达量进行检测,证明了射干乙醇提取物对禽传染性支气管炎病毒(infectious bronchitis virus,IBV)的体外抑制作用。射干中的野尾鸢尾黄素(7)在培养组织中可抗流感病毒[65],延迟柯萨奇病毒与埃可病毒引起的细胞病变,具有抗肺炎球菌活性。其对毛细血管通透性增高,有抑制作用,肉芽组织增生有治疗作用。
2.3 抗菌作用
张宏等[66]采用体外及体内抑菌法,对射干提取物进行了抑菌实验研究。体外实验结果表明射干提取物对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、停乳链球菌、肺炎链球菌有抑制作用。体内实验结果表明,射干提取物可明显降低金黄色葡萄球菌感染小鼠死亡率的作用(<0.05)。秦文艳等[67]进行了射干提取物体内体外抑菌作用的研究,采用2倍稀释法检测射干提取物的最小抑菌浓度(minimum inhibitory concentration,MIC),发现射干提取物对金黄色葡萄球菌、肺炎链球菌、大肠埃希菌、铜绿假单胞菌等体内体外所有菌株均有抑制作用。在体外抗耐多药结核菌试验中[68]发现射干有较好的抑制耐多药菌生长的作用,并且可在1∶4稀释浓度的培养基中无细菌生长,研究者猜测抗菌效果可能和鸢尾苷(1)有关。
2.4 抗氧化作用
众多研究表明,黄酮类化合物具有抗自由基的作用[69-71],而射干较其它一些含有黄酮类化合物的中药,其整体清除自由基能力更强。射干根茎中分离得到的异黄酮成分鸢尾苷(1)、鸢尾黄素(2)、野鸢尾黄素(7)、5,6,7,3′-四羟基-8-甲氧基异黄酮(37)均具有清除自由基的作用,其中鸢尾黄素(2)清除H2O2氧自由基的能力和活性都最强[72]。
段丽红等[73]选择氧自由基清除、羟基自由基清除、二苯代苦味肼基自由基清除、烷基自由基清除和抗油脂氧化作用等实验体系进行抗氧化活性的试验,证明了纯化得到的鸢尾苷(1)有较显著的抗氧化作用。张业等[74]研究证明射干种子的80%乙醇提取液对2,2-二苯基-1-苦肼基自由基(2,2-diphenyl- 1-picrylhydrazyl,DPPH)的清除率最高。可能是因为在强极性溶剂中更容易发生氢键效应,导致自由基清除剂的活性降低。同时,秦民坚等[75]在通过生物化学发光法对射干的甲醇提取物和天然产物单体清除自由基的能力进行研究时发现,检测射干类中药甲醇提取物及单体化合物清除O、OH+、H2O2的作用,认为抗自由基的作用可能是射干类药物防治疾病的机制之一。射干中异丹叶大黄素的化学结构与白藜芦醇(125)相似,能显著抑制各种氧化应激促进肝粒体、脑线粒体和突触体内二醛形成,以及阻止还原型谷胱甘肽水平下降和脂质过氧化反应,增强脂质过氧化作用中过度微弱的化学发光,减少DNA氧化损害。
2.5 雌性激素样作用
现代药理关于射干对于雌性激素样作用的研究较少。冯汉林等[76]建立卵巢切除致大鼠骨质疏松症模型,测定大鼠的骨矿密度(bone mineral density,BMD),骨矿含量(bone mineral content,BMC),血清钙、磷的水平和碱性磷酸酶(alkaline phosphatase,AKP)活性,发现射干总黄酮提取物和射干乙醇提取物能明显改善大鼠因雌激素缺乏引起的骨矿丢失,提高BMD、BMC,改善骨骼力学性能。静脉注射射干提取物能抑制被切除卵巢小鼠的促性腺激素的释放促黄体生成激素(luteinizing hormone,LH)的分泌,证明了射干具有雌性激素样作用。
2.6 抗肿瘤作用
射干属中的鸢尾苷(1)可通过调节肿瘤细胞的生物学特性从而发挥抗肿瘤的作用。研究者[77]在探讨射干苷对卵巢癌SK-OV-3细胞的影响及其作用机制时,发现鸢尾苷(1)发挥治疗卵巢癌的作用机制可能是通过影响磷脂酰肌醇-3激酶/蛋白质丝氨酸苏氨酸激酶信号通路蛋白的活性,从而阻碍细胞的增殖、侵袭和迁移抑制。在体外培养的人肺癌H460细胞下,采用软琼脂集落形成法检测锚定非依赖性生长能力,发现在显微镜下克隆数减少,Matrigel穿膜法检测细胞侵袭能力检测出药物组能穿透人工基底膜的细胞数明显减少,悬浮成球法检测肿瘤干细胞自我更新能力显示细胞球数目减少,高浓度下无细胞数形成,实时荧光定量PCR法检测细胞中微小RNA-21的表达水平。总结出了射干乙醇提取物可以有力抑制肺癌细胞的锚定非依赖性生长能力和侵袭能力,显著下调了肺癌细胞中微小RNA-21的表达水平[78-79]。熊玲凡[80]研究鸢尾苷(1)对结肠癌SW480细胞的毒性作用以及其增殖、侵袭能力的影响。实验数据显示,给药48 h后,射干苷可以抑制SW280细胞的生长,迁移以及克隆增长。Western blotting实验显示,鸢尾苷(1)可以通过上调SW480细胞凋亡相关蛋白Bax(Bcl2-Associated X的蛋白质,Bcl2-Associated X)的表达水平,下调SW480细胞增殖相关蛋白clycin D1、c-myc的表达水平起到抗肿瘤的作用。
2.7 其他作用
射干植物具有广泛的药理活性,除以上药理作用外,还具有抗糖尿病,降血糖作用[81],抗艾滋病病毒(human immunodeficiency virus,HIV),抗血栓,抗过敏等药理作用。Jung等[82]发现射干中的异黄酮成分如鸢尾黄素(2)、野鸢尾黄素(7)及其糖苷显示出强烈的醛糖还原酶抑制作用,以-甘油醛为底物,将化合物作用于链脲佐菌素诱导的糖尿病大鼠,能够显著抑制山梨糖在晶状体、坐骨神经和红细胞中的积蓄,并且野鸢尾黄素(7)的抑制活性更强,鸢尾黄素(2)能够预防和治疗糖尿病综合征。王小利等[83]研究射干提取物在HIV潜伏再激活治疗中的应用,通过中药植物粉碎,用乙醇或乙醚水混合物提取,渗漉,浓缩,发现其具有在制备抗HIV潜伏治疗药物上的应用的用途。有报道称[84],由于鸢尾黄素(2)可抑制花生四烯酸或胶原引起血小板聚集,因而其可能是射干抗血栓的有效成分之一;研究者发现卵清蛋白诱导的大鼠在鸢尾黄素(2)的干预下皮肤过敏的抑制率为40%。
3 质量标志物的预测分析
射干所含化合物种类多样,分布广泛,但目前《中国药典》2020年版仅对其中的野鸢尾黄素进行含量限定,同许多中药材一样,射干也存在着质控指标单一等问题。因此,需要更能体现其专属性和整体价值的质量评价方法。中药质量标志物是刘昌孝院士[85]提出的新概念,是指存在于中药材和中药产品(中药饮片、中药煎剂、中药提取物等)中固有或加工制备过程中形成的,与中药的功能属性密切相关的化学物质,作为反映中药安全性和有效性的标示性物质。通过文献分析,基于中药质量标志物的核心概念,对射干质量标志物进行预测,有利于建立中药射干的质量控制办法。
3.1 基于植物亲缘学及化学成分可测性的Q-Marker预测分析
中药的有效成分多为其次生代谢产物,不同植物具有不同遗传物质基础和生物合成途径,因而可生成特异的次生代谢产物[86]。近年研究表明,植物次生代谢物质不仅具有广泛的生物活性,而且它们在植物进化中起到不可或缺的作用,具有广泛的生态学意义。射干来源于百合目鸢尾科射干属,分布于全世界的热带、亚热带及温带地区。射干属分为2个组,我国仅有1种,其广布于全中国,主要生于林缘或山坡草地,大部分生于海拔较低的地方,在西南山区,海拔2000~2200 m处也可生长。
化学成分的可测性是中药Q-Marker的基本条件之一。射干含有多种化学成分,包括黄酮类、三萜类、挥发油等,其中异黄酮类成分在射干中的量较大,为其主要药效成分。《中国药典》2020年版规定了射干中野鸢尾黄素的测定方法和限度要求。姜鸿等[87]采用UPLC法对药材射干中10个成分鸢尾苷(1)、鸢尾黄素(2)、鸢尾甲苷A、鸢尾甲苷B、野鸢尾苷(6)、野鸢尾黄素(7)、鸢尾甲黄素A(8)、鸢尾甲黄素B(9)、次野鸢尾黄素(69)、白射干素(70)进行含量测定。该10个有效成分主要覆盖了射干主要成分异黄酮类。王晓月等[88]采用HPLC-VWD法测定复方黄芩射干汤中4个异黄酮成分鸢尾苷(1)、野鸢尾苷(6)、鸢尾黄素(2)、次野鸢尾黄素(69)的含量。尤献民等[89]建立RP-HPLC法同时测定射干药材中鸢尾苷(1)、鸢尾黄素(2)、野鸢尾苷(6)、野鸢尾黄素(7)、鸢尾甲黄素A(8)、鸢尾甲黄素B(9)、次野鸢尾黄素(69)、白射干素(70)、及芒果苷(82)9种成分的含量。孙朝荣等[90]利用反相高效液相色谱法测定射干合剂中次野鸢尾黄素(69)含量。冯传卫等[91]利用紫外分光光度法对射干中的总异黄酮的含量进行测定。综上所述,射干中黄酮类成分与其有效性密切相关,且能采用高效液相色谱法进行定量分析,可作为是其可能的主要药效物质基础,可作为其Q-Marker。宜根据不同化学成分的差异,建立专属性测定方法,为质量评价标准的建立提供科学依据。
3.2 基于传统功效的Q-Marker预测分析
传统功效(功能主治)是对中药有效性的概括,也是临床用药的依据[92]。射干始载于《神农本草经》,现收载于《中国药典》2020年版中,具有祛痰利咽、消癖散结、清热解毒、消肿止痛的功效,临床常用于治疗感受风热或痰热壅盛引起的咽喉肿痛、痰涎壅盛等症,是中医治疗喉痹咽痛之要药。异黄酮类化合物是射干的主要有效成分类型。异黄酮类化合物属于植物雌激素类化合物,在治疗雌激素依赖性疾病、肿瘤、心血管疾病及神经退行性疾病等方面具有良好的效果,并具有抗过敏、抗炎、抗糖尿病及肝保护等[93]作用。射干中的鸢尾苷(1)、鸢尾黄素(2)、染料木素(49)、白射干素(70)这几类与射干的传统功效相似[58],是射干传统功效的主要药效物质基础,同时也是射干Q-Marker筛选的主要途径和重要依据。
3.3 基于传统药性的Q-Marker预测分析
药的性味归经是中药的基本属性,也是临症治法、遣药组方的重要依据,因此,也应作为Q-Marker确定的依据之一。《中国药典》2020年版中记载,射干味苦、辛,性寒,微毒,归肺、肝经。苦味药的化学成分多以黄酮类、醌类、苷类、生物碱为物质基础,且三萜类化合物多味苦[94];含有挥发油,各种苷类、生物碱等物质的药物则呈现为辛味。通过以上分析,射干中的三萜类、黄酮类和挥发油成分应作为其Q-Marker选择的重要参考依据。
3.4 基于不同配伍中表达组分的Q-Marker预测
临床用药一般以复方多见,根据不同的病症,配伍不同方剂药物以达到驱除疾病的目的。射干具有止咳化痰的功效,是中医治疗喉痹咽痛之要药。射干-麻黄来自《金匮要略》中的射干麻黄汤,射干-麻黄药对是寒温配伍的经典药对,在临床上广泛应用于支气管哮喘的治疗。射干中的野鸢尾黄素(7)具有改善气道炎症作用;麻黄具有宣肺平喘、发汗解表以及消肿利水的功效,麻黄总生物碱为麻黄的主要有效成分[95],具有扩张支气管作用,其中麻黄碱含量最高。射干黄芩汤现临床用于治疗咳嗽,其作用机制推测为是通过干预花生四烯酸炎症通路中COX-2发挥抗气道炎症作用[96],射干止咳的主要药效物质基础为白射干素(70),而黄芩抗炎主要药效物质基础[97]为黄芩苷和黄芩素。2味中药配伍的其一目的就是增效[98],发挥药效作用起着一定的促进意义。现代临床应用射干配伍治疗哮喘疾病时,应将其改善支气管成分作为方剂配伍Q-Marker的选择参考;在止咳镇痛时,应将止咳抗炎成分作为方剂配伍Q-Marker的选择参考。中药多以配伍形式应用于临床[99],针对不同病症所选用不同的方剂配伍治疗,故选择不同的Q-Marker作为中药方剂配伍质控指标更具有现实意义。
3.5 基于不同产地和采收时期的Q-Marker预测分析
中药的产地、采收期是中药质量控制的源头环节,与药物有效成分含量密切相关。同一药材因受到不同产地生态环境和采收时期的影响,其有效成分的差异性也很大。张倩玉[100]选择了河南、河北、湖北、湖南、安徽、贵州、四川7个省,对不同产地射干的活性成分进行对比研究,通过对射干苷等10个抗炎止咳活性成分单体进行测定的含量测定方法,发现湖南射干中抗炎止咳活性成分的总含量远远高于其他产地射干。湖南、湖北射干抗炎有效成分鸢尾黄素(1)、鸢尾甲黄素A(8)、鸢尾甲黄素B(9)、野鸢尾黄素(7)含量显著大于其他产地;止咳有效成分野鸢尾黄素(7)、白射干素(70)含量,安徽射干与湖北射干最高,湖南射干最低。普冰清等[101]建立了HPLC法测定二年生和三年生栽培射干春、秋季不同采收时间中12种黄酮类成分含量的动态变化,研究发现春季采收期二年生和三年生射干以5月上旬和中旬含量最高。秋季采收期,二年生射干中黄酮苷含量于9月末达到最高,黄酮苷元含量于10月初达到最高;三年生射干中黄酮苷和苷元含量均于11月初达到最高。综上所述,不同的采收期和产地对射干黄酮类成分的含量有显著影响,故为更好评价不同采收期和产地射干的质量,可将黄酮类成分作为其Q-Marker的重要来源。
3.6 基于药动学的Q-Marker预测分析
射干具有治疗流感及上呼吸道感染作用,主要效应成分为射干异黄酮类化合物。杨万军等[102]研究麻黄与射干配伍对大鼠体内射干异黄酮类成分药动学的影响,建立了UHPLC-MS/MS方法测定血浆中射干异黄酮类成分鸢尾黄素(2)、野鸢尾黄素(7)及次野鸢尾黄素(69)的量,发现鸢尾黄素(2)和次野鸢尾黄素(69)在大鼠体内含量较高。有研究表明,在浊点萃取最优条件为Triton X-114浓度5%,加入0.3 mol/L盐酸50 μL调至酸性、平衡温度50 ℃,平衡时间20 min的基础上,发现给予射干提取物次野鸢尾黄素(69)后使气道炎症豚鼠血浆中升高的LTB4浓度得到显著回调[103]。还有实验通过对ig鸢尾苷(1)和鸢尾黄素(2)研究其在大鼠体内的药动学。结果表明,鸢尾苷(1)及鸢尾黄素(2)的吸收较快以及达峰时间相同,但鸢尾黄素(2)的消除半衰期比鸢尾苷消除半衰期长,说明它在体内的药效有可能发挥得更持久[104]。赵金明等[105]在探讨射干提取物发挥止咳作用的药效动力学过程中,证实了含有鸢尾苷(1)、鸢尾黄素(2)、次野鸢尾黄素(69)的射干提取混合物在小鼠体内均呈一室模型特征,均具有明显的止咳效果,抑制咳嗽次数的作用强度及延长咳嗽潜伏期的作用强度随着剂量的增大而增强。依照分析可知,除了药典已列出的次野鸢尾黄素(69)外,鸢尾黄素(2)和野鸢尾黄素(7)可作为射干药材Q-Marker的主要选择。
4 结语
射干为我国传统中药,应用历史悠久,具有多方面的药理活性,疗效确切,还有新的药理作用,如抗溃疡、射干与麻黄联用的射干麻黄汤在治疗咳嗽有良好的应用前景等。现行对射干的标准仅是药材中的异黄酮成分次野鸢尾黄素含量作为药材是否合格的指标,射干作为清热药发挥其功效与所含化学成分密不可分,其中的黄酮类成分次野鸢尾黄素为其抗炎、抗病毒疗效的主要物质基础。除以上射干还具有毒鱼活性的鸢尾醛型三萜类化合物等。中药中所含成分多种多样,单一指标成分难以表征中药复杂体系质量属性的完整性,仅以次野鸢尾黄素来作为射干质控指标与药效的关联性不够。
本文在系统综述射干化学成分和现代药理作用研究现状的基础上,以中药质量标志物新概念的理论为指导,根据射干的化学成分和药理作用、传统功效、性味、成分可测性、入血化学成分及配伍变化,对射干的中药质量标志物的预测和筛选进行了初步分析,其中以鸢尾苷(1)、鸢尾黄素(2)、野鸢尾黄素(7)、白射干素(70)、芒果苷(82)表现最为显著,可将这些化合物作为射干药材的潜在中药Q-Marker,再进一步深入的考察探究。因此,为了更好地开发利用射干资源,有必要继续对其化学成分、药理作用、作用机制进行深入研究,并结合疾病发生的特点,多层次、多方位、多靶点深入探讨其作用机制和功效,注重将其化学成分研究和药理活性研究相结合,以阐明药效物质基础,为射干深入开发应用提供依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 张艳阳, 关琛, 袁卉馥.射干现代研究进展浅析 [J].农业科技通讯, 2020(2): 28-29.
[2] 尹竹君, 陈世龙, 李莉, 等.川射干的基础研究与临床转化应用[J].世界中医药, 2020, 15(2): 200-207.
[3] Liu E Y, Zheng Z X, Zheng B Z,.Tectorigenin, an isoflavone aglycone from the rhizome of, induces neuronal expression of erythropoietin via accumulation of hypoxia-inducible factor-1α [J]., 2020, 34(6): 1329-1337.
[4] Tian M, Zhang X, Zhu Y,.Global transcriptome analyses reveal differentially expressed genes of six organs and putative genes involved in ()flavonoid biosynthesis in[J]., 2018, 9: 1160.
[5] Li S, Li S, Tang Y,.Ultrafiltration-LC-MS combined with semi-preparative HPLC for the simultaneous screening and isolation of lactate dehydrogenase inhibitors from[J]., 2016, 39(23): 4533-4543.
[6] Chen Y J, Liang Z T, Zhu Y,.Tissue-specific metabolites profiling and quantitative analyses of flavonoids in the rhizome ofby combining laser-microdissection with UHPLC-Q/ TOF-MS and UHPLC-QqQ-MS [J]., 2014, 130: 585-597.
[7] Zhu Y, Pu B Q, Xie G Y,.Dynamic changes of flavonoids contents in the different parts of rhizome ofduring the thermal drying process [J]., 2014, 19(7): 10440-10454.
[8] Jun H J, Hoang M H, Lee J W,.Iristectorigenin B isolated fromis a liver X receptor modulator that increases ABCA1 and ABCG1 expression in macrophage RAW 264.7 cells [J]., 2012, 34(12): 2213-2221.
[9] Zhang L, Wei K H, Xu J P,.(L.) DC-An ethnopharmacological, phytochemical and pharmacological review [J]., 2016, 186: 1-13.
[10] Gu J F, Wu W J, Huang M W,.Application of high-performance liquid chromatography coupled with linear ion trap quadrupole orbitrap mass spectrometry for qualitative and quantitative assessment of shejin-liyan granule supplements [J]., 2018, 23(4): 884.
[11] Zhang Y Y, Wang Q, Qi L W,.Characterization and determination of the major constituents in Belamcandae Rhizoma by HPLC-DAD-ESI-MS(n) [J]., 2011, 56(2): 304-314.
[12] Liu W N, Luo J G, Kong L Y.Application of complexation high-speed counter-current chromatography in the separation of 5-hydroxyisoflavone isomers from(L.) DC [J]., 2011, 1218(14): 1842-1848.
[13] Woźniak D, Matkowski A.Belamcandae chinensis rhizome: A review of phytochemistry and bioactivity [J]., 2015, 107: 1-14.
[14] Szandruk M, Merwid-Ląd A, Szeląg A.The impact of mangiferin fromon experimental colitis in rats [J]., 2018, 26(2): 571-581.
[15] Moriyasu M, Igi Y, Ichimaru M,.New isoflavones from belamcandae rhizoma [J]., 2007, 61(3): 329-333.
[16] Zhang Y Y, Wang Q, Qi L W,.Characterization and determination of the major constituents in Belamcandae Rhizoma by HPLC-DAD-ESI-MS(n) [J]., 2011, 56(2): 304-314.
[17] Liu M, Yang S, Jin L,.Chemical constituents of the ethyl acetate extract of(L.) DC roots and their antitumor activities [J]., 2012, 17(5): 6156-6169.
[18] Wei Y, Shu P, Hong J,.Qualitative and quantitative evaluation of phenolic compounds inPall [J]., 2012, 23(3): 197-207.
[19] Li J, Ni G, Liu Y,.Iridal-type triterpenoids with a cyclopentane unit from the rhizomes of[J]., 2019, 82(7): 1759-1767.
[20] Ha D T, Binh B T, Thu N T,.Four new compounds isolated from the aerial part of(L.) and their effect on vascular smooth muscle cell (VSMC) proliferation [J].(), 2019, 67(1): 41-46.
[21] Jin L, Chen H S, Jin Y S,.Chemical constituents from[J]., 2008, 10(1/2): 89-94.
[22] Kang S W, Kim M C, Kim C Y,.The rapid identification of isoflavonoids fromby LC-NMR and LC-MS [J]., 2008, 56(10): 1452-1454.
[23] Won S W, Eun H W.An isoflavone noririsflorentin from[J]., 1993, 33(4): 939-940.
[24] Peng C, Liang Y, Wang X,.Preparative isolation and purification of flavonoids from the Chinese medicinal herbby high-speed countercurrent chromatography [J]., 2009, 32(16): 2451-2461.
[25] Jung S H, Lee Y S, Lee S,.Anti-angiogenic and anti-tumor activities of isoflavonoids from the rhizomes of[J]., 2003, 69(7): 617-622.
[26] Yamaki M, Kato T, Kashihara M,.Isoflavones of[J]., 1990, 56(3): 335.
[27] Feng C W, Shen G.Studies on chemical constituents of[J]., 2010, 30(10): 1120-1122.
[28] Moriyasu M, Igi Y, Ichimaru M,.New isoflavones from belamcandae rhizoma [J]., 2007, 61(3): 329-333.
[29] Moein M, Khan S, Ali Z,.Flavonoids fromsongaricaand their antioxidant and estrogenic activity [J]., 2008, 74(12): 1492-1495.
[30] Xie G Y, Zhu Y, Shu P,.Phenolic metabolite profiles and antioxidants assay of three Iridaceae medicinal plants for traditional Chinese medicine “She-Gan” by on-line HPLC-DAD coupled with chemiluminescence (CL) and ESI-Q-TOF-MS/MS [J]., 2014, 98: 40-51.
[31] Guo F, Wang X, Liu X.Protective effects of irigenin against 1-methyl-4-phenylpyridinium-induced neurotoxicity through regulating the Keap1/Nrf2 pathway [J]., 2021, 35(3): 1585-1596.
[32] Lee S, Woo W S, Woo E H,.Isoflavonoids of[J]., 1989, 20(4): 219-222.
[33] Lee Y S, Kim S H, Kim J K,.Preparative isolation and purification of seven isoflavones from[J]., 2011, 22(5): 468-473.
[34] Lee J W, Lee C, Jin Q,.Chemical constituents fromand their inhibitory effects on nitric oxide production in RAW 264.7 macrophage cells [J]., 2015, 38(6): 991-997.
[35] Li J, Ni G, Li L,.New iridal-type triterpenoid derivatives with cytotoxic activities from[J]., 2019, 83: 20-28.
[36] Zhang C L, Wang Y, Liu Y F,.Iridal-type triterpenoids with neuroprotective activities from[J]., 2014, 77(2): 411-415.
[37] Lee Y S, Kim S H, Kim J K,.Preparative isolation and purification of seven isoflavones from[J]., 2011, 22(5): 468-473.
[38] Song Z J, Xu X M, Deng W L,.A new dimeric iridal triterpenoid fromwith significant molluscicide activity [J]., 2011, 13(3): 462-465.
[39] Liu M, Yang S, Jin L,.Chemical constituents of the ethyl acetate extract of(L.) DC roots and their antitumor activities [J]., 2012, 17(5): 6156-6169.
[40] 伍实花, 张国刚, 左甜甜, 等.射干化学成分的分离与鉴定 [J].沈阳药科大学学报, 2008, 25(10): 796-799.
[41] Song Y Y, Miao J H, Qin F Y,.Belamchinanes A-D from: Triterpenoids with an unprecedented carbon skeleton and their activity against age-related renal fibrosis [J]., 2018, 20(17): 5506-5509.
[42] Fukuyama Y, Okino J, Kodama M.Structures of belamcandols A and B isolated from the seed of[J]., 1991, 39(7): 1877-1879.
[43] Seki K, Haga K Z, Kaneko R.Belamcandones A-D, dioxotetrahydrodibenzofurans from[J]., 1995, 38(3): 703-709.
[44] 从仁怀.大别山道地药材射干指纹图谱研究及主要药用成分分析 [D].武汉: 华中科技大学, 2007.
[45] 吉文亮, 秦民坚, 王峥涛.射干的化学成分研究(I) [J].中国药科大学学报, 2001, 32: 39-41.
[46] Monthakantirat O, De-Eknamkul W, Umehara K,.Phenolic constituents of the rhizomes of the Thai medicinal plantwith proliferative activity for two breast cancer cell lines [J]., 2005, 68(3): 361-364.
[47] 张伟东, 王晓娟, 杨万军, 等.射干的化学成分研究 [J].中国医院药学杂志, 2011, 31(6): 435-436.
[48] 秦文艳, 赵金明, 齐越, 等.射干提取物体内体外抑菌作用的研究 [J].中国实验方剂学杂志, 2011, 17(4): 147-150.
[49] Zhou L X, Lin M.A new stilbene dimer: Shegansu B from[J]., 2000, 2(3): 169-175.
[50] Yu, Y., G., Wang, C.H., Liu, D,l.Studies on fat soluble constituents from Belamcanda chinensis [J].Sin.1998, 18: 969–972.
[51] 秦民坚, 王强, 徐珞珊, 等.射干和鸢尾的挥发性成分 [J].植物资源与环境, 1997, 6: 2.
[52] 段玉峰, 刘成德, 罗永红, 等.中药及其水煎液中微量元素的测定及浸出率初步研究 [J].中国药学杂志, 1993, 28(7): 396-398.
[53] 李欣妍, 尤献民, 邹桂欣, 等.射干止咳有效成分白射干素提取优化 [J].辽宁中医杂志, 2016, 43(8): 1699-1701.
[54] 李国信, 秦文艳, 齐越, 等.射干提取物抗炎及镇痛药理实验研究 [J].实用中医内科杂志, 2008, 22(1): 3-4.
[55] 朱竟赫, 赵金明, 秦文艳, 等.白射干素对烟熏及感染后豚鼠止咳作用及血细胞因子的影响 [J].中华中医药学刊, 2016, 34(12): 2902-2904.
[56] 李国信, 王光函, 姜鸿, 等.射干提取物在大鼠体内的药动学研究 [J].中草药, 2010, 41(12): 2052-2053.
[57] 汪天青.基于分子对接的射干抗气道炎症机制研究 [D].沈阳: 辽宁中医药大学, 2017.
[58] 卞娅, 刘孟生, 张丽媛, 等.射干、鸢尾不同部位6种活性成分定量分析及抗炎作用初探 [J].中国中药杂志, 2018, 43(1): 119-122.
[59] 刘雨娟, 王莉, 姚兰, 等.TNF-α介导的NF-κB通路在沙尘导致大鼠慢性咽炎中的作用及射干对其影响 [J].中国老年学杂志, 2018, 38(17): 4254-4256.
[60] 张良, 张玉奎, 戴荣继, 等.射干叶中黄酮碳苷类化合物的药理作用研究进展 [J].天然产物研究与开发, 2010, 22(4): 728-730.
[61] 韦永娜, 王伟鹏.射干药理作用的现代研究进展 [J].黑龙江科技信息, 2011(19): 22.
[62] 管仲莹, 李国信, 孟莉, 等.射干有效成分体外抗病毒实验研究[J].中华中医药学刊, 2015, 33(8): 1814-1816.
[63] 徐倩.射干不同有效成分体外抗病毒药效学作用分析 [J].亚太传统医药, 2015, 11(18): 9-10.
[64] 向谈婷, 刘卫容, 方守国.射干乙醇提取物抗IBV活性及调控IFN-β表达量作用 [J].中国动物传染病学报, 2019, 27(6): 99-102.
[65] 周小虎.射干、金银花、甘草雾化治疗慢性咽炎的药理分析 [J].光明中医, 2014, 29(4): 855-856.
[66] 张宏, 甘雨, 乔敏, 等.射干提取物抑菌实验研究 [J].实验动物科学, 2012, 29(2): 5-7.
[67] 秦文艳, 赵金明, 齐越, 等.射干提取物体内体外抑菌作用的研究 [J].中国实验方剂学杂志, 2011, 17(4): 147-150.
[68] 刘菊秀, 李美月, 陈辉.7种中药抗耐多药结核分支杆菌的实验研究 [J].中国社区医师: 医学专业, 2011, 13(26): 6.
[69] Wang L , Zhang L , Kang WY.Studies on the antioxidant activity of Rutin scavenging DPPH by spectrophotometry and micro methods.Chinese Tradit Pat Med , 2009, 31: 1785-1787.
[70] 张慧, 张云, 房燕茹, 等.植物黄酮类化合物的药理活性研究进展 [J].石化技术, 2017, 24(6): 211.
[71] 赵雪巍, 刘培玉, 刘丹, 等.黄酮类化合物的构效关系研究进展 [J].中草药, 2015, 46(21): 3264-3271.
[72] 秦民坚, 吉文亮, 刘峻, 等.射干中异黄酮成分清除自由基的作用 [J].中草药, 2003, 34(7): 640-641
[73] 段丽红, 李仲秋, 吴正治, 等.鸢尾苷抗氧化活性的研究 [J].天然产物研究与开发, 2014, 26(12): 2046-2049.
[74] 张业, 方毅林, 王凯, 等.超声波提取射干种子皮及其清除自由基活性研究 [J].桂林师范高等专科学校学报, 2010, 24(2): 171-173.
[75] 秦民坚, 刘俊, 吉文亮, 等.生物化学发光法测定射干类中药清除自由基的作用 [J].药学实践杂志, 2000, 18(5): 304-306.
[76] 冯汉林, 严启新.射干提取物抗雌激素缺乏大鼠骨质疏松的研究 [J].现代药物与临床, 2012, 27(3): 209-213.
[77] 王丽娟, 史惠蓉.射干苷对卵巢癌SK-OV-3细胞增殖迁移和侵袭的影响 [J].中华肿瘤杂志, 2020, 42(7): 570-574.
[78] 王振飞, 刘丽, 陈永霞, 等.射干提取物抑制肺癌细胞恶性行为的研究 [J].国医论坛, 2018, 33(2): 57-59.
[79] Wang J, Tang Y, Lv X,.Tectoridin inhibits osteoclastogenesis and bone loss in a murine model of ovariectomy-induced osteoporosis [J]., 2020, 140: 111057.
[80] 熊玲凡.中药射干提取物射干苷抑制结肠癌细胞增殖及迁移作用的研究 [D].武汉: 湖北中医药大学, 2016.
[81] Guo Y, Dai R, Deng Y,.Hypoglycemic activity of the extracts ofleaves (BCLE) on KK-Aymice [J]., 2019, 110: 449-455.
[82] Jung S H, Lee Y S, Lee S,.Isoflavonoids from the rhizomes ofand their effects on aldose reductase and sorbitol accumulation in streptozotocin induced diabetic rat tissues [J]., 2002, 25(3): 306-312.
[83] 王小利, 杨怡姝, 曾毅, 等.几种中药提取物在HIV潜伏再激活治疗中的应用: CN105079323B [P].2019-08-23.
[84] 张明发, 沈雅琴, 朱自平, 等.辛温(热)合归脾胃经中药药性研究(II)抗溃疡作用 [J].中药药理与临床, 1997(4): 1-5.
[85] 刘昌孝, 陈士林, 肖小河, 等.中药质量标志物(Q-marker): 中药产品质量控制的新概念 [J].中草药, 2016, 47(9): 1443-1457.
[86] 谭世强, 马琳, 许永华, 等.植物三萜类物质的生态学功能研究进展 [J].人参研究, 2015, 27(3): 36-38.
[87] 姜鸿, 王光函, 辛旭阳, 等.UPLC法测定射干药材中10个异黄酮类成分的含量 [J].中国药房, 2019, 30(23): 3216-3220.
[88] 王晓月, 鲁婧, 尹江涛, 等.HPLC法同时测定黄芩射干汤中8种有效成分的含量 [J].中华中医药学刊, 2021, 39(3): 148-150.
[89] 尤献民, 邹桂欣, 邸子真, 等.RP-HPLC同时测定射干9种活性成分含量 [J].中国中医药信息杂志, 2017, 24(1): 82-86.
[90] 孙朝荣, 王廉文.反相高效液相色谱法测定射干合剂中次野鸢尾黄素含量 [J].医药导报, 2016, 35(S1): 99-100.
[91] 冯传卫, 沈刚, 赵卫权, 等.中药射干中总异黄酮提取工艺的研究[C]//中国医药教育协会成人教育委员会三届五次理事大会暨医药教育创新研究和慢病防治学术研讨会[A] 西安: 中国医药教育协会成人教育委员会, 2012: 297-302.
[92] 姜程曦, 张铁军, 陈常青, 等.黄精的研究进展及其质量标志物的预测分析 [J].中草药, 2017, 48(1): 1-16.
[93] 佟佳玲, 林森森.对异黄酮类化合物药理作用的研究进展 [J].当代医药论丛, 2019, 17(7): 36-37.
[94] 张静雅, 曹煌, 许浚, 等.中药苦味药性表达及在临证配伍中的应用 [J].中草药, 2016, 47(2): 187-193.
[95] 黄玲, 王艳宁, 吴曙粤.中药麻黄药理作用研究进展 [J].中外医疗, 2018, 37(7): 195-198.
[96] 王晓月.基于分子对接的黄芩射干汤抗炎机制和质量控制研究 [D].沈阳: 辽宁中医药大学, 2019.
[97] 朱亚南, 杨七妹, 张硕, 等.黄芩苷与黄芩素药理作用及机制研究进展 [J].时珍国医国药, 2020, 31(4): 921-925.
[98] 肖治均, 刘传鑫, 杨欣欣, 等.雷公藤研究进展及其质量标志物的预测分析 [J].中草药, 2019, 50(19): 4752-4768.
[99] 刘丽, 张笑敏, 许浚, 等.吴茱萸化学成分和药理作用及质量标志物 (Q-marker)的预测分析 [J].中草药, 2020, 51(10): 2689-2702.
[100]张倩玉.不同产地射干化学成分对比研究 [D].沈阳: 辽宁中医药大学, 2019.
[101]普冰清, 朱艳, 许方云, 等.射干不同采收期黄酮类成分的动态变化规律 [J].药学与临床研究, 2014, 22(3): 212-215.
[102]杨万军, 张伟东, 王莹, 等.射干麻黄配伍对射干异黄酮类成分在大鼠体内药代动力学的影响 [J].中成药, 2012, 34(11): 2094-2099.
[103]杨瑞, 邸子真, 吴怡, 等.浊点萃取结合UPLC-MS/MS法测定气道炎症模型豚鼠灌胃射干提取物后血浆中LTB4的浓度 [J].中国药房, 2018, 29(15): 2086-2090.
[104]李国信, 王光函, 姜鸿, 等.射干提取物在大鼠体内的药动学研究 [J].中草药, 2010, 41(12): 2052-2053.
[105]赵金明, 齐越, 秦文艳, 等.射干提取物止咳药效动力学研究 [J].中药药理与临床, 2011, 27(4): 46-50.
Research grogress ofand predictive analysis of its quality markers
LING Yue1, CHEN Jin-peng2, 3, 4, YE Qing1, LIU Yi-miao1, XU Xu2, 3, 4, TIAN Cheng-wang2, 3, 4
1.Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China 2.Tianjin Institute of Pharmaceutical Research, Tianjin 300301, China 3.Tianjin Key Laboratory of Quality Marker of Traditional Medicine, Tianjin 300301, China 4.State Key Laboratory of Drug Delivery and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300301, China
is a commonly used Chinese medicinal material in China, which has abundant resources, wide distribution and broad prospects for development and utilization.The chemical compositions are rich in, including flavonoids, triterpenes, volatile oils, steroids.etc.Traditionally, isoflavones are considered to be the main medicinal ingredients.Based on the summarization of its chemical components and pharmacological effects, the Q-Markers ofare predicted from the aspects of chemical components, traditional properties, detectable components, different producing areas, collecting periods, components entering blood and different compatibility environments.It was found that iris, iris flavin, wild kite flavin, eucalyptin and mangiferin were the most significant, which can provide basis for clarifying the Q-Markers and establishing scientific quality standardsof.
(L.) DC.; isoflavone; quality marker;iris; iris flavin; wild kite flavin; eucalyptin; mangiferin
R28
A
0253 - 2670(2022)05 - 1595 - 14
10.7501/j.issn.0253-2670.2022.05.035
2021-10-08
国家重大新药创制专项(2019ZX09201005);国家自然科学基金青年科学基金项目(82003936);中医药国际合作专项(基地类项目)(0610-2140NF020630)
凌 悦,硕士研究生,药物分析与质量标志物研究。E-mail: 18361140199@163.com
通信作者:田成旺,研究员。E-mail: tiancw@tjipr.com
[责任编辑 王文倩]
——鸢尾花