荷斯坦奶牛不同群体牛舍土壤细菌菌群结构差异分析
杨思瑞,杨 卓,火 苗,张 洁,张力莉,李胜利,徐晓锋,*
(1.宁夏大学 农学院,宁夏 银川 750021;2.中国农业大学 动物科学技术学院,动物营养学国家重点实验室,北京 100193)
土壤微生物群落由细菌、古细菌、病毒、真菌和原生动物组成,细菌和真菌作为土壤中的主要微生物,其生物量通常是其他主要微生物类群(原生生物、古生菌和病毒)的10~10倍。研究表明,土壤优势菌群会受到土壤来源、地表生物活动以及周围环境的影响。植被下的土壤中,细菌多以变形菌门、放线菌门,以及酸杆菌门等为主。用于畜牧业生产的土壤,由于常受到牲畜粪便的污染,其菌群结构有别与常规土壤。张雯通过采集银川周边四家奶牛场的奶牛粪便、土壤、污水样本并进行16S rDNA V4区测序,结果表明,奶牛场土壤的优势菌门为变形菌门、拟杆菌门与放线菌门,与堆积粪便的优势菌门(厚壁菌门、变形菌门、拟杆菌门、放线菌门)基本一致,与新鲜粪便的优势菌门(厚壁菌门、拟杆菌门)差异较大。将蛋鸡养殖区所采集到的新鲜鸡粪和土壤样品的细菌群落结构进行对比发现,与鸡粪细菌优势菌门种类(厚壁菌门、变形菌门、拟杆菌门)相比,土壤细菌优势菌门(变形菌门、拟杆菌门、放线菌门、酸杆菌门、Planctomycetes、Gemmatimonadetes、厚壁菌门)种类更丰富,施用鸡粪后的土壤厚壁菌门与Gemmatimonadetes丰度略有上升,放线菌门丰度下降。别佳等将林蛙人工养殖圈舍与自然栖息地(半人工养殖)的土壤菌群进行对比发现,林蛙养殖密度的增大会降低土壤中厚壁菌门以及放线菌门的丰度,使蓝细菌门的丰度升高。
奶牛养殖中产生的粪便中含有大量的细菌,其中包括很多人畜共患病的致病菌,如奈瑟菌属()、梭杆菌属()、嗜血杆菌属()以及牛布鲁氏杆菌等。这些细菌通过奶牛粪便堆积晾晒后作为卧床垫料或直接排泄至牛舍地面等形式进入牛舍土壤,对人畜健康以及奶牛场环境的卫生安全造成危害。目前对奶牛场土壤微生物的相关研究较少,并且其中大部分研究未将不同群体奶牛牛舍的土壤进行区分。基于荷斯坦奶牛不同群体牛舍土壤之间具有不同的细菌菌群结构这一假设,本试验通过采集宁夏某规模化奶牛场不同群体奶牛牛舍土壤,利用16S rDNA测序,研究不同群体奶牛牛舍土壤细菌菌群结构,为人畜健康与奶牛场环境卫生安全问题的解决提供理论依据。
1 材料与方法
1.1 试验设计
1.2 样本的采集与处理
铲除表层土壤,垂直取距离地表5~10 cm深度的土壤100 g,将同类牛舍中不同位置采集到的土样中随机选取5 g进行混合。土样封装于灭菌袋中,立即带回试验室进行-20 ℃冻存。共18个样品,其中干奶牛舍土壤3个(dcA1、dcA2、dcA3),高产泌乳牛舍土壤3个(hcA1、hcA2、hcA3),哺乳犊牛岛土壤3个(ncA1、ncA2、ncA3),断奶犊牛舍土壤3个(wcA1、wcA2、wcA3),育成牛舍土壤3个(rcA1、rcA2、rcA3),低产泌乳牛舍土壤3个(lcA1、lcA2、lcA3)。将样品送至诺禾致源生物信息科技有限公司进行16S rDNA扩增子测序。
1.3 基因组DNA的提取和PCR扩增
采用磁珠法对样本的基因组 DNA 进行提取,之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样本DNA于离心管中,使用无菌水稀释样本至1 ng·μL。
以稀释后的基因组 DNA 为模板,根据测序区域的选择,使用带 Barcode 的特异引物,New England Biolabs 公司的 Phusion® High-Fidelity PCR Master Mix with GC Buffer,和高效高保真酶进行PCR,确保扩增效率和准确性。
细菌16S rDNA序列的V3+V4区引物序列:上游引物 341F,5′-CCTAYGGGRBGCASCAG-3′; 下游引物 806R,5′-GGACTACNNGGGTATCTAAT-3′。
1.4 PCR产物的混样和纯化
PCR产物使用琼脂糖凝胶(2%质量分数)进行电泳检测;根据PCR产物浓度进行等量混样,充分混匀后使用琼脂糖凝胶(2%质量分数)进行电泳检测PCR产物,对目的条带使用QIAGEN公司提供的胶回收试剂盒回收产物。
1.5 文库构建和上机测序
使用TruSeqDNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,基于Illumina NovaSeq 测序平台进行上机测序。
1.6 测序数据的处理和物种注释
根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样本数据,截去Barcode和引物序列后使用FLASH对每个样本的reads进行拼接,得到的拼接序列为原始Tags数据(Raw Tags);拼接得到的Raw Tags,需要经过严格的过滤处理得到高质量的Tags数据(Clean Tags),之后进行如下操作:a)Tags截取:将Raw Tags从连续低质量值(默认质量阈值为≤19)碱基数达到设定长度(默认长度值为3)的第一个低质量碱基位点截断;b)Tags长度过滤:Tags经过截取后得到的Tags数据集,进一步过滤掉其中连续高质量碱基长度小于Tags长度75%的Tags。经过以上处理后得到的Tags序列通过与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列,得到最终的有效数据(Effective Tags)。
根据薪酬数据公司Equilar曾做过的一项调查分析,从外部挖来的CEO候选人的平均薪酬比内部提拔的高管薪酬远高得多,但他们的表现往往却不尽如人意。外部聘用的风险总是大于内部晋升。基于此,越来越多公司更倾向于从内部物色接班人。那么内部接班人又要从哪来?《哈佛商业评论》的文章中就有提到:研究表明,大多数公司现任领导者的候选人都虚悬以待,但每年大约有10%—15%的公司都不得不面临任命新CEO的问题。人选不佳、仓促更替是企业权杖交接不得不跨过的槛。
利用Uparse软件(Uparse v7.0.1001,http://www.drive5.com/uparse/)对所有样本的全部 Effective Tags进行聚类,默认以97%的一致性(Identity)将序列聚类成为OTUs(operational taxonomic units),用Mothur方法与SILVA132(http://www.arb-silva.de/)的SSUrRNA数据库对OTUs序列进行物种注释分析,设定比对阈值为80%。
2 结果与分析
2.1 OTU分析
基于Illumina Nova 测序平台测序,对所有样本的 Effective Tags 以 97%的一致性(identity)进行OTUs聚类,共得到4 110个OTU。试验各牛舍土壤的OTU数目之间差异均不显著(>0.05),如图1所示,各牛舍土壤共有的OTU数目为857,干奶牛舍土壤、高产泌乳牛舍土壤、哺乳犊牛岛土壤、断奶犊牛舍土壤、育成牛舍土壤、低产泌乳牛舍土壤特有的OTU数目分别为174、80、137、196、77、225。
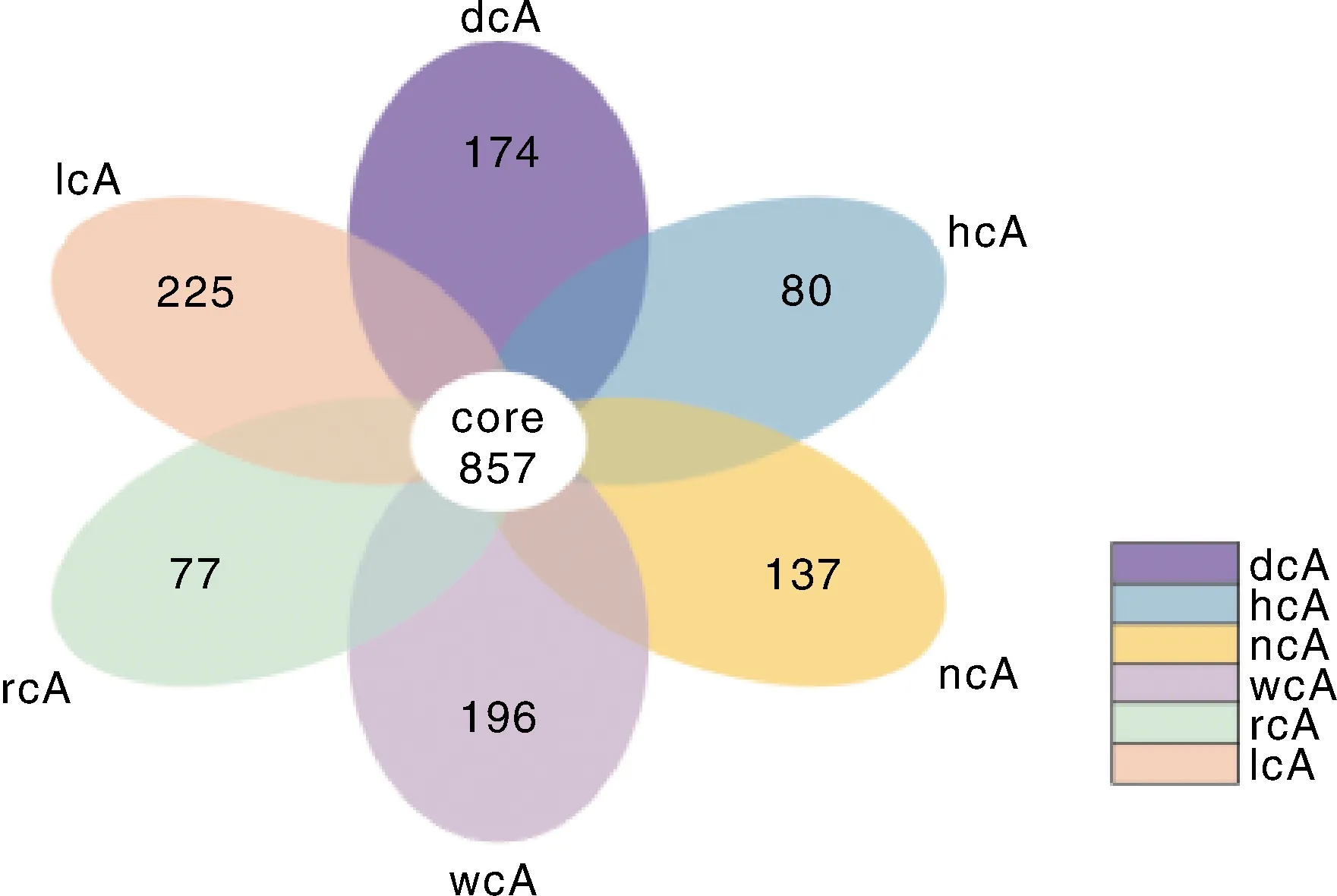
dcA,干奶牛舍;hcA,高产泌乳牛舍;ncA,哺乳犊牛岛;wcA,断奶犊牛舍;rcA,育成牛舍;lcA,低产泌乳牛舍。下同。
2.2 Alpha多样性
2.2.1 稀释曲线
由图2可知,随着测序深度的增加,最终所有曲线都达到了平缓期,说明当前测序深度已经基本覆盖到样品中的所有物种,足够进行样品菌群多样性分析。
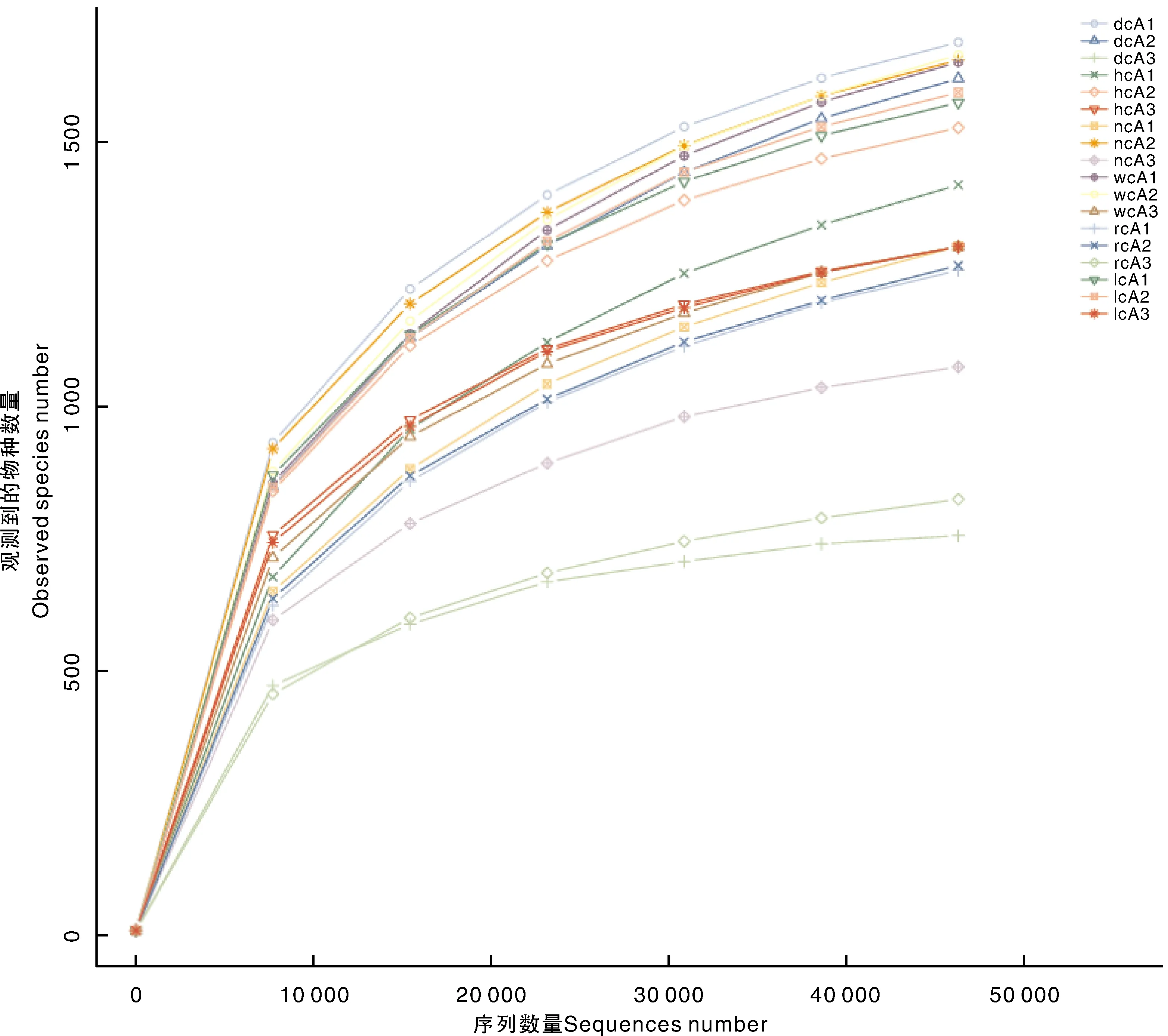
图2 稀释曲线
2.2.2 Alpha多样性指数
Alpha多样性指数中,Ace指数、Observed_species指数和Chao 1指数反映样品中群落的丰富度,而不考虑群落中每个物种的丰度情况。Shannon指数以及 Simpson指数反映群落的多样性,受样品群落中物种丰富度和物种均匀度的影响,Goods_coverage为样品的物种覆盖率。如表1所示,各牛舍土壤细菌菌群的物种覆盖率均达到99%以上,说明测序结果足以反映各牛舍土壤细菌菌群的细菌菌群情况,各牛舍土壤细菌菌群之间Alpha多样性指数均不显著(>0.05),说明各牛舍土壤细菌菌群的物种多样性没有差异。
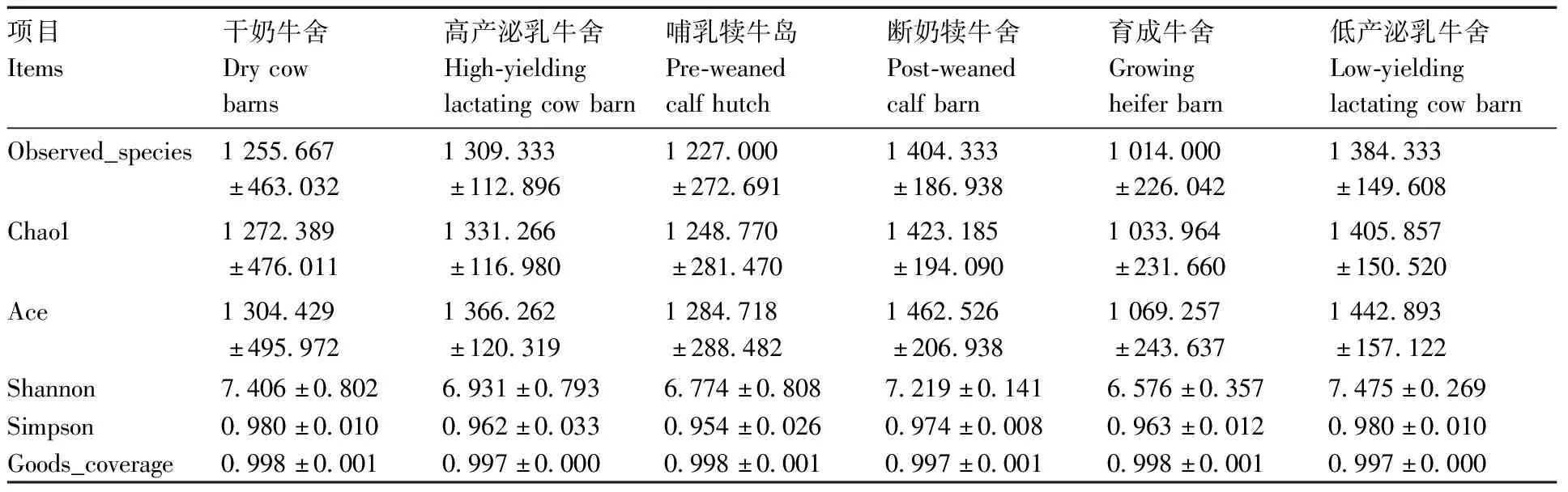
表1 牛舍土壤细菌菌群Alpha多样性指数
2.3 Beta多样性分析
基于Weighted Unifrac距离来进行PCoA分析,并选取贡献率最大的主坐标组合进行作图展示,如果样品距离越接近,表示物种组成结构越相似。
从图3中可以看出,Weighted Unifrac距离的第1主坐标(PC1)和第2主坐标(PC2)的贡献率分别为32.4%与28.57%。各试验牛舍土壤样品的组内距离普遍小于组间距离,相较于其他各牛舍土壤之间的距离,高产泌乳牛舍土壤与低产泌乳牛舍土壤两组之间的距离较近。说明当同时考虑物种有无和物种丰度时,各牛舍土壤样品的组内菌群结构相似度普遍高于组间菌群结构相似度,高产泌乳牛舍土壤与低产泌乳牛舍土壤两组之间的菌群结构较接近。
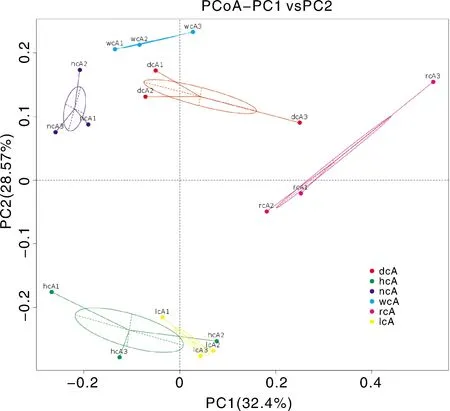
图3 牛舍土壤细菌菌群基于Weighted Unifrac距离的PCoA
2.4 荷斯坦奶牛不同群体牛舍土壤细菌菌群结构差异变化分析
本次测序中,各牛舍土壤于细菌界中共测出37个门、55个纲、126个目、256个科、671个属。
2.4.1 门水平
表2共列出丰度较高的11个菌门,如表2所示,各牛舍土壤共有的优势菌门(丰度>10%)为变形菌门与拟杆菌门,干奶牛舍土壤与哺乳犊牛岛土壤特有的优势菌门为厚壁菌门、放线菌门;泌乳牛舍土壤(高产泌乳牛舍土壤、低产泌乳牛舍土壤)与育成牛舍土壤特有的优势菌门为放线菌门;断奶犊牛舍土壤特有的优势菌门为厚壁菌门。

表2 牛舍土壤细菌门水平丰度
放线菌门丰度比较,泌乳牛舍土壤显著高于其他牛舍土壤(<0.05)。绿弯菌门丰度比较,育成牛舍土壤极显著高于干奶牛舍土壤、高产泌乳牛舍土壤、哺乳犊牛岛土壤(<0.01)。Gemmatimonadates菌门与软壁菌门丰度比较,断奶犊牛舍土壤极显著高于其他牛舍土壤(<0.01)。unidentified_Bacteria丰度比较,哺乳犊牛岛土壤(1.917%)极显著高于其他牛舍土壤(<0.01)。
2.4.2 属水平
表3共列出丰度较高的20个菌属,如表3所示,干奶牛舍土壤的优势菌属(丰度>3%)为、、、脱硫杆菌属、盐单胞菌属,共占24.20%,其中脱硫杆菌属的丰度极显著高于其他牛舍土壤(<0.01)。哺乳犊牛岛土壤的优势菌属为嗜冷杆菌属、鸟杆菌属、、不动杆菌属、,共占29.57%,其中嗜冷杆菌属的丰度极显著高于其他牛舍土壤(<0.01)。断奶犊牛舍土壤的优势菌属为硫碱螺旋菌属、、、,共占26.37%,其中硫碱螺旋菌属的丰度极显著高于其他牛舍土壤(<0.01)。育成牛舍土壤的优势菌属为、、、甲基杆菌属,共占19.80%,其中、的丰度极显著高于其他牛舍土壤(<0.01)。丰度比较,断奶犊牛舍土壤显著高于干奶牛舍土壤、育成牛舍土壤(<0.05),极显著高于哺乳犊牛岛土壤与泌乳牛舍土壤(<0.01),干奶牛舍土壤与育成牛舍土壤极显著高于泌乳牛舍土壤(<0.01),显著高于哺乳犊牛岛土壤(<0.05)。
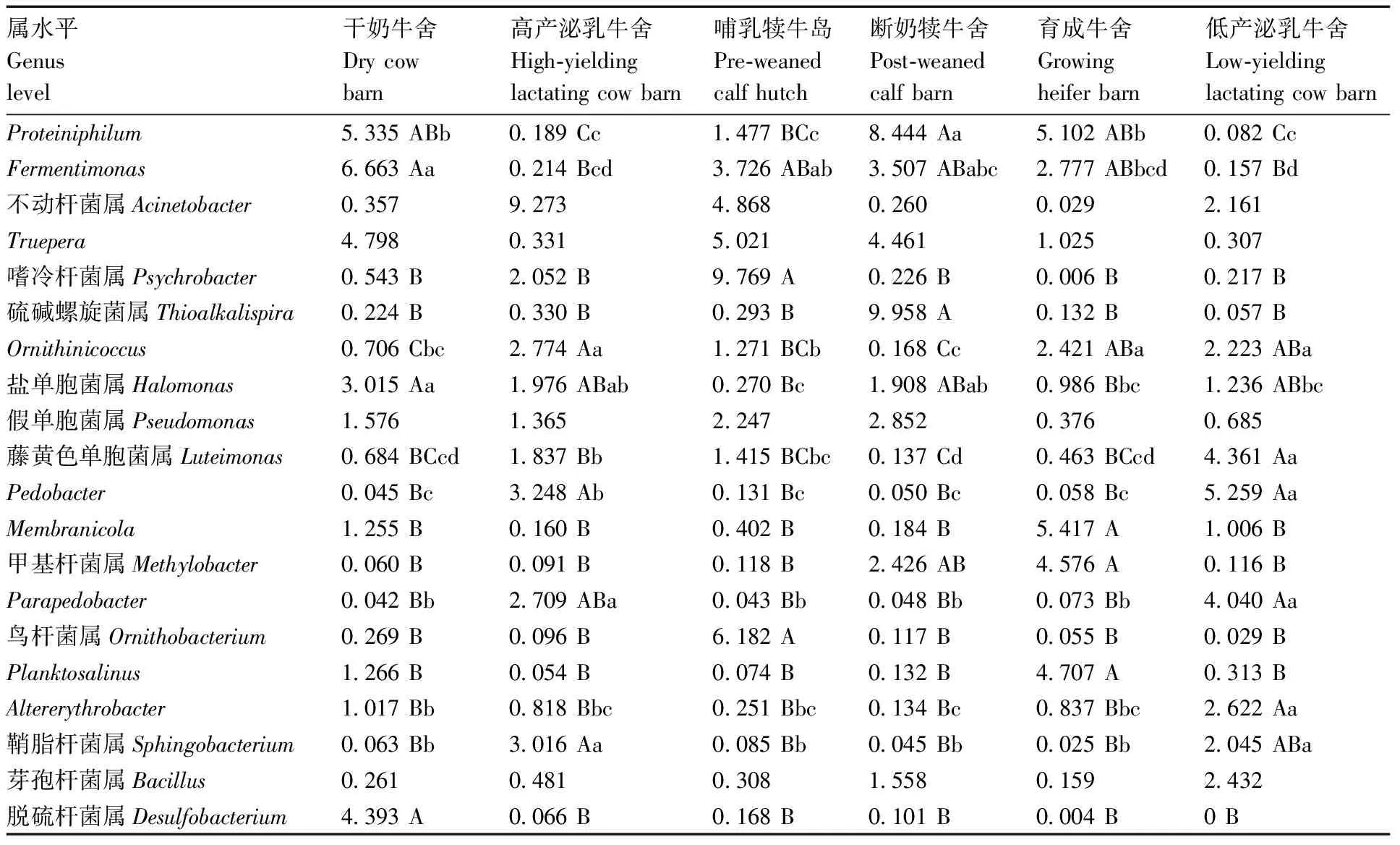
表3 牛舍土壤细菌属水平丰度
高产泌乳牛舍土壤的优势菌属为不动杆菌属、、鞘脂杆菌属,共占15.54%。低产泌乳牛舍土壤的优势菌属为、藤黄色单胞菌属、,共占13.66%,其中藤黄色单胞菌属的丰度极显著高于其他牛舍土壤(<0.01)。泌乳牛舍土壤中,鞘脂杆菌属、的丰度显著高于其他牛舍土壤(<0.05),极显著高于其他牛舍土壤(<0.01)。
3 讨论
本试验中,各牛舍土壤细菌菌群的Alpha多样性指数虽然无显著差异,但是Beta多样性结果表明各牛舍土壤细菌菌群结构存在明显差异,与Liu等的结果一致,证明假设成立,牛舍土壤的细菌会受到奶牛群体的影响,呈现不同的群落结构。主坐标分析(PCoA)结果表明,高产泌乳牛舍土壤与低产泌乳牛舍土壤细菌菌群结构更加接近。
各牛舍土壤的优势菌门基本为变形菌门、拟杆菌门、放线菌门、厚壁菌门,与猪粪堆肥、奶牛堆积粪便以及奶牛场土壤的优势菌门相似,但与奶牛新鲜粪便、新鲜鸡粪存在一定差异。生产中常常将牛粪堆肥作为泌乳牛卧床的垫料以改善泌乳牛舒适度,而完成腐熟的牛粪堆肥中放线菌门的丰度较高。Sun等的研究结果同样表明未进行充气处理的卧床垫料中放线菌门的丰度高达30.3%。本试验结果中,泌乳牛舍土壤中放线菌门的丰度显著高于其他牛舍土壤,原因可能是泌乳牛卧床垫料中的菌群影响了泌乳牛舍土壤的细菌结构。
各牛舍土壤的优势菌属差异较大,但也存在一些规律。、、以及嗜冷杆菌属等可以对碳水化合物、蛋白质进行降解,主要分布在干奶牛舍土壤(、、)、哺乳犊牛岛土壤(、、嗜冷杆菌属)以及断奶犊牛舍土壤(、、)与育成牛舍土壤(),其中具有一定的嗜盐碱性。嗜盐碱的菌属有脱硫杆菌属、盐单胞菌属、硫碱螺旋菌属,主要分布在干奶牛舍土壤(脱硫杆菌属、盐单胞菌属)以及断奶犊牛舍土壤(硫碱螺旋菌属),其中脱硫杆菌属可以利用氢对硫酸盐进行还原,硫碱螺旋菌属可以将硫化物氧化。不动杆菌属与鞘脂杆菌属可引起人类呼吸道疾病并且存在较强的耐药性,主要分布在高产泌乳牛舍土壤,其中鞘脂杆菌属还可以降解多环芳烃类有机物以及缓解土壤的重金属污染。在育成牛舍土壤的优势菌属中,与的丰度显著高于其他牛舍土壤,二者均为革兰氏阴性好氧菌、严格异养、氧化酶阴性、过氧化氢酶阳性,其中还可以对部分脂类与蛋白质进行降解。
4 小结
各牛舍土壤菌群Alpha多样性无差异,菌群结构差异明显。各牛舍土壤的优势菌门差异不明显,基本为变形菌门、拟杆菌门、放线菌门与厚壁菌门。各牛舍土壤的优势菌属差异明显,、、等蛋白质降解菌在非泌乳阶段牛舍土壤中的丰度较高;脱硫杆菌属、盐单胞菌属、硫碱螺旋菌属等嗜盐碱的菌属在干奶牛舍土壤与断奶犊牛舍土壤中的丰度较高;不动杆菌属与鞘脂杆菌属等致病菌在高产泌乳牛舍土壤中的丰度较高。

