肠道菌群与肠屏障互作影响动脉粥样硬化形成的研究进展
徐雁云陈民利
(1.浙江中医药大学 药学院,杭州 310053;2.浙江中医药大学 动物实验研究中心/比较医学研究所,杭州 310053)
心血管疾病(cardiovascular disease,CVD)是严重危害人类健康的重大疾病。 动脉粥样硬化(atherosclerosis,AS)是众多CVD 的病理基础,也是以炎症反应和脂质沉积为基础的代谢性疾病,与高血压、高血脂、高血糖、高尿酸等危险因素密切相关。 然而,目前AS 发生发展机制仍未被阐明,面对严峻的形势,深入研究AS 的发病机制和影响因素对发现新型有效的防治方案有着重要意义。
大量研究发现,肠道菌群结构和肠道通透性与AS 及其危险因素密切相关[1]。 肠道中有益菌数量下降和有害菌数量上升,可导致肠道屏障损伤以及菌群相关产物脂多糖(lipopolysaccharide,LPS)、短链脂肪酸(short chain fatty acid,SCFAs)、胆汁酸(bile acids,BAs)、氧化三甲胺(trimethylamine oxide,TMAO)等物质发生变化,继而促使更多有害物质进入循环系统,引起炎症反应、氧化应激,影响AS 进展[2]。 本文将从肠道菌群与肠道屏障互作对AS 及其危险因素发生发展的影响加以阐述,为研究和防治AS 提供参考。
1 肠道菌群与肠道屏障
1.1 肠道屏障
肠道屏障由肠道皮下向肠腔内可依次细分为免疫屏障、机械屏障、化学屏障和生物屏障。 免疫屏障主要由肠道相关淋巴细胞组织及其分泌的抗体组成,能抵御病原微生物入侵。 由肠道上皮细胞和紧密连接(tight junction,TJ)等结构形成的机械屏障,能将机体与外界环境分隔,有效的阻挡大分子及有害物质进入。 TJ 的完整性是肠道通透性保持健康状态的关键所在。 化学屏障主要由肠道黏膜绒毛下侧的隐窝组织分泌的黏液、酶以及消化液构成,能消灭外来病原微生物[3]。 生物屏障即肠道菌群,肠道菌群一直处于动态变化的状态,在免疫和营养吸收等方面发挥无可取代的作用[3]。
1.2 肠道菌群
肠道菌群作为肠道屏障的特殊部分,组成复杂且数量庞大,包含1000 多种细菌,多达100 万亿个细胞。 肠道中99%微生物是厌氧菌,随着人类一起进化至今。 肠道内存在共生菌和条件性致病菌,共生菌与宿主保持着共生关系,两者互惠互利,并且抑制条件性致病菌繁殖。 肠道菌群的组成主要包括厚壁菌门、拟杆菌门、放线菌门、梭杆菌门、变形菌门、疣微菌门、蓝藻菌门,其中厚壁菌门和拟杆菌门占92%以上[4]。
1.3 肠道菌群与肠道屏障的互作
正常情况下,生物屏障中有益菌和有害菌保持稳态,并以争夺营养的方式对外来病原体起到拮抗作用,阻止致病菌定植[5]。 肠道菌群是肠道屏障最初的关卡,坚守生物屏障这道关卡有利于维持肠道其他屏障结构功能完整性,防止致病菌及其有害物质入侵。
1.3.1 肠道菌群影响机械屏障
在细菌与细菌之间、菌群与肠道上皮细胞之间存在粘附现象,形成占位性保护对机械屏障有协助和加强作用[6]。 肠道菌群组成的改变直接影响菌群相关产物的变化,并且通过各个途径影响屏障结构。 例如,当革兰阴性杆菌丰度增加,细菌膜表面的主要毒力因子LPS 随之增加。 LPS 能降低空肠跨上皮电阻,使机械屏障TJ 相关蛋白claudin-1、occludin 和闭锁连接蛋1(zona occludens 1,ZO-1)的表达降低,导致肠道通透性增加(表1,图1)[7]。 同时,LPS 具有交感神经兴奋作用,引起肠黏膜血管收缩供血、供氧缺乏,并且使肠上皮细胞代谢紊乱,进一步导致肠道机械屏障功能受损。 随着肠道通透性增加,肠道内的LPS 更易进入机体,而后会被Toll样受体(Toll-like receptors,TLR)识别激活核转录因子-κB(nuclear transcription factor-κB,NF-κB)引起免疫反应,增加单核巨噬细胞表达,促进凝血因子、炎症因子、氧自由基释放,并下调TJ 蛋白使肠道通透性增加的情况进一步恶化,最终导致更多LPS 入侵机体,形成恶性循环(图1)[3,8]。 同样的,部分菌群产生的三甲胺(trimethylamine, TMA)在肝被黄素单氧酶3(flavin monooxygenase,FMO3)氧化为氧化三甲胺(trimethylamine oxide,TMAO),TMAO 也会引起机体炎症反应,降低TJ 蛋白表达量(图1)[9]。 与之相反,双歧杆菌等益生菌能将难以消化的膳食纤维和抗性淀粉分解成SCFAs,如乙酸、丙酸和丁酸,是肠道微生物区系以及肠道上皮细胞的重要碳能源,也是肠黏膜屏障的保护剂,能通过腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)来调节TJ 的组装,增强肠道屏障(表2,图1)[10-11]。
1.3.2 肠道菌群影响化学屏障
肠道上皮存在多种分泌细胞,肠腔中的粘液主要由杯状细胞分泌,潘氏细胞位于肠隐窝底部分泌抗菌肽、溶菌酶和磷脂酶等,可以阻止致病菌附着在上皮细胞边界并具有杀菌作用。 粘蛋白2(Mucin 2,MUC2)是粘液层的主要组成部分,有部分共生菌喜好定植在外层粘液层,这可能与其能利用MUC2为自身生长功能有关,而内层粘液层与上皮细胞贴合且较为致密起到抵抗致病菌等作用[12-13]。 例如嗜黏蛋白阿克曼氏菌(Akkermansiamuciniphila,Akk)具有很强的分解黏蛋白的能力能在黏蛋白上生长,并且能产生乙酸盐和丙酸盐。Akk本身能增加杯状细胞以及抗菌肽的数量,同时产生的SCFAs 能够刺激MUC2 基因的表达和肠道粘蛋白的释放(表2,图1)[14]。 在小鼠模型中发现,结肠粘液的粘度由近端向远端增加,而这恰恰限制了细菌的运动,赋予细菌种群的空间结构分布[15]。 另外,BAs 作为化学屏障主要成分之一,能破坏有害细菌细胞膜起到抑菌作用[16]。
1.3.3 肠道菌群影响免疫屏障
在免疫屏障中,微皱褶细胞也可称为M 细胞,能摄取并转运肠腔内LPS 等抗原,从而激活派尔集合淋巴结中的树突状细胞(dendritic cell,DC),后者能有效帮助幼稚CD4+T 细胞分化为调节性T 细胞(T regulatory cell, Treg), 分泌白介素- 10(interleukin-10,IL-10)等进一步诱导产生免疫球蛋白A(immunoglobulin A,IgA)结合病原体特异性受体使其凝集困于黏液中,并中和毒素和病原体,阻止它们直接接触上皮细胞[17]。 SCFAs 通过刺激巨噬细胞和DC 来促进IL-10 的分泌。 另外,肠道共生菌与病原体的种群密度或与其相关的内源性分子共同决定肠道中IgA 的分泌。 例如,梭状芽胞杆菌和脆弱拟杆菌的内源性多糖A 和SCFAs 促进杯状细胞分泌的粘蛋白,均可激活Treg 细胞介导的抗炎反应,以加强免疫屏障功能[18]。 肠杆菌科和相关肠道致病菌株的丰度增加相当于病原体的爆发,破坏免疫系统耐受性并激活促炎反应[19]。 近期研究发现乳杆菌株具有抗菌活性,并通过增加小鼠体内的分泌型IgA 来增强黏膜免疫力[20]。
2 肠道菌群与肠道屏障互作对AS 的影响
肠道保持稳态与肠黏膜屏障、内环境及其代谢产物等因素有关,在肠道稳态被破坏的情况下菌群结构相继发生变化,肠道菌群及其代谢产物能影响各个层次肠道屏障。 此时肠腔内的益生菌减少,致病菌大量增殖,遵循肠道渗漏概念,肠道屏障功能受损导致细菌产物易位进入宿主循环,这可能导致促炎状态,进一步增加肠道通透性,造成恶性循环[21]。 相反,有益菌能抑制致病菌繁殖,可通过提高TJ 蛋白含量、促使上皮细胞增殖分化、促进粘液和抗炎因子产生来维持肠道菌群稳态、肠道屏障完整、炎症水平稳定,有利于降低AS 及其危险因素等疾病的危险性[2]。
2.1 影响AS 危险因素
AS 逐渐被认为是一种慢性炎症性疾病,在AS疾病的发生发展中炎症免疫反应参与全过程,促进疾病进程、血栓形成以及斑块不稳定性。 另外,氧化应激和脂质代谢受各种危险因素影响,影响AS斑块发生直至破裂,与血管内皮损伤、粘附分子表达等机制有关,促使单核细胞粘附血管内皮,发展为巨噬细胞并吞噬脂质转为泡沫细胞参与AS 斑块形成[22]。 高血脂、肥胖、高血压、高血糖、胰岛素抵抗、高尿酸等慢性代谢类疾病是近些年困扰人们健康的重要危险因素,也是增加心血管突发事件的元凶,并与AS 联系密切,均存在慢性低度炎症、氧化应激等现象。 随着对各疾病的深入研究,不断有文献报道肠道菌群在AS 危险因素疾病中扮演着关键角色(表1)。
2.1.1 影响高脂血症
高脂血症是脂质代谢紊乱所引起的疾病,不仅是AS 的病理基础之一,也是众多CVD 高危因素。高脂血症的肠道菌群改变表现为链球菌、产气肠杆菌、瘤胃球菌、脱硫弧菌增加,双歧杆菌属、普拉梭菌、Akk等产SCFAs 菌减少、LPS 增加[23]。 在高脂饮食物条件下,肠道中LPS 能伪装成磷脂参与组装乳糜微粒脂蛋白进入机体,并且参与毛细血管内皮的脂蛋白胞吞作用,进入各个组织(表1)[24]。
SCFAs 能保护肠道屏障,并通过G 蛋白偶联受体43 (G protein-coupled receptor 43, GPR43) 和GPR41 促进糖脂代谢。 相应受体能刺激胰高血糖样素肽-1(glucagon peptide-1,GLP-1)和胃肠肽类激素酪酪肽(peptide YY,PYY)分泌,进而增加瘦素释放,瘦素和各类肽能增加饱腹感、控制饮食,从而减少高脂血症的发生(表1,图1)[25]。 因此,肠道菌群紊乱导致SCFAs 产生减少、LPS 增加,不利于脂肪分解以及肠道屏障完整性的维持。
正常情况下,双歧杆菌、乳杆菌可使初级BAs转化为石胆酸和脱氧胆酸等次级BAs,若肠道菌群失调则导致BAs 代谢改变,影响胆汁酸的解偶联、转化和脱硫作用进一步破坏肠道稳态和通透性,还会使次级BAs 合成减少导致其受体法尼醇X 受体(farnesoid X receptor,FXR)活化被抑制,对肠上皮炎症、脂质稳态产生负面影响[26]。 肠道菌群不仅参与了次级BAs 代谢,而且可抑制肝BAs 合成[27]。另外,BAs 在脂代谢方面发挥着至关重要的作用,有利于胆固醇代谢,FXR 可以抑制脂肪生成、增加脂解作用(表1,图1)[28]。
2.1.2 影响高血糖
高血糖症往往伴随高脂血症一起出现,同样对AS 产生影响,且长期的高血糖症还会发展为糖尿病,另外随着年龄增长AS 患者的高血糖生物标志物也呈上升趋势[29]。 LPS 是胰岛素抵抗的触发因素之一,还能增加促炎因子、损害胰腺β 细胞功能,提高患糖尿病风险(表1)[30]。 另外,TMAO 能通过磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路加剧高血糖病症和胰岛素抵抗(表1)[9,31]。
双歧杆菌等益生菌可增加糖原合成并降低肝糖异生相关基因的表达,其产物SCFAs 能保护β 细胞,刺激胰岛素分泌促进血糖稳态[32-33]。Akk被认为是一种很有前途的益生菌,是治疗肥胖和糖尿病的候选物。Akk不仅可以改善葡萄糖耐量和胰岛素敏感性,还强效抑制相关酶活性,有效的阻止碳水化合物的分解,有利于降低餐后的血糖水平[33-34]。BAs 已被证实是葡萄糖代谢的重要调节物,有助于建立糖尿病的血糖控制,下游受体FXR 能提高葡萄糖耐量和胰岛素敏感性,并刺激胰腺β 细胞产生胰岛素(表1,图1)[35]。
2.1.3 影响高血压
高血脂和高血糖是高血压的诱发因素,三种疾病互存的情况十分常见,能共同促进AS。 菌群改变使LPS 升高,引发心率增加、去甲肾上腺素水平增加、压力反射敏感性降低等现象,还具有促炎、交感神经激活、促进神经炎症作用,以上反应均与高血压发病机制有关(表1)[36]。
SCFAs 能激活GPR 和嗅觉相应受体增加肾素释放促进血压升高,然而由于SCFAs 具有舒张血管作用,因此血压在各因素共同作用下保持相对稳定(表1)[37]。 丁酸经相应受体作用与迷走神经能发挥一定的降压效果[36]。 最新研究证实TMAO 能通过激活蛋白激酶R 样内质网激酶以及下游活性氧(ROS)等相关通路来实现收缩小动脉,并使血压对Ang II 反应敏感并降低肾小球滤过率,从而增强Ang II 诱导的血管收缩,且TMAO 能延长Ang II 对高血压的作用(表1)[38-39]。
2.1.4 影响高尿酸
高尿酸与前三者一样均是AS 的独立危险因素且相互关联,能加速AS 进程。 在AS 斑块中存在较高的尿酸,推断尿酸对AS 存在直接作用。 机体尿酸过高可形成尿酸盐结晶直接损伤血管内皮,引起炎症和氧化应激,刺激平滑肌细胞增殖、血小板聚集,促进AS[40]。 高尿酸患者的肠道菌群中双歧杆菌、乳酸杆菌等细菌分泌的活性蛋白酶、转运酶以及SCFA 减少,嘌呤分解代谢和转运降低,利于尿酸形成(表1)[41]。
高尿酸极易导致痛风、肾病的机制与LPS 有关。 LPS 诱导的TLR 相关炎症反应不仅增加肠道通透性,肾通透性也增加,为肠源性LPS 损害肾提供可能[42]。 近期研究发现,可溶性尿酸可以增加ROS 的释放,使线粒体膜电位去极化,激活NLRP3炎症小体和NF-κB 信号,进一步导致TJ 蛋白对肠屏障功能产生不良影响[43]。 此外,部分革兰阴性变形菌在高尿酸血症中丰度较高[44]。 进一步的研究发现, LPS 和尿酸生成关键酶黄嘌呤氧化酶(xanthine oxidase,XOD) 以及尿酸呈正相关(表1)[45]。 然而,高尿酸和肠道菌群的相互作用机制还需要进一步探讨。
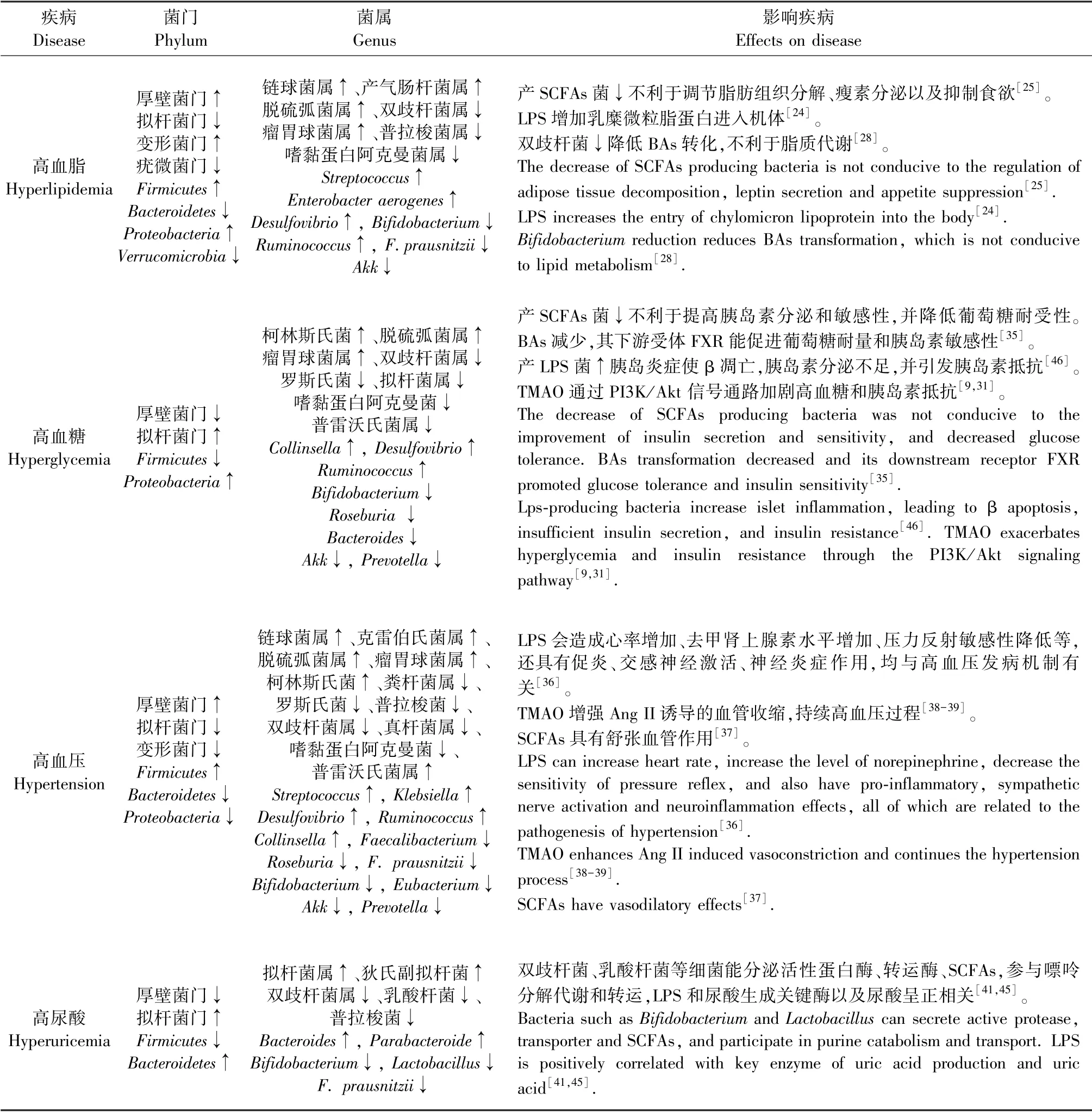
表1 肠道菌群对AS 危险因素的影响Table 1 Effects of intestinal flora on risk factors of AS
2.2 影响AS 的发生发展
目前,在AS 斑块中的研究发现来自口腔和肠道的五十多种细菌,如链球菌、假单胞菌肺炎支原体、幽门螺旋杆菌和、牙周病原菌,可见细菌可以通过某些途径进入定植于AS 斑块并影响其稳定性[47]。 实验动物和人群的肠道菌群16sRNA、宏基因组等测序结果显示,AS 患者以及高血脂、高血压、高血糖、高尿酸疾病患者的肠道菌群组成与正常状态相比存在明显差异,厚壁菌门和拟杆菌门的比值(F/B)显著增加且菌群多样性降低[48]。 AS 患者肠道菌群在门水平主要表现为厚壁菌门丰度增加以及拟杆菌门丰度减少,F/B 比值增加[36](表2)。
肠道菌群在AS 及其危险因素疾病中,各菌门菌属的变化趋势相似程度较大。 表现为双歧杆菌属、罗斯氏菌、普拉梭菌以及Akk等益生菌丰度的降低,而克雷伯氏菌、埃希氏菌、产气肠杆菌、脱硫弧菌等条件致病菌丰度升高,另外,瘤胃球菌作为肠道优势菌群在AS 及其危险因素疾病中也表现为明显升高趋势(表2)[49-50]。 这说明了肠道菌群的改变确与疾病的发生发展密切相关,也进一步说明了AS与危险因素在肠道菌群方面存在一定联系。 例如,AS 以及其危险因素类疾病研究中均有报道LPS 水平在循环系统中升高,且LPS 与TMAO 一样对机体最严重的影响是激活NF-κB 等炎症反应、氧化应激,进一步导致肠道通透性增加的恶性循环(表2)[51-52]。
TMAO 不仅参与炎症反应、氧化应激、糖代谢,还参与胆固醇和胆汁酸代谢、泡沫细胞形成以及血小板活化。 最近Cai 等[53]通过宏基因组等手段发现,在AS 患者肠道中有两种细菌显著高于健康人群,它们含有最丰富的CutC 同源序列,CutC 是TMA裂解酶基因负责与胆碱相关的TMA 转化,后续小鼠实验发现血清TMAO 水平显著升高会导致斑块明显堆积。 原因是TMAO 能下调胆汁酸合成酶胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)的表达,造成胆固醇转运障碍、细胞内脂质堆积(图1)[54]。 且巨噬细胞胆固醇反向转运的关键途径可以被TMAO 抑制,事实上,FMO3 作为TMAO 合成酶在胆固醇代谢和反向胆固醇转运的调节方面发挥着强大作用[55]。 另外,TMAO 还能导致血小板过度活化来增加血栓形成[56]。 由此可见,TMAO 不仅影响AS 的斑块形成还影响斑块稳定性。
同样在脂代谢方面发挥作用的还有BAs,除在糖脂代谢等方面发挥有益作用外,BAs 还通过FXR等受体抑制NF-κB 的促炎反应,并且FXR 能在转录水平诱导一氧化氮合酶表达,增加血管扩张剂一氧化氮的产生达到扩充血管的作用[57-58]。 另外,FXR能诱导MUC2 表达,且NF-κB 也参与其中[59]。SCFAs 不仅能抑制NF-κB 活化,还能通过激活GPR43 等受体从而诱导Treg 细胞,并由Treg 和DC产生IL-10 等抗炎细胞因子[60]。 而且高浓度SCFAs可以降低结肠肠腔中的pH 值,抑制潜在病原体生长,并促进有益细菌例如乳酸杆菌和双歧杆菌的生长,从而影响微生物群落,降低心血管疾病的风险[23]。 无论在AS 或者其危险因素中,炎症、氧化应激对疾病的影响都处于重要地位,SCFAs 的有益作用表现为有助于维稳肠道菌群、修复肠道通透性、改善炎症以及氧化应激。 Yuan 等[61]研究了SCFAs对NLRP3 炎症小体的形成和激活的影响,结果显示丁酸盐能阻断含半胱氨酸的天冬氨酸蛋白水解酶-1(caspase-1)的活化,caspase-1 活化被抑制可减少IL-1β 等炎症因子,对血管损伤有保护作用(表2)。
3 结语
综上所述,AS 以及高血脂、高血糖、高血压、高尿酸等相关疾病存在菌群紊乱的现象,例如革兰阴性细菌和产TMAO 菌增加,而产SCFAs、BAs 的益生菌减少,相应的菌群相关产物LPS、TMAO 增加,SCFAs、BAs 减少,导致菌群占位性保护减弱、TJ 蛋白降低、粘液层减少以及炎症等反应,使肠道屏障受损、肠道通透性增加,大量有害物质进入机体,并进一步促使肠道菌群紊乱。 有害物质进入机体后影响炎症反应、氧化应激、脂质代谢、血糖代谢、血栓形成等机制,促进高血脂、高血糖、高血压、高尿酸以及AS 的发生发展。 由此可见,肠道菌群相关产物作为桥梁在各个机制中影响疾病发生发展,AS与其危险因素互为因果、相互促进(图1)。 因此,通过改善肠道状态来治疗AS 以及相关疾病或可成为新型治疗手段。
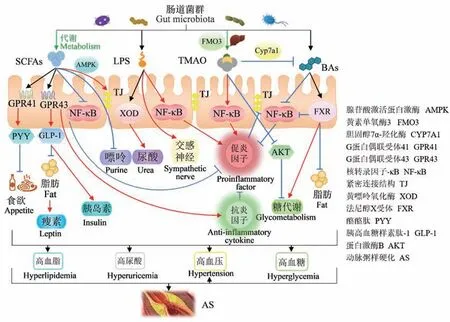
图1 肠道菌群与AS 以及危险因素的关系Note. The red arrow indicates the promoting effect; green arrow indicates metabolic production; blue indicates inhibition. SCFAs, a metabolite of intestinal flora, can inhibit appetite and fat formation and promote leptin and insulin secretion by activating GPR41 and GPR43, respectively;GPR41 and GPR43 can also promote the secretion of anti-inflammatory factors; In addition, SCFAs can inhibit purine formation and protect TJ structure; and SCFAs can also reduce proinflammatory factor secretion by inhibiting NF-κB. LPS can promote uric acid formation through XOD,activate sympathetic nerve and NK-κB to promote the secretion of proinflammatory factors, while inflammatory reaction will destroy TJ structure.TMAO produced by liver metabolism triggers inflammatory reaction in the same way, and hinders sugar metabolism by inhibiting AKT pathway;TMAO also inhibits BAs formation through CYP7A1. BAs can inhibit the secretion of proinflammatory factors, fat formation and promote glucose metabolism through FXR and other ways.Figure 1 Relationship between intestinal flora and AS and risk factors
目前已知益生菌对机体有利,但其具体作用机制有待进一步探究,例如Akk可通过促进SCFAs 增加来调节人体的能量代谢、葡萄糖耐量、免疫系统等功能,但涉及的分子机制尚未确定。 最近Yoon等[66]研究发现,Akk能分泌一种84 × 103大小,名为P9 的蛋白,P9 能诱导GLP-1 分泌、褐色脂肪组织产热,可改善小鼠的葡萄糖稳态和代谢疾病,作者还发现P9 与细胞间粘附分子2 存在相互作用,这在未来可能成为代谢疾病治疗的新靶点。
事实上,肠道菌群相关代谢产物的产生机制尚不明确,如细菌是如何利用膳食纤维产生SCFAs的。 最新研究证实肠道菌群能产生新的微生物结合型BAs,这种有微生物介导形成的结合BAs 其确切机制并不明了,但可能对回肠受体或BAs 转运蛋白的结合机制产生空间位阻[16]。 这类微生物结合型BAs 还是强效的人类FXR 激动剂,并且当给予小鼠时,负责肝中胆汁酸产生的FXR 靶基因的表达降低[67]。 当然,对于这种新发现BAs 仍需要更多的研究来探索其对人类健康以及FXR 相关疾病的潜在影响。
肠道菌群与肠道屏障互作可能还与多种疾病密切相关,多项研究表明肠菌群在心血管疾病、代谢性疾病、神经退行性疾病、肠道疾病等多种疾病中有重要作用[2,68-71]。 随着更加深入的研究,通过调节肠道菌群稳态来改善肠道屏障以及肠道通透性来治疗相关疾病的策略越来越有吸引力。
参考文献(References)
[ 1] Jonsson AL, Bäckhed F. Role of gut microbiota in atherosclerosis[J]. Nat Rev Cardiol, 2017, 14(2): 79-87.
[ 2] Witkowski M, Weeks TL, Hazen SL. Gut microbiota and cardiovascular disease [J]. Circ Res, 2020, 127(4): 553-570.
[ 3] 尉浩斌, 张小丹, 李苏宜. 肠屏障功能损伤机制及其临床检测方法研究现状 [J]. 肿瘤代谢与营养电子杂志, 2020, 7(4): 407-414.Yu HB, Zhang XD, Li SY. Research status of the mechanism of intestinal barrier function injury and its clinical detection methods[J]. Electron J Metab Nutr Cancer, 2020, 7(4): 407-414.
[ 4] Liu BN, Liu XT, Liang ZH, et al. Gut microbiota in obesity[J]. World J Gastroenterol, 2021, 27(25): 3837-3850.
[ 5] Coyne MJ, Comstock LE. Type VI secretion systems and the gut microbiota [J]. Microbiol Spectr, 2019, 7(2): 10.
[ 6] Chelakkot C, Ghim J, Ryu SH. Mechanisms regulating intestinal barrier integrity and its pathological implications [J]. Exp Mol Med, 2018, 50(8): 1-9.
[ 7] Cao S, Zhang Q, Wang C, et al. LPS challenge increased intestinal permeability, disrupted mitochondrial function and triggered mitophagy of piglets [J]. Innate Immun, 2018, 24(4): 221-230.
[ 8] 李嘉慧, 王欣佩, 冷静. TLR4/NF-κB 参与动脉粥样硬化发生发展机制的研究进展 [J]. 中国比较医学杂志, 2021, 31(4): 137-142.Li JH, Wang XP, Leng J. The mechanism of TLR4/NF-κB in atherosclerosis [J]. Chin J Comp Med, 2021, 31(4): 137-142.
[ 9] Zeisel SH,WarrierM.Trimethylamine N-Oxide,the microbiome, and heart and kidney disease [J]. Annu Rev Nutr,2017, 37: 157-181.
[10] Parada Venegas D, De la Fuente MK, Landskron G, et al.Corrigendum: short chain fatty acids (SCFAs)-mediated gut epithelial and immune regulation andits relevance for inflammatory bowel diseases [ J]. Front Immunol, 2019,10: 1486.
[11] Peng L, Li ZR, Green RS, et al. Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in Caco-2 cell monolayers [J]. J Nutr, 2009, 139(9): 1619-1625.
[12] Chen Z, Luo J, Li J, et al. Foxo1 controls gut homeostasis and commensalism by regulating mucus secretion [J]. J Exp Med,2021, 218(9): e20210324 .
[13] Yao D, Dai W, Dong M, et al. MUC2and related bacterial factors: Therapeutictargetsforulcerativecolitis[ J ].EBioMedicine, 2021, 74: 103751.
[14] Fernández-Tomé S, Ortega Moreno L, Chaparro M, et al. Gut microbiota and dietary factors as modulators of the mucus layer in inflammatory bowel disease [J]. Int J Mol Sci, 2021, 22(19):10224.
[15] Fang J, Wang H, Zhou Y, et al. Slimy partners: the mucus barrier and gut microbiome in ulcerative colitis [J]. Exp Mol Med, 2021, 53(5): 772-787.
[16] Guzior DV, Quinn RA. Review: microbial transformations of human bile acids [J]. Microbiome, 2021, 9(1): 140.
[17] Shi N, Li N, Duan X, et al. Interaction between the gut microbiome and mucosal immune system [J]. Military Med Res,2017, 4(1): 14.
[18] Wang L, Zhu L, Qin S. Gut microbiota modulation on intestinal mucosal adaptive immunity [ J]. J Immunol Res, 2019,2019: 4735040.
[19] Wu W, Sun M, Chen F, et al. Microbiota metabolite short-chain fatty acid acetate promotes intestinal IgA response to microbiota which is mediated by GPR43 [J]. Mucosal Immunol, 2017, 10(4): 946-56.
[20] Ghoneum M, Abdulmalek S. KDP, aLactobacilliproduct from kimchi, enhances mucosal immunity by increasing secretory IgA in mice and exhibits antimicrobial activity [J]. Nutrients, 2021,13(11): 3936.
[21] Kinashi Y, Hase K. Partners in leaky gut syndrome: intestinal dysbiosis and autoimmunity [ J]. Front Immunol, 2021,12: 673708.
[22] Libby P. The changing landscape of atherosclerosis [J]. Nature,2021, 592(7855): 524-533.
[23] Vourakis M, Mayer G, Rousseau G. The Role of gut microbiota on cholesterol metabolism in atherosclerosis [J]. Int J Mol Sci,2021, 22(15): 8074.
[24] Hersoug LG, Møller P, Loft S. Role of microbiota-derived lipopolysaccharide in adipose tissue inflammation, adipocyte size and pyroptosis during obesity [J]. Nutr Res Rev, 2018, 31(2): 153-163.
[25] Zhi C, Huang J, Wang J, et al. Connection between gut microbiome and the development of obesity [J]. Eur J Clin Microbiol Infect Dis, 2019, 38(11): 1987-1998.
[26] Pushpass RG, Alzoufairi S, Jackson KG, et al. Circulating bile acids as a link between the gut microbiota and cardiovascular health: impact of prebiotics, probiotics and polyphenol-rich foods[J]. Nutr Res Rev, 2021, 30: 1-20.
[27] Wahlström A, Kovatcheva-Datchary P, Stahlman M, et al.Induction of farnesoid X receptor signaling in germ-free mice colonized with a human microbiota [J]. J Lipid Res, 2017, 58(2): 412-419.
[28] Shen C, Pan Z, Wu S, et al. Emodin palliates high-fat dietinduced nonalcoholic fatty liver disease in mice via activating the farnesoid X receptor pathway [J]. J Ethnopharmacol, 2021,279: 114340.
[29] Warren B, Rawlings AM, Lee AK, et al. Increases in biomarkers of hyperglycemia with age in the atherosclerosis risk in communities (ARIC) study [J]. Diabetes Care, 2017, 40(8):e96-e97.
[30] Han H, Li Y, Fang J, et al. Gut microbiota and type 1 diabetes[J]. Int J Mol Sci, 2018, 19(4): 995.
[31] Jie Z, Xia H, Zhong SL, et al. The gut microbiome in atherosclerotic cardiovascular disease [J]. Nat Commun, 2017,8(1): 845.
[32] McNabney SM, Henagan TM. Short chain fatty acids in the colon and peripheral tissues: a focus on butyrate, colon cancer, obesity and insulin resistance [J]. Nutrients, 2017, 9(12): 1348.
[33] Gurung M, Li Z, You H, et al. Role of gut microbiota in type 2 diabetespathophysiology[ J ].EBioMedicine,2020,51: 102590.
[34] Zhang T, Li Q, Cheng L, et al.Akkermansiamuciniphilais a promising probiotic [J]. Microb Biotechnol, 2019, 12(6):1109-1125.
[35] Ding L, Yang Q, Zhang E, et al. Notoginsenoside Ft1 acts as a TGR5 agonist but FXR antagonist to alleviate high fat dietinduced obesity and insulin resistance in mice [J]. Acta Pharm Sin B, 2021, 11(6): 1541-1554.
[36] Verhaar BJH, Prodan A, Nieuwdorp M, et al. Gut microbiota in hypertension and atherosclerosis: a review [J]. Nutrients,2020, 12(10): 2982.
[37] Kimura I, Inoue D, Maeda T, et al. Short-chain fatty acids and ketones directly regulate sympathetic nervous system via G protein-coupled receptor 41 (GPR41) [J]. Proc Natl Acad Sci U S A, 2011, 108(19): 8030-8035.
[38] Jiang S, Shui Y, Cui Y, et al. Gut microbiota dependent trimethylamineN-oxideaggravatesangiotensinII-induced hypertension [J]. Redox Biol, 2021, 46: 102115.
[39] Ufnal M, Jazwiec R, Dadlez M, et al. Trimethylamine-N-oxide:a carnitine-derived metabolite that prolongs the hypertensive effect of angiotensin II in rats [J]. Can J Cardiol, 2014, 30(12):1700-1705.
[40] Zhao J, Chen H, Liu N, et al. Role of hyperhomocysteinemia and hyperuricemia in pathogenesis of atherosclerosis [J]. J Stroke Cerebrovasc Dis, 2017, 26(12): 2695-2699.
[41] 纪泽敏. 基于临床病例筛选高尿酸血症相关的肠道菌群[D]. 北京: 中央民族大学; 2020.Ji ZM. Screening intestinal flora associated with hyperuricemia based on clinical cases [D]. Beijing: Central University for Nationalities; 2020.
[42] Huang W, Lan X, Li X, et al. Retraction notice to “Long noncoding RNA PVT1 promote LPS-induced septic acute kidney injury by regulating TNFα and JNK/NF-κB pathways in HK-2 cells”[J]. Int Immunopharmacol, 2021, 95: 107672.
[43] Ma C, Yang X, Lv Q, et al. Soluble uric acid induces inflammation via TLR4/NLRP3 pathway in intestinal epithelial cells [J]. Iran J Basic Med Sci, 2020, 23(6): 744-750.
[44] Liu X, Lv Q, Ren H, et al. The altered gut microbiota of highpurine-induced hyperuricemia rats and its correlation with hyperuricemia [J]. Peer J, 2020, 8: e8664.
[45] Guo Z, Zhang J, Wang Z, et al. Intestinal microbiota distinguish gout patients from healthy humans [ J]. Sci Rep, 2016,6: 20602.
[46] Salazar J, Angarita L, Morillo V, et al. Microbiota and diabetes mellitus: role of lipid mediators [J]. Nutrients, 2020, 12(10):3039.
[47] Herrema H, Nieuwdorp M, Groen AK. Microbiome and cardiovascular disease [J]. Handb Exp Pharmacol, 2022, 270:311-334.
[48] Takagi T, Naito Y, Kashiwagi S, et al. Changes in the gut microbiota are associated with hypertension, hyperlipidemia, and type 2 diabetes mellitus in japanese subjects [J]. Nutrients,2020, 12(10): 2996.
[49] Kumar D, Mukherjee SS, Chakraborty R, et al. The emerging role of gut microbiota in cardiovascular diseases [J]. Indian Heart J, 2021, 73(3): 264-272.
[50] de Vos WM, Tilg H, Van Hul M, et al. Gut microbiome and health: mechanistic insights [J]. Gut, 2022, 71(5): 1020-1032.
[51] Shen X, Li L, Sun Z, et al. Gut microbiota and atherosclerosisfocusing on the plaque stability [J]. Front Cardiovasc Med,2021, 8: 668532.
[52] Gorabi AM, Kiaie N, Khosrojerdi A, et al. Implications for the role of lipopolysaccharide in the development of atherosclerosis[J]. Trends Cardiovasc Med, 2021, 9: S1050-S1738.
[53] Cai YY, Huang FQ, Lao X, et al. Integrated metagenomics identifies a crucial role fortrimethylamine-producing Lachnoclostridium in promoting atherosclerosis [ J]. NPJ Biofilms Microbiomes, 2022, 8(1): 11.
[54] Ding L, Chang M, Guo Y, et al. Trimethylamine-N-oxide(TMAO)-induced atherosclerosis is associated with bile acid metabolism [J]. Lipids Health Dis, 2018, 17(1): 286.
[55] Warrier M, Shih DM, Burrows AC, et al. The TMAO-generating enzyme flavin monooxygenase 3 is a central regulator of cholesterol balance [J]. Cell Rep, 2015, 10(3): 326-338.
[56] Duttaroy AK. Role of gut microbiota and their metabolites on atherosclerosis, hypertension and human blood platelet function:a review [J]. Nutrients, 2021, 13(1): 144.
[57] Gai Z, Visentin M, Gui T, et al. Effects of farnesoid X receptor activation on arachidonic acid metabolism, NF-κB signaling, and hepatic inflammation [J]. Mol Pharmacol, 2018, 94(2): 802-811.
[58] Li J, Wilson A, Kuruba R, et al. FXR-mediated regulation of eNOS expression in vascular endothelial cells [J]. Cardiovasc Res, 2008, 77(1): 169-177.
[59] Yu JH, Zheng JB, Qi J, et al. Bile acids promote gastric intestinal metaplasia by upregulating CDX2 and MUC2expression via the FXR/NF-κB signalling pathway [J]. Int J Oncol, 2019,54(3): 879-892.
[60] van den Munckhof ICL, Kurilshikov A, ter Horst R, et al. Role of gut microbiota in chronic low-grade inflammation as potential driver for atherosclerotic cardiovascular disease: a systematic review of human studies [J]. Obes Rev, 2018, 19(12): 1719-1734.
[61] Yuan X, Wang L, Bhat OM, et al. Differential effects of short chain fatty acids on endothelial Nlrp3 inflammasome activation and neointima formation: Antioxidant action of butyrate [J].Redox Biol, 2018, 16: 21-31.
[62] Hashizume-Takizawa T, Yamaguchi Y, Kobayashi R, et al. Oral challenge withStreptococcussanguinisinduces aortic inflammation and accelerates atherosclerosis in spontaneously hyperlipidemic mice [J]. Biochem Biophys Res Commun, 2019, 520(3): 507-513.
[63] 王淙玉. 高血压患者肠道菌群变化特点的研究 [D]. 西安:西安医学院; 2020.Wang CY. Study on the characteristics of intestinal microflora change in hypertensive patients [D]. Xi’an: Xi’an Medical University; 2020.
[64] Xie D, Zhang M, Wang B, et al. Differential analysis of hypertension-associated intestinal microbiota [J]. Int J Med Sci,2019, 16(6): 872-881.
[65] Li J, Lin S, Vanhoutte PM, et al.Akkermansiamuciniphilaprotectsagainstatherosclerosis by preventingmetabolic endotoxemia-induced inflammation in Apoe-/-mice [ J].Circulation, 2016, 133(24): 2434-2446.
[66] Yoon HS, Cho CH, Yun MS, et al.Akkermansiamuciniphilasecretes a glucagon-like peptide-1-inducing protein that improves glucose homeostasis and ameliorates metabolic disease in mice[J]. Nat Microbiol, 2021, 6(5): 563-573.
[67] Quinn RA, Melnik AV, Vrbanac A, et al. Global chemical effects of the microbiome include new bile-acid conjugations [J].Nature, 2020, 579(7797): 123-129.
[68] Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease [J]. Nat Rev Microbiol, 2021, 19(1): 55-71.
[69] Qian XH, Song XX, Liu XL, et al. Inflammatory pathways in Alzheimer’s disease mediated by gut microbiota [J]. Ageing Res Rev, 2021, 68: 101317.
[70] Sampson TR, Debelius JW, Thron T, et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson’s disease [J]. Cell, 2016, 167(6): 1469-1480.
[71] Lavelle A, Sokol H. Gut microbiota-derived metabolites as key actors in inflammatory bowel disease [J]. Nat Rev Gastroenterol Hepatol, 2020, 17(4): 223-237.

