小鼠心肌梗死模型的建立及系统性评价
丁怡铭高杰邢元铭温尔刚夏聪聪赵四海刘恩岐袁祖贻白亮*
(1. 西安交通大学医学部转化研究院心血管研究所,西安 710061;2. 西安交通大学第一附属医院心血管内科,西安 710061;3. 西安交通大学医学部基础医学院实验动物学系,西安 710061)
心肌梗死(myocardial infarction,MI)是冠状动脉血管堵塞导致心肌缺血缺氧的一种心血管疾病,可导致心律失常、心力衰竭、致死等严重后果,严重威胁人类生命健康[1-2]。 尽管近年来血管内介入等治疗显著提高了患者生存率[3-5],但其确切的发病机制尚不完全清楚,加之心梗发生发展的复杂性[6-7],临床治疗过程中仍面临诸多挑战[8]。 因此建立合适的心梗动物模型对研究MI 的发病机理及防治措施显得尤为重要[9]。 由于小鼠在建立基因工程动物及生命科学研究中的独特优势[10-11],故建立便捷可行的小鼠心梗模型及标准化的成模评价体系非常必要。 心梗动物模型的构建方法以冠脉结扎为主[12-13],传统的冠脉结扎法需要腹腔麻醉联合气管插管通气[14],创伤大,效率低。 而且,相较于兔、犬、猪等大动物[11,15],小鼠体形和心脏较小导致造模难度较大,本研究基于Gao 等[16]报道的挤心脏法,结合自身实践经验对手术方法进行了改进和优化,包括:将皮肤缝合放在手术过程最后;向右斜30°做胸部切口而非右斜45°;手术过程中不挤出左心耳等,可提高造模成功率、节约时间,成功构建小鼠心梗模型。 此外,进一步完善了小鼠心梗模型的评价体系,在不同时间点选取了不同手段对模型进行评估,包括心脏形态学、功能学、组织病理学和分子生物学4 个方面,可作为模型建立的标志性指标,为临床进一步研究心梗发生发展和转归,以及药物研发提供了动物模型保障和方法学支持。
1 材料与方法
1.1 材料
1.1.1 实验动物
42 只SPF 级C57BL/6J 小鼠,不分雌雄,8 ~11周龄,体重22 ~ 25 g,由西安交通大学实验动物中心【SCXK(陕)2018-001】提供,并在本中心饲养和实验【SYXK(陕)2020-005】。 饲养环境:昼夜各半循环照明,湿度恒定,温度控制在22 ~ 25℃。 42 只小鼠分为两组:34 只小鼠为模型组,进行LCA 永久性结扎;8 只小鼠为假手术组,只过线不结扎,其余操作步骤与模型组相同。 实验项目经西安交通大学伦理委员会批准实施(2020-812),所有实验过程遵循国家实验动物管理的相关法律和规定。
1.1.2 主要试剂与仪器
异氟烷(瑞沃德,R500);TTC(Sigma,T5648-1G);TRIzol(AG,AG21102);SYBR(AG,AG11701);引物由上海生物工程有限公司合成。 气体麻醉机(瑞沃德,R510-22,中国);心超机(飞依诺,VINNO 6,中国)。
1.2 方法
1.2.1 MI 模型的建立
术前24 h 用脱毛膏去除胸部及上腹部被毛。手术当日小鼠称重后,放入吸入式麻醉剂的诱导麻醉盒,5%异氟烷吸入诱导麻醉;待小鼠麻醉后,将小鼠仰卧位固定,用吸入面罩吸入2%异氟烷持续麻醉;75%乙醇消毒手术区。 自剑突与肋弓交界向右斜30°做胸部切口,切口长约1.2 cm;用弯头镊和弯头止血钳钝性分离胸大肌,暴露胸大肌下的胸小肌;在小鼠呼吸平稳时,以弯头止血钳轻轻捅破3/4肋间隙肌肉,逆时针旋转并微微撑开弯头止血钳,同时借助手指挤压,利用心脏跳动使心脏弹出胸腔;翻转心脏找到左心耳,在其下2 mm 处,用提前准备好的6-0 带针缝线结扎左前降支冠脉,心脏挤压出胸腔后在体外时间不超过1 min;迅速将心脏送回胸腔,轻轻挤压胸腔排气;缝合皮肤,关闭胸腔。取下面罩,放回干净笼盒,3~5 min 即可苏醒。 术后密切关注小鼠状态。 假手术组只过线,不结扎,其余操作步骤与模型组相同。
1.2.2 超声检查
术后24 h、3 d、7 d,小鼠异氟烷吸入麻醉,使用高分辨率小动物超声影像系统测量射血分数(ejection fraction, EF)、 缩 短 分 数( fractional shortening,FS)、左室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左室收缩末期容积(left ventricular end-systolic volume,LVESV)、左室舒张末期内径(left ventricular end-diastolic dimension,LVIDd)、左室收缩末期内径(left ventricular endsystolic dimension,LVIDs)、左室舒张末期后壁厚度(left ventricular end-diastolic posterior wall thickness,LVPWd)、左室收缩末期后壁厚度(left ventricular end-systolic posterior wall thickness,LVPWs),在2 ~3个心动周期上测量各指标,取平均值。
1.2.3 TTC 染色
术后24 h 麻醉小鼠,打开胸腔,用生理盐水进行心脏灌流,留取心脏,置于-80℃至心脏变硬(约30 min);无菌PBS 配置1% TTC,避光,37℃预热;取出心脏,将结扎线以下快速切成1 mm 厚的薄片,浸泡于1% TTC 染液中,37℃染色30 min;PBS 清洗2 次,对心脏切片进行扫描拍照。
1.2.4 HE 染色
术后7 d 留取心脏标本,4%甲醛固定48 h,组织脱水,石蜡包埋,石蜡切片(4 μm)。 常规脱蜡后,苏木素染色2 min,伊红染色3 min,常规干燥、封片,显微镜下观察。
1.2.5 实时定量PCR
取小鼠梗死心肌组织,提取总RNA,逆转录为cDNA。 以β-actin 为内参基因,计算术后3 d 肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、单核细胞趋化因子-1(monocyte chemotactic protein 1,MCP-1)和术后7 d 纤连蛋白(fibronectin,FN)、Ⅲ型胶原蛋白α1 链(collagen alpha-1(Ⅲ)chain,COL3A1)基因相对表达量。 PCR 引物由上海生物工程有限公司合成,引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.3 统计学分析
用 GraphPad Prism 8. 0 软件进行统计学分析,数据以平均值±标准误差(±s)表示,两组间比较用Studentt检验。P< 0. 05 为差异有统计学意义。
2 结果
2.1 成功构建小鼠心梗模型
对文献[16]建立的手术方法进行优化,按实验方法所述,将小鼠心脏挤出胸腔后进行LCA 结扎,与假手术组相比,片刻后可见结扎部位以下LCA 供血范围内心肌变白,提示结扎成功。 而假手术组心脏颜色基本正常,无白色区域(图1A),术后24 h 开胸,可见模型组心尖部梗死区发白(图1B)。

图1 小鼠心梗模型的建立及心脏大体观Note. A. In situ and ex vivo diagram of the heart in the sham group at 24 h after surgery. B. In situ and ex vivo diagram of the heart in the model group at 24 h after surgery. Arrows. Left ventricular wall.Figure 1 Establishment of mouse myocardial infarction model and general view of the heart
2.2 心动超声变化
分别在术后24 h、3 d、7 d 进行心动超声,结果可见,模型组左心室前壁、心尖部等LCA 供血范围活动幅度明显减小甚至消失,提示心肌受损;左室壁变薄,左室腔变大,心梗术后7 d 变化最为明显(图2A)。对3 个时间点的心功能指标进行分析,可见模型组EF、FS 值较假手术组显著下降(P< 0.01,图2B,2C),LVEDV、LVESV 值较假手术组显著升高(P<0.01,图2D,2E),提示模型组心功能变差,且随心梗时间延长逐渐加重,具体心超指标详见表2。

表2 心梗后心动超声指标Table 2 Echocardiographic indexes after myocardial infarction

图2 术后心动超声变化Note. A. Representative images of the cardiac M ultrasound of sham group and model group at 24 h, 3 d and 7 d after surgery. B ~ E. Compared with the sham group, **P < 0.01,***P < 0.001,****P < 0.0001.(The same in the following figures and tables)Figure 2 Postoperative echocardiographic changes
2.3 心脏TTC 染色
术后24 h,取心脏标本进行常规TTC 染色,可观察到假手术组心脏切片均呈红色(图3A),但模型组梗死区呈白色,非梗死区呈红色,从结扎位置到心尖,白色梗死区所占面积百分比逐渐增加,靠近心尖的心脏切片几乎全部变白(图3B)。
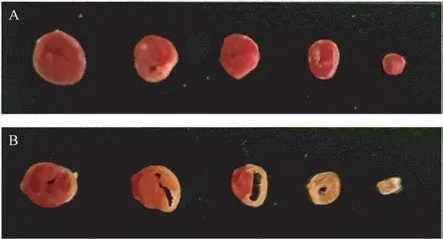
图3 心脏TTC 染色Note. A. Sham group. B. Model group after surgery for 24 h.Figure 3 Heart TTC staining
2.4 心脏HE 染色
术后7 d 心脏HE 染色可见,假手术组和模型组非梗死区心肌排列整齐、胞质丰富;模型组梗死区心肌排列紊乱,炎症细胞严重浸润,细胞萎缩甚至消失,代之以纤维瘢痕组织,左室壁明显变薄;梗死边缘区心肌细胞萎缩,从非梗死区到梗死区,可见心肌细胞从正常到萎缩直至消失的过渡现象,表现为明显的“红蓝交界”(图4)。

图4 心脏HE 染色Note. 10× and 20× representative images of cardiac infarct area, border area, and remote area of the heart HE staining at 7 days after surgery and the sham group.Figure 4 Heart HE staining
2.5 梗死区炎症和纤维化水平
小鼠心梗术后3 d,心脏梗死区TNF-α 和MCP-1 表达量较假手术组显著升高,差异具有统计学意义(P< 0.05,图5A),提示心脏梗死区炎症加重。小鼠心梗术后7 d,心脏梗死区FN 和COL3A1 表达水平较假手术组明显升高,差异具有统计学意义(P< 0.001,图5B),提示心脏梗死区纤维化程度加重。

图5 心脏组织炎症和纤维化相关基因表达水平Note. A. TNF-α 和MCP-1 mRNA expression at 3 d after surgery. B. FN 和COL3A1 mRNA expression at 7 d after surgery.Figure 5 Expression levels of genes related to inflammation and fibrosis in heart
3 讨论
本研究在以往研究的基础上,对小鼠心梗模型的构建进行了深入的探究和优化,并完善和总结了一套详细和实用的新型心梗模型评价体系,通过形态学、功能学、组织病理学和分子生物学等多种常用手段,为在体心梗动物模型的构建提供了实践经验,为心梗病理生理学机制和临床转化研究提供了动物模型保障和方法学支持。
建立心梗模型的常用方法包括:冠状动脉结扎、介入栓塞、药物诱导、低温损伤等[9,17]。 其中,冠状动脉左前降支结扎最为常用,具体操作又以腹腔麻醉联合机械通气和挤心脏法为主[14,16],前者需要打开胸腔在显微镜下诱导心肌梗死,创伤大且耗时长;后者由Gao 等[16]于2010 年建立,通过小切口人工暴露,不经插管,因速度快、创伤小、手术死亡率低等优势,被广泛使用[18-19]。 此外,还可通过超声辅助结扎LCA,但因复杂、实施难度大等问题尚未普及[20]。 在此基础上,本研究基于挤心脏法进行了三点探索和改进:第一,将缝合皮肤放在手术最后,与Gao 等[16]报道的心梗模型构建方法中先进行荷包缝合的做法相比,最后缝合可减少术中缝线对操作和视野的影响,且不影响手术成功率,这也提示皮肤缝合速度并非手术失败和小鼠死亡的直接原因,但前提是心脏回纳后胸大肌能完全覆盖肋间隙的创口,使胸腔完全闭合。 先前Andrade 等[21]报道过用手术夹代替缝合线快速闭合皮肤的做法,此做法之所以能提高手术存活率,可能是因为快速闭合皮肤创口,有助于减少气胸的发生,但快速缝合皮肤并非避免气胸所必须的。 第二,向右斜30°做胸部切口而非右斜45°,大量实践发现小鼠胸大肌边缘倾斜度通常为右斜45°左右,做右斜30°的皮肤切口(或略小于30°)可与胸大肌边缘形成一定夹角,有利于回纳心脏后胸腔的闭合,减少气胸的发生。第三,可不挤出左心耳,通常心梗造模的结扎位置以左心耳为标准,在其下2 mm 左右进行结扎,但实践发现左心耳在被挤出胸腔和回纳过程中极易受损出血,导致小鼠死亡,为避免这一现象,可通过练习建立多个心脏参照点进行结扎,术后取材时再观察结扎线与左心耳的距离,以确认结扎位置正确且所有小鼠结扎高度大致相同,有助于提高术中存活率和造模一致性。
此外,本研究在以往研究和实践的基础上,进一步从多个角度完善了小鼠心梗模型的系统性评估体系。 鉴于心梗发生发展的复杂性及其病理生理过程中存在的诸多变化[6-7,22],心梗模型的评价方法较多,例如:梗死区心肌局部变化、心电图改变和血清肌钙蛋白等心梗标志物检测提示心梗发生;心动超声变化提示梗死后心功能改变[23-24];MRI、PET/CT 检测心肌活力[25-26];TTC 染色显示梗死区域;HE 染色及梗死区炎症相关基因检测提示心脏炎症情况;TUNEL 染色及凋亡相关基因检测提示心肌细胞凋亡;Masson 三色染色及纤维化相关基因检测提示心肌修复等。 考虑到科学研究的严谨性和全面性,以及操作的可行性和实用性,本研究综合各个方面,选取了其中几种手段,尝试总结出心梗模型的基本评价体系,主要包括四个方面:心脏形态学评估、心脏功能学评估、组织病理学评估和分子生物学评估。 第一,术中可以通过肉眼观察结扎后心脏局部变化,若结扎后心尖局部发白,说明结扎成功,但由于术中心脏在体外的时间不能过长,为提高手术成功率,术中观察梗死区发白不是必要的,可以选择术后取材时进行细致观察,且此时的梗死区变白现象一般比术中更明显。 此外,还能观察到左室梗死区室壁变薄和炎症组织粘连,且心梗时间越长,室壁越薄,粘连越严重。 第二,可运用心动超声检测心梗后心功能,心梗小鼠相对于假手术组而言,左心功能明显下降,一方面直观体现在动态超声图和M 超中梗死部分心肌活动度下降甚至消失,室壁变薄,室腔变大,提示心肌受损;另一方面体现在左心室各项指标的变化,具体包括:EF、FS显著下降,LVEDV、LVESV、LVIDd、LVIDs 显著升高。 由于心动超声对操作者要求较高,且小鼠个体差异较大,建议每组至少8 只,以减少误差。 第三,组织病理学染色,其中TTC 染色能明显区分梗死区与非梗死区,可在此基础上对梗死面积进行统计;HE 染色可观察到心梗后梗死区心肌萎缩、炎症浸润和边缘区的“红蓝交界”。 第四,分子生物学评估,主要包括术后3 d 炎症指标的检测和术后7 d 纤维化指标的检测。 通常认为,术后3 d 内为小鼠心梗急性炎症期[27-28],术后7 d 进入修复期[28-29],通过检测相关基因表达情况可侧面反映心梗严重程度。 可检测的炎症指标包括:TNF-α、MCP-1、IL-1β、IL-6 等;可检测的纤维化指标包括:FN、COL3A1、MMP-2/9、Postn、TIMP-1 等。
综上,本研究成功建立了小鼠心梗模型,并通过一系列手段对其病变特征进行了评估,提出和总结了一套对小鼠心梗模型评价的方法体系,这将有助于研究心梗发生发展及其干预对策。
参考文献(References)
[ 1] Tsao CW, Aday AW, Almarzooq ZI, et al. Heart disease and stroke statistics-2022 update: a report from the American heart association [J]. Circulation, 2022, 145(8): e153-e639.
[ 2] Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018) [J]. J Am Coll Cardiol, 2018, 72(18): 2231-2264.
[ 3] Bhatt DL, Lopes RD, Harrington RA. Diagnosis and treatment of acute coronary syndromes: a review [J]. JAMA, 2022, 327(7): 662-675.
[ 4] Alfonso F, Gonzalo N, Rivero F, et al. The year in cardiovascular medicine 2020: interventional cardiology [J].Eur Heart J, 2021, 42(10): 985-1003.
[ 5] Members WC, Lawton JS, Tamis-Holland JE, et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization:executive summary: a report of the American college of cardiology/American heart association joint committee on clinical practice guidelines [J]. J Am Coll Cardiol, 2022, 79(2): 197-215.
[ 6] Vogel B, Claessen BE, Arnold SV, et al. ST-segment elevation myocardial infarction [J]. Nat Rev Dis Primers, 2019, 5: 39.
[ 7] Heusch G, Gersh BJ. The pathophysiology of acute myocardial infarction and strategies of protection beyond reperfusion: a continual challenge [J]. Eur Heart J, 2017, 38(11): 774-784.
[ 8] Kornowski R, Orvin K. The clinical challenge of ST-segment elevation myocardial infarction and COVID-19 [J]. J Am Coll Cardiol, 2021, 77(16): 2004-2006.
[ 9] Tang YP, Liu Y, Fan YJ, et al. To develop a novel animal model of myocardial infarction: a research imperative [J].Animal Model Exp Med, 2018, 1(1): 36-39.
[10] Doncheva NT, Palasca O, Yarani R, et al. Human pathways in animal models: possibilities and limitations [J]. Nucleic Acids Res, 2021, 49(4): 1859-1871.
[11] Martin TP, MacDonald EA, Elbassioni AAM, et al. Preclinical models of myocardial infarction: from mechanism to translation[J]. Br J Pharmacol, 2022, 179(5): 770-791.
[12] De Villiers C, Riley PR. Mouse models of myocardial infarction:comparing permanent ligation and ischaemia-reperfusion [J]. Dis Model Mech, 2020, 13(11): dmm046565.
[13] Lindsey ML, Brunt KR, Kirk JA, et al. Guidelines forinvivomouse models of myocardial infarction [J]. Am J Physiol Heart Circ Physiol, 2021, 321(6): H1056-H1073.
[14] Michael LH, Entman ML, Hartley CJ, et al. Myocardial ischemia and reperfusion: a murine model [J]. Am J Physiol Heart Circ Physiol, 1995, 269(6): H2147-H2154.
[15] Shin HS, Shin HH, Shudo Y. Current status and limitations of myocardial infarction large animal models in cardiovascular translational research [J]. Front Bioeng Biotechnol, 2021,9: 673683.
[16] Gao E, Lei YH, Shang X, et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse[J]. Circ Res, 2010, 107(12): 1445-1453.
[17] van den Bos EJ, Mees BME, de Waard MC, et al. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation [J]. Am J Physiol Heart Circ Physiol, 2005, 289(3): H1291-H1300.
[18] Snider JC, Riley LA, Mallory NT, et al. Targeting 5-HT2Breceptor signaling prevents border zone expansion and improves microstructural remodeling after myocardial infarction [ J].Circulation, 2021, 143(13): 1317-1330.
[19] Gan L, Liu D, Xie D, et al. Ischemic heart-derived small extracellular vesicles impair adipocyte function [J]. Circ Res,2022, 130(1): 48-66.
[20] Sicklinger F, Zhang Y, Lavine KJ, et al. A minimal-invasive approach for standardized induction of myocardial infarction in mice [J]. Circ Res, 2020, 127(9): 1214-1216.
[21] Andrade JN, Tang J, Hensley MT, et al. Rapid and efficient production of coronary artery ligation and myocardial infarction in mice using surgical clips [ J]. PLoS One, 2015, 10(11): e0143221.
[22] Reed GW, Rossi JE, Cannon CP. Acute myocardial infarction[J]. Lancet, 2017, 389(10065): 197-210.
[23] Yang Y,Schena GJ,Wang T,et al.Postsurgery echocardiography can predict the amount of ischemia-reperfusion injury and the resultant scar size [J]. Am J Physiol Heart Circ Physiol, 2021, 320(2): H690-H698.
[24] Morra S, Pitisci L, Su F, et al. Quantification of cardiac kinetic energy and its changes during transmural myocardial infarction assessed by multi-dimensional seismocardiography [J]. Front Cardiovasc Med, 2021, 8: 603319.
[25] Jasmin NH, Thin MZ, Johnson RD, et al. Myocardial viability imaging using manganese-enhanced MRI in the first hours after myocardial infarction [ J]. Adv Sci ( Weinh), 2021, 8(11): e2003987.
[26] Sun T, Wei L, Tian H, et al. Novel PET/CT tracers for targeted imaging of membrane receptors to evaluate cardiomyocyte apoptosis and tissue repair process in a rat model of myocardial infarction [J]. Apoptosis, 2021, 26(7-8): 460-473.
[27] Ong SB, Hernández-Reséndiz S, Crespo-Avilan GE, et al.Inflammation following acute myocardial infarction: multiple players, dynamic roles, and novel therapeutic opportunities [J].Pharmacol Ther, 2018, 186: 73-87.
[28] Bacmeister L, Schwarzl M, Warnke S, et al. Inflammation and fibrosis in murine models of heart failure [J]. Basic Res Cardiol,2019, 114(3): 19.
[29] Jin K, Gao S, Yang P, et al. Single-cell RNA sequencing reveals the temporal diversity and dynamics of cardiac immunity after myocardial infarction [ J]. Small Methods, 2022, 6(3): e2100752.

