非重型再生障碍性贫血大鼠模型的构建方法
何丽梅,孙立哲,李媛媛,周智辉,李 宏
(1.陕西中医药大学第二临床医学院,陕西 咸阳 712046; 2.陕西中医药大学第二附属医院,陕西 咸阳 712000;3.陕西中医药大学制药厂,陕西 咸阳 712000)
再生障碍性贫血(AA,aplastic anemia)又称再障,是一种难治的、不多见的,由多种发病机制引起的骨髓造血功能衰竭性疾病。再障根据其发病原因分为遗传性再障(先天性)和获得性再障(后天性)[1],其中获得性再障居多;根据病情轻重、血象、骨髓象等,分为重型再生障碍性贫血(SAA,severe aplastic anemia)、极重型再生障碍性贫血(VSAA,very severe aplastic anemia)和非重型再生障碍性贫血(NSAA,non-severe aplastic anemia),其中非重型再障起病时间较长,以贫血为最先和主要表现,其病理表现为骨髓造血细胞增殖减低,内皮细胞、脂肪空泡增多[2]。目前,AA在亚洲国家的发病率为(39~50)/1 000万,为欧美国家的2~3倍,在我国AA发病率为74/1 000万,其中非重型再障为 60/1 000万,并且北方地区的发病率明显高于南方地区,而经典免疫抑制治疗的缓解率仅在58%~77%,10年的生存率仅为58%左右[3]。对于其确切发病机制尚未明确,因此,构建耗时短、存活率高、模型稳定的AA动物模型,对研究AA发病机制及探索新型药物治疗AA有重要作用。
目前,国内外构建AA动物模型的方法主要有:物理辐射法、化学药物诱导法、免疫介导法、物理化学联合法、物理免疫介导法等,其中单一采用物理、化学法构建的模型不稳定,模型成功率低,存活时间较短,而免疫介导法操作复杂,模型易成重型,程度不易掌握,故而前三种单一构建AA模型法已不常用[4-6]。物理免疫介导法应用最多,成功率最高,但模型生存周期短,不适合后续药物研究,且操作繁杂,技术要求高,需要专人操作。物理化学联合法可以构建稳定、简单、耗时较短的最佳AA模型,适合AA发病机制研究及相关药物治疗机制的探索,张乐等[7]通过137Csγ射线联合环磷酰胺与氯霉素的方法构建的AA 小鼠模型程度重,存活时间短,不适合中医药疗效的研究,且137Csγ射线多用于工业制造业等领域,小剂量不易找寻,其对动物的损伤比X射线大,易致重型。研究主要通过改变造模时间及采用简单易得的X射线联合环磷酰胺与氯霉素构建非重型AA大鼠模型,为研究AA发病机制及研发治疗AA的新型药物提供稳定的再障大鼠模型。
1 材料
1.1 一般材料
购买SPF级、健康、雄性SD大鼠18只,6~8周龄,体重180~200 g,由西安科奥技术有限公司提供,动物实验许可证号为:SCXK(陕)2018-001。所有大鼠自由饮水、进食,清洁饮水及普通饲料饲养。每2~3天更换一次垫料并彻底消毒清洁鼠笼。实验室温度控制在 22~25 ℃之间,室内相对湿度控制在 50%~70%。
1.2 试剂与仪器
CTX粉剂(美国Sigma公司)、氯霉素粉剂(美国 Solarbio公司)、戊巴比妥钠、红霉素软膏、苦味酸、甲醛、PBS缓冲液、5%葡萄糖注射液;全自动兽用血液细胞分析仪(BC5300-vet)、BX51光学显微镜;X射线由陕西中医药大学第二附属医院放疗科提供。
2 方法
2.1 非重型AA大鼠模型的建立
SD雄性大鼠适应性喂养1周,编号,按照随机数表法分组,分别为对照组和模型组,对照组8只,模型组10只。第1天模型组给予2.5 Gy X射线照射,照射量率为400 cGy/min,距离97 cm ,时间1.1 min,全身照射,对照组经铅砖遮挡实行假照射;模型组于第 4、6、8、15、17、19天腹腔注射环磷酰胺40 mg/(kg·d)和氯霉素45 mg/(kg·d),对照组腹腔注射等量生理盐水,共6次,分别于第5天(对照组8只,模型组10只)、第20天(对照组8只,模型组6只)经眼眶静脉采血,测血常规。观察给药期间每组大鼠一般状态(如活动、反应状况等)、饮食状况、体型、毛发色泽、耳朵及脚爪颜色以及是否有出血点等变化,并定期测量大鼠体重,第20天解剖、取材。
2.2 大鼠内眦静脉取血
全部大鼠分别于第5、20天经内眦静脉取血,每只0.3~0.5 mL。将抗凝1.5 mL EP管进行编号,按顺序放置。1%戊巴比妥钠0.3 mL/100 g 腹腔注射,待大鼠达到麻醉理想状态。蘸取75%酒精消毒大鼠眼周皮毛,备皮,准备微量采血吸管,从1/3处折断备用。固定大鼠头部,注意头部朝下,保持眼球呈突出状态,吸管平整端从大鼠鼻侧眼角进入,另一端对准抗凝管口内,调整吸管角度后,快速刺入,可用手挤压大鼠心脏位置,加快出血速度,取血过程中应避免穿刺时用力过大使大鼠致盲。采血完毕后,移除吸管,棉球压迫眼部数分钟止血,消毒,大鼠穿刺部位取适量红霉素软膏涂抹,加快伤口愈合,灌胃补充5%葡萄糖盐水,与采血量相等,以提高大鼠存活率。采集的血标本做好标记,用于外周血细胞(PBC,peripheral blood cell)检测,如红细胞RBC、白细胞WBC、血小板PLT、血红蛋白HGB和红细胞压积百分比HCT。
2.3 脾脏体质、颜色改变
造模期间,模型组大鼠死亡4只,剩余6只,对照组大鼠无死亡,第20天,所有大鼠以1%戊巴比妥钠按照致死量(50 mg/kg)腹腔注射,实施安乐死,无菌条件下剖腹将脾脏完整取出,清洗,称重,观察脾脏色泽、质地及大小改变,计算大鼠脾脏指数,计算公式为
脏器指数=脏器湿重(mg)/体重(g)×100%。
2.4 病理学检测
(1) 脾脏组织病理切片 停止给药后对照组、模型组各随机选取6只,麻醉后,颈部脱臼处死,取出脾脏后,用10%福尔马林固定;用浓度递减的酒精进行逐级脱水干燥,二甲苯透明,石蜡包埋,将标本切片,厚度4 μm,连续切制3片,制成组织切片,脱蜡后分别进行HE染色,置于光学显微镜下观察脾脏病理学。
(2) 骨髓病理切片 游离大鼠右侧股骨,剪开股骨两端,完整取出骨髓,用骨髓专用固定液浸泡固定24 h,进行逐级脱水、塑料包埋、切片(厚4 μm)瑞士-吉木萨染色、中性树胶封片等处理,光学显微镜下观察骨髓组织病理变化。
2.5 统计学分析

3 结果
3.1 两组大鼠给药期间一般状态的比较
对照组活动正常,精神好,饮水、进食均正常,毛发有光泽,体重随时间明显增加,无四肢及脚爪红肿;模型组活动减少,精神萎靡,脱毛、毛色无光,瞳色色泽逐渐变浅,耳廓、四肢、尾巴逐渐苍白,均于造模中后期出现不同程度的四肢及脚爪红肿,伴眼睛、鼻、口腔、脚爪出血点及食欲下降,体重明显下降,大鼠一般情况的比较如图1所示。
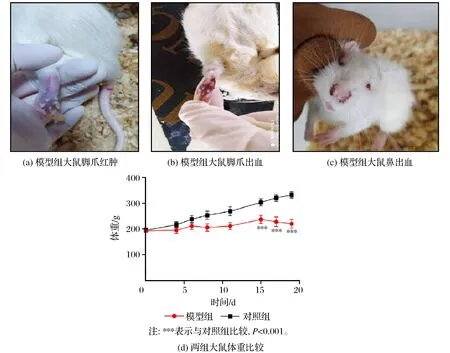
图1 大鼠一般情况的比较Fig.1 Comparison of general conditions of rats
由图1可知,模型组大鼠X射线照射后第4天,体重相对于对照组明显下降,第1次给药后体重较前下降减缓,考虑可能是X射线对大鼠造成的不可逆性损伤,给予小剂量环磷酰胺加氯霉素后对射线有一定拮抗作用,大鼠体重下降减缓。因第5天两组大鼠行眼眶静脉采血,故两组大鼠体重都有所下降。第8天给药第1个循环结束后,模型组大鼠体重无明显变化,对照组体重较前增加。第17天,给药第5次,模型组相对对照组体重明显下降,具有显著差异(P<0.001)。第19天最后一次给药后,模型组大鼠体重下降程度较前增加,对照组体重持续增加,具有显著差异(P<0.001)。
3.2 两组大鼠外周血血常规计数指标的比较
造模第5、20天采血测血常规,比较对照组与模型组大鼠WBC、RBC、PLT、HGB以及HCT的变化,结果如表1所列。造模第5天两组大鼠外周血血常规未见明显变化(P>0.05),差异无统计学意义。造模第20天,与对照组相比,模型组大鼠WBC、RBC、PLT、HGB、HCT均明显低于对照组大鼠(P<0.05),其中WBC、RBC波动幅度较大,差异有明显统计学意义。

表1 第5、20天外周血血常规PBC比较
3.3 两组大鼠脾脏指数的改变
第20天,处死大鼠并进行解剖,观察大鼠脾脏大小、颜色,计算脾脏指数。对照组脾脏体积、颜色均正常,模型组脾脏体积缩小,颜色变黑,两组大鼠脾脏大小、颜色变化如图2所示,脾脏指数如表2所列。与对照组相比,模型组大鼠脾脏指数明显减小,具有显著统计学差异(P<0.001)。

表2 两组大鼠的脾脏指数比较

图2 两组大鼠的脾脏大小、颜色变化Fig.2 Changes of spleen size and color of the two groups
3.4 大鼠脾脏组织病理学比较
对照组与模型组大鼠脾脏病理切片如图3所示,由图3可知,与对照组相比较,模型组脾脏体积缩小,质量减轻,色暗红,脾被膜增厚,切片未见髓外造血,脾小体萎缩,数目减少,脾组织结构疏松,脾血窦扩张,但不充血,呈贫血状,部分区域可见脾小动脉壁增厚及玻璃样变。
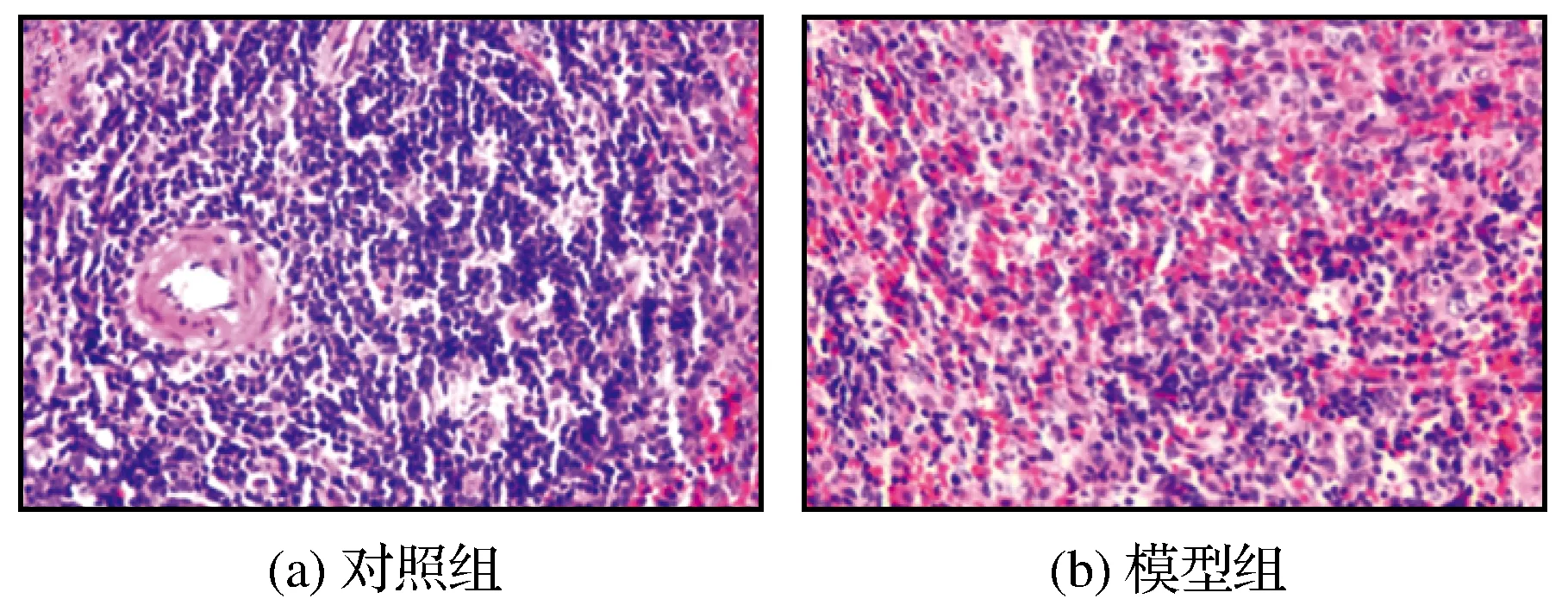
图3 对照组与模型组大鼠脾脏病理切片(HE染色,×400)Fig.3 Pathological sections of spleen in control group andmodel group (HE stain,×400)
3.5 两组大鼠骨髓形态改变
各组大鼠骨髓组织瑞士-吉木萨染色结果如图4所示。图4中黑色箭头为骨髓有核细胞,黄色箭头为粒细胞,红色箭头为脂肪空泡。光学显微镜下,
对照组大鼠骨髓细胞(BMNC)呈增生活跃状态,少见或未见脂肪空泡,可见巨核系细胞、粒系、红系,细胞形态均无明显异常(见图4(a))。

图4 两组大鼠第20天骨髓形态学变化Fig.4 Morphological changes of bone marrow of the two groups on the 20th day
与对照组相比,模型组骨髓增生极度低下,巨核系细胞缺如,红系、粒系均明显减少(见图4(c));骨髓小粒减少,常为空网状结构,脂肪滴增多,非造血细胞(淋巴细胞、浆细胞、组织嗜碱细胞、破骨细胞、脂肪细胞等)相对增高,造血组织减少,呈抑制状态,伴有充血现象(见图4(b))。
3.6 大鼠生存曲线比较
与对照组相比,模型组大鼠造模15天的生存率为80%,20天的生存率为60%,对照组为100%;模型组大鼠被辐射后有6只出现腹大、腹腔出血,概率为60%,2只出现口、鼻、眼出血伴四肢脚爪出血,呈危重状态,重型概率为20%。
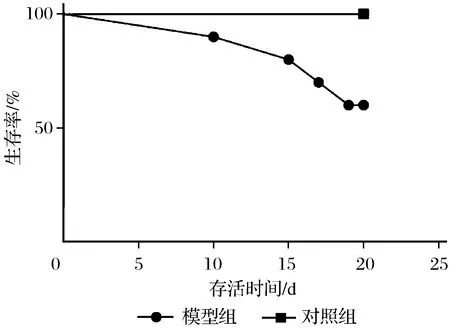
图5 造模期间大鼠生存曲线Fig.5 Survival curve of rats during modeling
4 讨论
目前,国内外有关非重型获得性再生障碍性贫血动物模型的构建方法各有优势与不足,主要为以下几种:物理模型[4],即采用60Coγ射线、X射线、137Csγ射线进行小鼠或大鼠全身照射,此方法制作的模型与人类急性AA相似,但由于辐射剂量难以控制,辐射过大易导致小鼠全身器官的损伤,毒副作用大,模型存活率低;辐射过小损伤较轻易恢复,达不到模型标准,故目前单纯物理模型已较少采用。化学模型[5],即通过常用的化学药物如马利兰、环磷酰胺、白消安和氯霉素等AA诱导剂,用不同浓度的以上药物单一或联合给药,引起造血细胞损伤,达到缓慢持久的骨髓抑制,从而导致AA的发生,此方法成功率较高、操作方法简单、较接近人类AA,但造模周期较长,有研究表明该方法对骨髓抑制是可逆的,在停药后,动物骨髓抑制可恢复。物理免疫介导模型[6],即采用60Coγ射线照射后,尾静脉注射淋巴液,其原理与物理法相似,该模型与临床人类AA患者基本一致,但制作方法较为复杂,对仪器设备要求高,且短期内模型动物死亡率较高,因此该模型适用于与免疫因素有关的急性AA的实验研究。物理化学模型[7-8],即60Co γ射线、137Csγ射线、X射线等射线照射结合化学药物注射,可造成骨髓造血微环境进一步损伤,导致骨髓不断衰竭,从而严重影响造血干细胞的生长、分化,最终使造血功能不能重建,进而发生再障,该方法造模周期短,动物存活时间长,接近人类 AA。物理化学联合法最多见的射线选择为60Coγ射线、137Csγ射线,但一般较难获得,实验选取的射线为经直线粒子加速器发射的X射线,辐射条件较易设定,易于操作;选取的给药方式为两个周期间断给药(第一个周期为第4、6、8天,第二个周期为第15、17、19天),通过调整模型的造模周期,使模型患病程度相对减轻,延长模型的存活时间,有助于进行较长时间的实验研究,尤其适用于相关药物疗效研究及AA发病机制探索,且因操作简单,有助于基层科研实验的进行。
非重型获得性再生障碍性贫血作为一种慢性、需要长期依赖药物支持的疾病,医疗费用昂贵,严重影响个人和家庭的生活质量,威胁人类的健康和生命[9]。研究通过物理化学联合法构建的SD大鼠模型符合非重型获得性再生障碍性贫血的临床诊断标准,实验通过X射线照射联合环磷酰胺、氯霉素构建非重型AA大鼠模型,结果表明:经一定剂量X射线照射后,大鼠精神萎靡,体重骤降,出现腹大、腹泻、纳差等症状,且无法恢复,表明X射线对大鼠的损害是不可逆的,且对大鼠胃肠道的损害更大。通过X射线照射联合化学药物注射结果显示:模型组大鼠外周血白细胞、红细胞、血红蛋白明显减少,红细胞压积百分比降低,符合AA诊断标准;骨髓病理活检显示模型组大鼠骨髓有核细胞减少,停药后其减少程度可减轻,为研发治疗AA的新型药物提供了较稳定的动物模型。此外,研究还发现,多只大鼠在X射线照射后普遍出现腹部膨胀、腹泻、纳差等消化系统症状,考虑是射线损伤胃肠道黏膜所致。有研究表明,益生菌可减轻射线对大鼠胃肠功能的损害[10],因此,在照射前给予适量益生菌可在一定程度上减轻大鼠胃肠道症状,提高大鼠存活率。

