基于3,3′,5,5′-四甲基联苯胺-碘酸根显色体系以近紫外分光光度法测定碘盐中碘酸钾的含量
董 娜,张爱菊,白 莹,张玲杰,黄玉红,张小林
(甘肃医学院,平凉 744000)
碘在人体内具有重要的生理作用[1],可参与甲状腺激素的合成,是人体必需的微量元素之一。但是,碘无法直接在体内合成,一般通过食用含碘酸钾的食盐摄入。相关国家标准GB 5461-2000《食用盐》规定食盐中含碘酸钾量为20~50μg·g-1,而过量添加将会损害身体健康[2-3]。为了保障消费者的健康权益和规范生产企业生产经营行为,有必要提供准确测定食盐中碘含量的方法。
食盐中碘的测定方法主要有分光光度法[4-8]、流动注射安培法[9]、色谱法[10-11]、循环伏安法[12]、电位滴定法[13]等。其中,分光光度法常使用3,3′,5,5′-四甲基联苯胺(TMB)作为显色剂,而TMB 能与碘酸根形成TMB-碘酸根显色体系,在检测波长450 nm 处有最大吸收[8]。基于此原理,该体系可用于碘酸根含量的测定,但检测波长450 nm 处测定灵敏度较低,不适用于检测食盐中的微量碘。经试验发现,TMB-碘酸根显色体系在检测波长372 nm处有较好吸收,因此本工作提出近紫外分光光度法测定碘酸根的含量,以实现食盐中微量碘的检测。
1 试验部分
1.1 仪器与试剂
UV1102型紫外-可见分光光度计。
碘酸钾标准溶液:1 mmol·L-1。
碘酸钾标准溶液系列:分别取适量碘酸钾标准溶液,用水将其逐级稀释成0,0.50,2.50,5.00,10.00,15.00,20.00μmol·L-1的标准溶液系列。
TMB溶液:0.01 mol·L-1,取0.24 g TMB,用适量乙醇溶解后,用水定容至100 mL,摇匀备用。
碘酸钾、乙酸、乙酸钠、TMB 均为分析纯;试验用水为蒸馏水;碘盐样品来自于当地超市。
1.2 试验方法
称取碘盐样品5 g,用水溶解并稀释至50 mL。分取5.00 mL,加入TMB 溶液1.00 mL 和乙酸-乙酸钠缓冲溶液(pH 1.85)5.00 mL,于50 ℃水浴中加热60 min,用水稀释至50 mL。以试剂空白为参比,在372 nm 处测量TMB-碘酸根显色体系的吸光度A。
2 结果与讨论
2.1 显色体系的吸收光谱
试验考察了反应液中碘酸钾浓度分别为0,2.50,5.00,10.00,15.00,20.00μmol·L-1时TMB-碘酸根显色体系吸光度的变化,结果见图1。
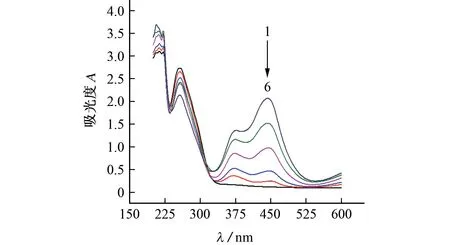
图1 添加不同浓度碘酸钾溶液后TMB-碘酸根显色体系吸光度的变化Fig.1 Absorbance change of TMB-iodate color system after adding different concentrations of potassium iodate solution
由图1可知:TMB仅在258 nm 处有特征吸收峰(曲线6);加入碘酸钾后,在372,444 nm 处新增2个特征吸收峰(曲线1~5),其吸光度均随碘酸钾浓度的增加而增加,同时伴随着258 nm 处吸光度的下降。
2.2 显色反应动力学过程
在TMB溶液中加入1 mmol·L-1碘酸钾标准溶液1.00 mL,考察了70 min内显色体系在258,372,444 nm 处吸光度的变化,所得结果见图2。
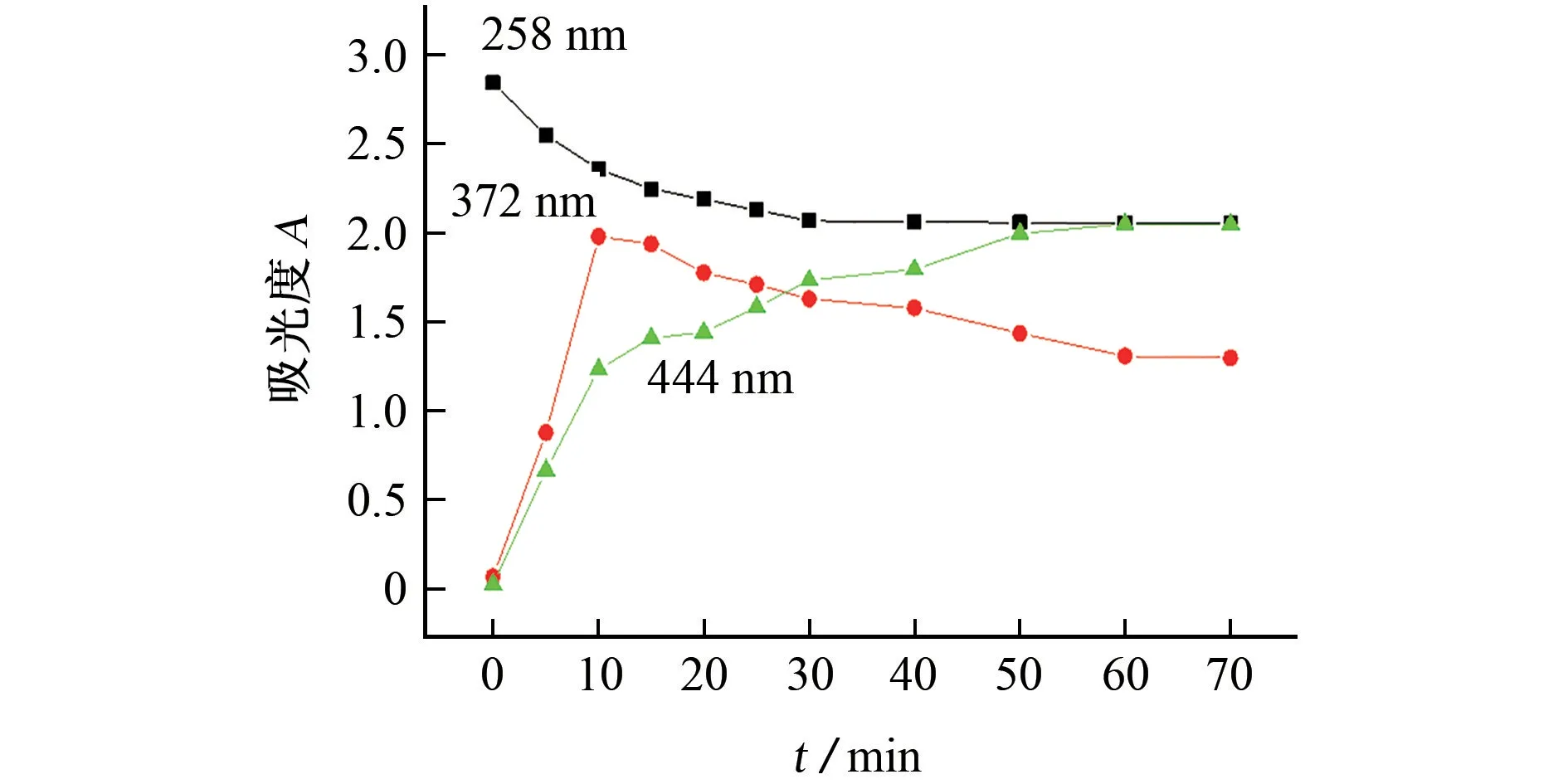
图2 3个检测波长下的动力学曲线Fig.2 Kinetic curves at 3 detection wavelengths
由图2可知:258 nm 处显色体系的吸光度随着反应时间的延长逐渐递减,在30 min后趋于稳定;372,444 nm 处显色体系的吸光度均在10 min内随反应时间的延长呈线性增加,说明该显色体系具有明显的动力学反应特征;15 min后,372 nm 处显色体系的吸光度随着反应时间的延长而降低,在60 min后趋于稳定,444 nm 处显色体系的吸光度随着反应时间的延长而增加,在50 min后趋于稳定。以上结果说明TMB和碘酸根的显色反应是分步完成的,这和文献[14]报道的结果一致,其中372,444 nm 处对应的化合物分别为被单质子化的TMB氧化产物(SQI+)和被完全质子化的TMB 氧化产物(TMQD2+)。
2.3 3个检测波长下的标准曲线和检出限
按照试验方法分析碘酸钾标准溶液系列,以碘酸钾的浓度为横坐标,258,372,444 nm 处对应的吸光度为纵坐标绘制标准曲线,所得表观摩尔吸光系数(ε)以及标准曲线的线性范围、线性回归方程、相关系数见表1。按照试验方法对空白样品平行测定10次,计算测定值的标准偏差(s),以3倍标准偏差与标准曲线斜率(k)的比值计算检出限(3s/k),所得结果见表1。

表1 3种检测波长下的表观摩尔吸光系数、线性参数和检出限Tab.1 Apparent molar absorption coefficients,linearity parameters and detection limits at 3 detection wavelengths
由表1可知:3个检测波长所得线性参数均较好,258,444 nm 处的线性范围超过了食盐中允许添加的碘酸根含量,而372 nm 处的线性范围较宽且检出限较低,因此试验选择372 nm 为检测波长。
2.4 反应介质酸度的选择
在TMB溶液中加入1 mmol·L-1碘酸钾标准溶液1.00 mL,考察了显色体系的酸度分别为pH 1.00,1.50,1.85,1.96,2.47,3.15,4.75,5.00 时 对372 nm 处吸光度的影响。结果显示:当pH 1.50~1.96时,吸光度保持不变;当pH 大于1.96时,吸光度急剧下降,这是由碘酸钾得电子能力降低所致。综合考虑,试验选择乙酸-乙酸钠缓冲溶液的酸度为pH 1.85。
2.5 TMB溶液用量的选择
试验考察了不同用量0.01 mol·L-1TMB 溶液对372 nm 处显色体系吸光度的影响(碘酸钾的用量为1μmol)。结果显示:显色体系的吸光度随着TMB溶液用量的增大而增大;当TMB溶液用量不小于0.60 mL时,吸光度趋于稳定。为了使显色反应完全,试验选择TMB溶液的用量为1.00 mL。
2.6 水浴温度的选择
试验考察了水浴温度为25~60℃时对372 nm处显色体系吸光度的影响。结果显示:吸光度随着水浴温度的升高而增加;在水浴温度不小于60 ℃时,特征吸收峰消失。综合考虑,试验选择水浴温度为50 ℃。
2.7 共存离子干扰试验
试验考察了常见共存离子Na+、Mg2+、Ca2+、K+、Cl-、SO42-对372 nm 处显色体系吸光度的影响(碘酸钾的用量为1μmol)。结果显示:在相对误差绝对值不大于5% 时,100倍的Na+、Mg2+、Ca2+、K+、Cl-、SO42-对碘酸钾的测定不产生干扰。
2.8 精密度和回收试验
按照试验方法对3个实际样品进行加标回收试验,每个样品平行测试6次,计算回收率和测定值的相对标准偏差(RSD),结果见表2。

表2 精密度和回收试验结果(n=6)Tab.2 Results of tests for precision and recovery(n=6)
由表2可知:食盐中碘酸钾的检出量为1.16~1.58μmol·L-1,换算为质量分数,所得结果为24.82~33.81μg·g-1,与标签值(19~39μg·g-1)一致,且均在国家标准GB 5461-2000规定的范围(20~50μg·g-1)内;碘酸钾的回收率为96.4%~101%,RSD 为1.6%~2.1%,说明本方法的准确度较高,精密度较好,可用于食盐中碘含量的测定。
本工作以372 nm 为检测波长,基于TMB-碘酸根显色体系,以近紫外分光光度法测定食盐中的微量碘酸根。该方法操作简单,线性范围宽、检出限低、精密度及准确度较高,可用于监测食盐中碘的添加水平。

