针刺对肾虚型多囊卵巢综合征不孕症患者免疫调控及临床妊娠率的影响
魏慧俊,李金霞,高学娟,尹艳茹,王孟长
(浙江中医药大学附属湖州中医院,湖州 313000)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种常见的女性生殖内分泌疾病,以高雄激素血症及持续无排卵为主要特征,可导致女性生殖障碍与代谢异常,发生率高达 5%~10%,其所导致的不孕占无排卵性不孕症的75%[1]。对于育龄期PCOS患者来说,最典型的表现为月经不规律、闭经、多毛、肥胖等,不孕症是其就诊的主要原因。PCOS不孕症属中医学“不孕”范畴,临床表现为虚实夹杂的本虚标实证,与肾、肝、脾等功能失调密切相关,多认为肾虚为本病的重要病机[2]。PCOS不孕症不仅可影响患者生殖内分泌功能,还会引起子宫内膜癌、糖尿病、高脂血症等诸多严重的远期性并发症,增加患者的生理健康风险及焦虑、抑郁的发病率,并带来一定的经济负担[3]。近年来,针刺治疗在生殖内分泌领域已应用于月经病和不孕症,具有调节整体功能、调经助孕等优势。现代研究表明,针刺可通过调节下丘脑-垂体-卵巢性腺轴功能而诱发排卵,并可促进卵泡发育和改善黄体功能[4-6]。本研究通过对100例肾虚型PCOS不孕症患者的临床资料进行回顾性分析,探讨顺应月经周期分期针刺对肾虚型PCOS不孕症患者免疫调控及临床妊娠率的影响。
1 临床资料
1.1 一般资料
共 100例 PCOS不孕症患者来自 2018年 6月至2020年6月浙江中医药大学附属湖州中医院妇科门诊,按就诊顺序采用查随机数字表法分为治疗组和对照组,每组 50例。治疗组年龄 22~38岁,平均(28±6)岁;病程 1~6 年,平均(2.83±0.78)年;身体质量指数(body mass index, BMI)为 18~27 kg/m2,平均(24.15±2.78)kg/m2。对照组年龄 23~39 岁,平均(27±6)岁;病程 1~7 年,平均(2.79±0.88)年;BMI为 18~28 kg/m2,平均(25.01±2.41)kg/m2。两组患者年龄、病程及BMI比较,差异无统计学意义(P>0.05),具有可比性。
1.2 诊断标准
PCOS西医诊断标准参照《多囊卵巢综合征诊断中华人民共和国卫生行业标准》[7];中医诊断标准参照《中医妇科学》[8]中肾虚型相关标准。不孕症参照《妇产科学》[9]中的相关标准。
1.3 纳入标准
①符合上述诊断标准;②已婚女性,年龄为 21~40岁;③配偶精液检查正常;④近3个月未进行激素人工周期治疗,且未服用影响内分泌药物或避孕药;⑤病情稳定且意识清晰,沟通无障碍;⑥患者及家属均知情,同意参与本研究。
1.4 排除标准
①有针刺禁忌证者;②合并输卵管不通、生殖器畸形、性腺发育不全等其他不孕因素者;③合并心、肝、肾、脑等重大疾病者;④合并肾上腺、垂体或甲状腺等内分泌疾病者;⑤月经初潮1年内或卵巢早衰者;⑥合并子宫内膜异位症、子宫肌瘤、子宫腺肌症等疾病者。
2 治疗方法
2.1 治疗组
顺应月经周期行针刺分期治疗。主穴取关元、三阴交、命门和腰俞穴。卵泡期(月经周期开始后8~12 d)取气海、子宫和太溪穴;排卵期(月经周期开始后13~15 d)取中极、合谷、卵巢和血海穴;黄体期(月经周期开始后 16~28 d)取肝俞、肾俞和脾俞穴。患者取仰卧位,针刺前先排空膀胱,穴位局部皮肤常规消毒后,采用0.25 mm×40 mm毫针垂直刺入20~25 mm,反复提插捻转,针刺中极、关元、气海以患者感觉向会阴放射为得气,针刺命门以患者感觉向子宫放射为得气,得气后每10 min行针1次,留针30 min。卵泡期及黄体期隔日治疗1次,排卵期每日治疗1次,月经期不给予针刺。3个月经周期为1个疗程,治疗2个疗程。
2.2 对照组
于月经第 5天(月经稀发或闭经的患者于黄体酮撤退出血后第5天)开始口服枸橼酸氯米芬胶囊(上海衡山药业有限公司,国药准字 H31021107)50 mg,每日晚饭后 30 min服用,连续服用 5 d。3个月经周期为1个疗程,治疗2个疗程。
3 治疗效果
3.1 观察指标
3.1.1 各项激素水平
两组治疗前后(月经周期第 2~4天)分别抽取晨起空腹静脉血10 mL,用全自动化学发光分析仪进行检测黄体生成素(luteinizing hormone, LH)、卵泡刺激素(follicle stimulating hormone, FSH)、睾酮(testosterone, T)、雌二醇(estradiol, E2)水平,并计算LH/FSH比值。
3.1.2 外周血NK细胞
两组治疗前后分别采用流式细胞仪检测外周血NK细胞,采用Cell Quest软件计算NK细胞占比。抗体与血细胞孵育,用溶血素去除成熟红细胞,集1万个细胞,再用FSC和SSC散点图或CD45和SSC散点图圈淋巴细胞群,计算NK细胞在淋巴细胞群中的百分比。
3.1.3 外周血Th1/Th2细胞因子
两组治疗前后分别检测 Th1细胞因子[干扰素(interferon gamma, IFN)-γ]、Th2 细胞因子[白细胞介素(interleukin, IL)-4]。首先将 PMA、IS和 BFA加入肝素抗凝的外周血中,37 ℃、5% CO2孵育4 h,抗CD3、CD8抗体孵育15 min,裂解破膜,用抗IFN-γ-FITC和抗IL-4-PE抗体标记细胞,孵育20 min后检测。
3.1.4 妊娠率
排卵15 d后,血清绒毛膜促性腺激素水平25 U/L以上即为生化妊娠;间隔15 d后阴道B超发现孕囊即为临床妊娠。两组治疗后分别统计妊娠率。
3.2 疗效标准
根据《中药新药临床研究指导原则》[10]中相关标准判断临床疗效。
痊愈:临床症状及体征消失,月经恢复正常并维持>3个月,血清性激素水平恢复正常。
显效:临床症状及体征部分消失,月经周期及血清性激素水平基本恢复正常。
有效:临床症状及体征有所好转,月经恢复正常维持≤3个月,血清性激素水平较治疗前有所好转。
无效:临床症状及体征、血清性激素水平等无改善甚至加重。
3.3 统计学方法
本研究数据均采用SPSS21.0软件进行统计分析。符合正态分布的计量数据采用均数±标准差表示,以t检验对两组数据进行比较;计数数据采用百分率表示,以卡方检验对两组间数据进行比较。以P<0.05表示差异具有统计学意义。
3.4 治疗结果
3.4.1 两组临床疗效比较
由表1可见,治疗组总有效率为88.0%,高于对照组的68.0%,差异具有统计学意义(P<0.05)。
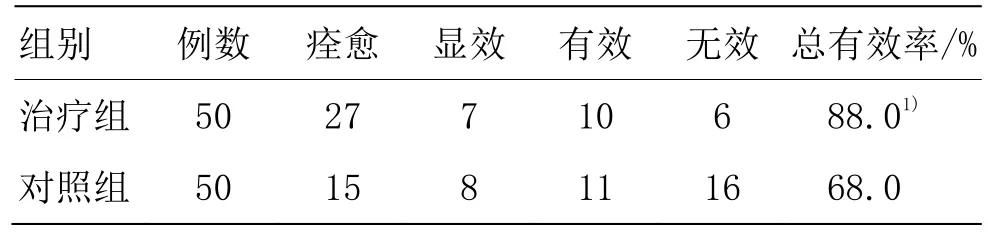
表1 两组临床疗效比较 (例)
3.4.2 两组治疗前后各项性激素水平比较
由表2可见,两组治疗前各项性激素水平比较,差异均无统计学意义(P>0.05)。治疗组治疗后LH、T、LH/FSH水平明显降低,E2水平明显升高,与同组治疗前比较,差异均具有统计学意义(P<0.05);对照组治疗后LH、LH/FSH水平较同组治疗前明显降低(P<0.05)。两组治疗后LH、E2、T、LH/FSH水平比较,差异均具有统计学意义(P<0.05)。
表2 两组治疗前后各项性激素水平比较 (±s)
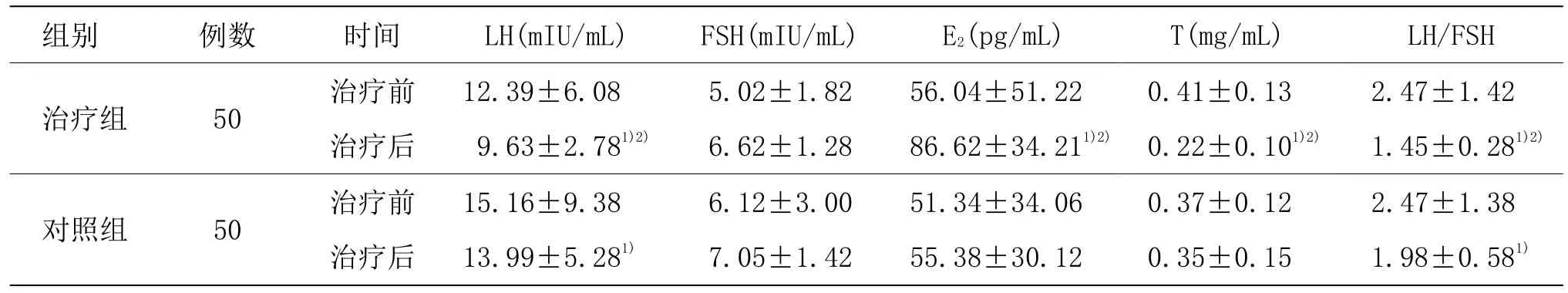
表2 两组治疗前后各项性激素水平比较 (±s)
注:与同组治疗前比较 1)P<0.05;与对照组比较 2)P<0.05
组别 例数 时间 LH(mIU/mL) FSH(mIU/mL) E2(pg/mL) T(mg/mL) LH/FSH治疗组 50 治疗前 12.39±6.08 5.02±1.82 56.04±51.22 0.41±0.13 2.47±1.42治疗后 9.63±2.781)2) 6.62±1.28 86.62±34.211)2) 0.22±0.101)2) 1.45±0.281)2)对照组 50 治疗前 15.16±9.38 6.12±3.00 51.34±34.06 0.37±0.12 2.47±1.38治疗后 13.99±5.281) 7.05±1.42 55.38±30.12 0.35±0.15 1.98±0.581)
3.4.3 两组治疗前后外周血NK细胞各项指标比较
由表3可见,两组治疗前外周血NK细胞占比及各亚群比较,差异均无统计学意义(P>0.05)。两组治疗后外周血 NK细胞占比均较同组治疗前明显降低(P<0.05),且治疗组治疗后外周血 NK细胞占比明显低于对照组(P<0.05)。两组治疗后外周血NK细胞各亚群组内及组间比较,差异均无统计学意义(P>0.05)。
表3 两组治疗前后外周血NK细胞各项指标比较 (±s, %)
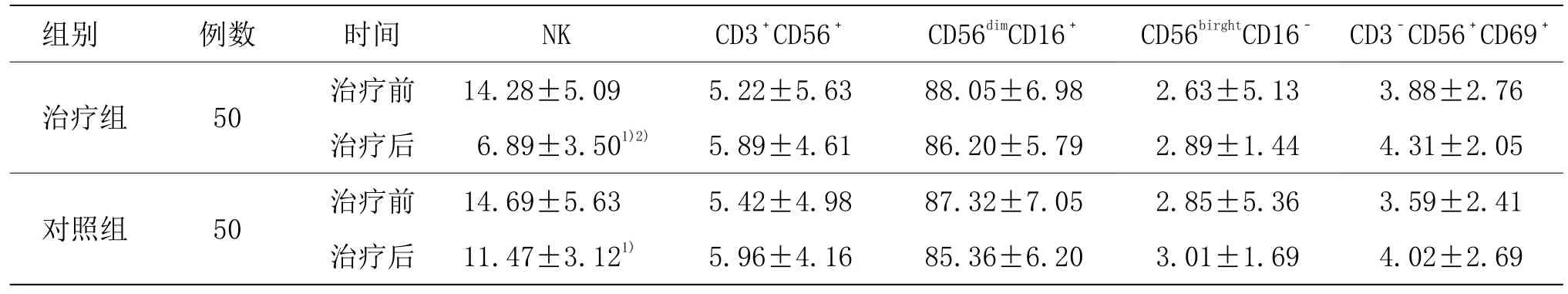
表3 两组治疗前后外周血NK细胞各项指标比较 (±s, %)
注:与同组治疗前比较 1)P<0.05;与对照组比较 2)P<0.05
组别 例数 时间 NK CD3+CD56+ CD56dimCD16+ CD56birghtCD16- CD3-CD56+CD69+治疗组 50 治疗前 14.28±5.09 5.22±5.63 88.05±6.98 2.63±5.13 3.88±2.76治疗后 6.89±3.501)2) 5.89±4.61 86.20±5.79 2.89±1.44 4.31±2.05对照组 50 治疗前 14.69±5.63 5.42±4.98 87.32±7.05 2.85±5.36 3.59±2.41治疗后 11.47±3.121) 5.96±4.16 85.36±6.20 3.01±1.69 4.02±2.69
3.4.4 两组治疗前后外周血Th1/Th2细胞因子比较
由表 4可见,两组治疗前 Th1、Th2细胞因子及Th1/Th2比值比较,差异均无统计学意义(P>0.05)。两组治疗后Th1细胞因子、Th1/Th2均较同组治疗前明显降低(P<0.05),且治疗组治疗后Th1细胞因子、Th1/Th2明显低于对照组(P<0.05)。两组治疗后Th2细胞因子组内及组间比较,差异均无统计学意义(P>0.05)。
表4 两组治疗前后外周血Th1/Th2细胞因子比较 (±s)
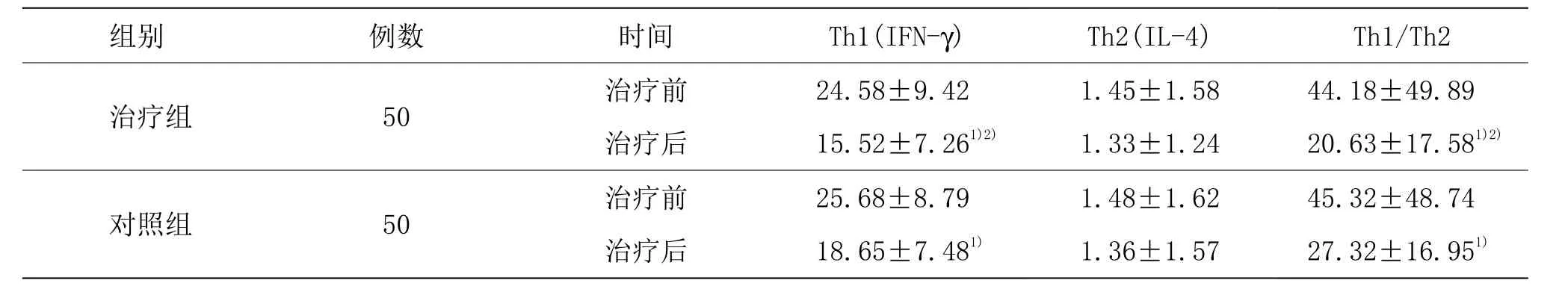
表4 两组治疗前后外周血Th1/Th2细胞因子比较 (±s)
注:与同组治疗前比较 1)P<0.05;与对照组比较 2)P<0.05
组别 例数 时间 T h 1(I F N-γ)治疗组 5 0 治疗前 2 4.5 8±9.4 2治疗后 1 5.5 2±7.2 6 1)2)对照组 5 0 治疗前 2 5.6 8±8.7 9治疗后 1 8.6 5±7.4 8 1)T h 2(I L-4) T h 1/T h 2 1.4 5±1.5 8 4 4.1 8±4 9.8 9 1.3 3±1.2 4 2 0.6 3±1 7.5 8 1)2)1.4 8±1.6 2 4 5.3 2±4 8.7 4 1.3 6±1.5 7 2 7.3 2±1 6.9 5 1)
3.4.5 两组治疗后妊娠率比较
由表 5可见,治疗组生化妊娠率及临床妊娠率分别为78.0%和56.0%,对照组分别为40.0%和22.0%,两组比较差异均具有统计学意义(P<0.05)。

表5 两组治疗后妊娠率比较 [例(%)]
4 讨论
多囊卵巢综合征主要是由于女性生殖内分泌及代谢功能出现障碍而引起的排卵障碍,为育龄期女性无排卵性不孕的重要原因。PCOS不孕症至今尚无较好的治疗方案,西医主要采用激素进行促排卵,但易引起卵巢过度刺激综合征,且具有流产率高、不良反应大等缺点[11]。针刺作为中医学的重要组成部分,近年来在国内外生殖学领域得到广泛应用。针刺治疗PCOS不孕症临床效果显著,且有助于提高对体外受 精-胚胎移植的妊娠率。针刺能调节人体内分泌功能,维持下丘脑-垂体-卵巢轴功能的平衡状态[12]。针刺还可通过调节血糖水平等多种靶点和途径使人体内分泌功能趋于稳定的状态,降低 PCOS患者高雄激素和胰岛素异常水平,进而恢复卵巢正常的排卵功能,提高PCOS不孕妇女的妊娠率。同时,顺应月经周期分期针灸治疗以补肾培元、理气活血,促进卵巢排卵[13-14]。在卵泡期给予针刺能使卵泡生长成熟子宫内膜增生;在黄体期可调节阴阳,促进黄体成熟,为妊娠卵植入或下次月经打下良好的物质基础。朱璇[15]研究发现,在单纯西药治疗的基础上给予针刺治疗,配合不同时期辨证取穴,可明显改善患者激素水平,促进患者排卵和妊娠。本研究结果显示,治疗组经针刺分期治疗后临床总有效率为 88.0%,优于对照组,提示针刺可改善临床症状,疗效更佳。治疗组治疗后LH、T、LH/FSH水平低于对照组,E2水平高于对照组,提示针刺可调节卵巢激素的分泌,改善性腺轴功能,促进体内激素水平趋于正常。
NK细胞是母胎免疫的主要细胞群,在妊娠过程中起重要作用。下丘脑-垂体-性腺轴功能障碍和卵泡功能障碍的发生过程中可能有炎症的参与,性激素也可调节细胞免疫功能,而PCOS患者的细胞免疫活性可能与高雄激素有关[16]。本研究结果显示,治疗组治疗后NK细胞占比明显低于对照组,提示针刺可降低PCOS不孕症患者外周血 NK细胞活性,减轻卵巢纤维化的发生。Th1/Th2平衡与妊娠结局密切相关,Th1型细胞因子过度表达时,胚胎吸收率高,最终导致不孕、反复自然流产和妊娠期高血压等发生[17]。PCOS不孕症患者外周血Th1细胞因子和Th1/Th2水平高于正常人群,推测PCOS不孕症患者可能存在免疫紊乱[18]。本研究结果显示,治疗组治疗后Th1细胞因子、Th1/Th2比值均低于对照组,提示针刺可调节PCOS不孕症患者免疫状态。
综上所述,顺应月经周期分期针刺治疗肾虚型PCOS不孕症患者临床效果显著,可调节患者体内NK细胞活性,纠正Th1/Th2细胞因子失衡状态,提高临床妊娠率,具有重要的现实意义。

