蓝靛果米糠酵素发酵工艺优化及其代谢产物变化分析
包怡红,赵鑫磊,唐 妍,张俊顺,卢卫红,马 莺,于殿宇
(1.东北林业大学 林学院,黑龙江 哈尔滨 150040;2.黑龙江省森林食品资源利用重点实验室,黑龙江 哈尔滨 150040;3.哈尔滨工业大学 化工与化学学院,黑龙江 哈尔滨 150001;4.东北农业大学 食品学院,黑龙江 哈尔滨 150030)
蓝靛果Lonicera caerulea属忍冬科,多年生落叶小灌木,又名蓝靛果忍冬,是继越橘、沙棘等之后的又一新兴浆果树种。常生长于野外、沿河、沼泽地或森林空地,原产于俄罗斯东北部、中国、日本和加拿大,主要生长在我国西南、东北等地,特别是大小兴安岭和长白山地区,抗寒能力强,属于耐寒植物。蓝靛果中富含花青素、鞣花酸和超氧化物歧化酶等多种抗氧化成分[1],还富含维生素C、B1、B2等、膳食纤维、矿物质、人体必需氨基酸等营养成分,而花色苷和黄酮类化合物是蓝靛果果实中的主要功能成分,具有多种生理功能和药理作用。Wu 等利用诱发关节炎小鼠模型和巨噬细胞模型验证了蓝靛果多酚提取物具有抗炎和抗氧化的功能。随着蓝靛果研究的深入,其营养价值和医疗保健价值逐渐被重视,但是由于蓝靛果口味酸涩,不宜直接食用,因此常被加工制作成各种产品,如果醋、果酒、果酱等。岳晓霞等[2]以蓝靛果和苹果为原料,未经发酵制得了风味独特的复合果酱。包怡红等[3]以野生蓝靛果为原料,通过添加食用酒精、糖、酸味剂等配料获得了高品质的蓝靛果酒;梁敏等[4]采用碳酸钙和碳酸钠复合降酸剂对蓝靛果酒进行降酸,提高了果酒中有机钙的含量。
酵素是采用一种或多种原料,经有益菌发酵的含有多种酶和次级代谢产物等成分的发酵产品,具有调节菌群平衡、清除体内垃圾和延缓衰老等功效。随着对酵素食品关注度的不断提升,酵素的生产工艺也得到了深入研究并取得一系列进展。蒋增良等[5]研究表明葡萄酵素具有丰富的有机酸和良好的抗氧化性能;刘毅超[6]研究发现谷芽酵素中含有的多酚类和谷胱甘肽等化合物可以清除羟基自由基、ABTS 自由基和DPPH 自由基且还原力较强。米糠中富含角鲨烯、γ-谷维醇、不饱和脂肪酸、多酚等生物活性物质,在预防心脑血管疾病、增强机体免疫力、抗癌和预防便秘等方面具有显著的功能作用,是保健食品和医药的重要原料[8]。由于乳酸菌和酵母菌中含有谷氨酸脱羧酶可催化生产GABA,米糠中谷氨酸含量丰富、谷氨酸脱羧酶活力较高且不受资源、环境和空间的限制。除此之外,两种菌种均为具有保健作用的益生菌,与食品工艺的关系密切,因此本研究以蓝靛果为主要发酵原料,米糠为GABA 合成的酶源,蜂蜜和红糖为碳源,利用乳酸菌和酵母菌发酵制备了营养物质丰富的多功能酵素产品,优化发酵工艺的同时,系统研究了其代谢产物和抗氧化活性的相关性。酵素作为一种绿色高效的加工方式,除了可以解决蓝靛果和米糠的贮藏问题,还可以实现林产品的精深加工,拓宽应用市场,为林下资源的综合开发提供相关理论依据和技术支持。
1 材料与方法
1.1 材料、菌株与试剂
蓝靛果由黑河市中俄林业科技合作园提供;米糠(成分组成包括稻谷皮层、糊粉层、米胚和少量胚乳;基本营养物质组成包括水分、蛋白质、脂肪、不饱和脂肪酸、碳水化合物、膳食纤维、灰分和生育三烯酚),由黑龙江省五常市米业有限公司提供。
供试菌:植物乳杆菌Lactobacillus plantarum和酿酒酵母Saccharomyces cerevisiae均由东北林业大学微生物实验室提供。
红糖、蜂蜜,市购;果胶酶(活力≥1 000 U/mg),上海源叶生物科技有限公司;标准品(γ-氨基丁酸、芦丁、没食子酸、柠檬酸、乳酸、抗坏血酸、乙酸、草酸),上海源叶生物科技有限公司;DPPH、ABTS(均为分析纯),上海阿拉丁试剂有限公司;甲醇(色谱纯),天津市福晨化学试剂厂;氢氧化钠、福林酚、硼酸、次氯酸钠、苯酚、硝酸铝、亚硝酸钠、柠檬酸、柠檬酸钠、硫酸亚铁、过氧化氢(均为分析纯),天津市恒兴化学试剂制造有限公司。
1.2 仪器与设备
JYL—C91T 型榨汁机,九阳股份有限公司;PHS—3E 雷磁pH 计,上海仪电科学仪器股份有限公司;721 可见光分光光度计,上海佑科仪器仪表有限公司;H/T20MM 台式高速离心机,湖南赫西仪器装备有限公司;DH6000A 电热恒温培养箱,天津市泰斯特仪器有限公司;TECHCOMP LC 2050 Organizer 高效液相色谱仪,上海天美科学仪器公司;DY04—13—44—00 压力蒸汽灭菌器,上海东亚压力容器制造有限公司。
1.3 方法
1.3.1 蓝靛果米糠酵素制备
1)酶解
蓝靛果清洗后按照料水比为1∶3(g∶mL)的比例打浆,经果胶酶进行酶解,果胶酶添加量为2.5%,置于26℃酶解2 h。
2)米糠预处理
将米糠与无菌水按料水比1∶15(g∶mL)的比例混匀,煮沸90 min,4 000 r/min 条件下离心5 min,保留上清液[9]。
3)发酵培养基的制备
将蓝靛果浆液和米糠上清液按照所需比例混匀,每100 mL发酵培养基中加入5 g红糖和3 g蜂蜜,调pH 至6.25,121℃灭菌15 min,冷却至室温备用。
4)接种
将植物乳杆菌和酿酒酵母活化,使菌液浓度达到(植物乳杆菌为1×109CFU/mL,酿酒酵母为1×107CFU/mL)。
5)发酵
按照所需接种量接种到发酵培养基中,放置于恒温培养箱中28℃下静置培养24 h。发酵终止后用纱布将样品过滤,4 000 r/min 条件下离心5 min,弃沉淀物,将得到的蓝靛果米糠酵素置于4℃保存,待测。
1.3.3 原料比例对蓝靛果米糠酵素GABA 及pH值的影响
将蓝靛果浆液与米糠上清液按照1∶2、1∶1、2∶1、3∶1、4∶1 的比例(mL∶mL)混合制备发酵培养基,121℃灭菌15 min,冷却至室温后向发酵培养基中接入3%复合发酵菌种(植物乳杆菌与酿酒酵母的接种比例为1∶1),于28℃恒温培养箱中静置培养24 h 后测定GABA 含量和pH 值变化,确定蓝靛果米糠酵素的最佳原料比例。
1.3.4 菌种比例对蓝靛果米糠酵素GABA 及pH值的影响
将蓝靛果浆液与米糠上清液按照3∶1 的比例混合制备发酵培养基,121℃灭菌15 min,冷却至室温后向发酵培养基中接入3%复合发酵菌种(植物乳杆菌与酿酒酵母的接种比例分别为(3∶1、2∶1、1∶1、1∶2、1∶3),于28℃恒温培养箱中静置培养24 h 后测定GABA 含量和pH 值的变化,确定蓝靛果米糠酵素发酵的最佳菌种比例。
1.3.5 装液量对蓝靛果米糠酵素GABA 及pH 值的影响
参考牛广财等[10]的研究方法并略作修改,将蓝靛果浆液与米糠上清液按照3 ∶1 的比例混合制备发酵培养基,按照26.7%(80 mL/300 mL)、40%(120 mL/300 mL)、53.3%(160 mL/300 mL)、66.7%(200 mL/300 mL)、80.0%(240 mL/300 mL)的装液量分别装入300 mL 容量瓶中,121℃灭菌15 min,冷却至室温后向发酵培养基中接入3%复合发酵菌种(植物乳杆菌与酿酒酵母的接种比例为1∶1),放置于恒温培养箱中28℃下静置培养24 h 后测定GABA 含量和pH 值的变化,确定蓝靛果米糠酵素发酵的最佳装液量。
1.3.6 温度对蓝靛果米糠酵素GABA 及pH 值的影响
将蓝靛果浆液与米糠上清液按照3∶1 的比例混合制备发酵培养基,按照66.7%的装液量装入300 mL 容量瓶中,121℃灭菌15 min,冷却至室温后向发酵培养基中接入3%复合发酵菌种(植物乳杆菌与酿酒酵母的接种比例为1∶1),分别于26、28、30、32、34℃恒温培养箱中静置培养24 h后测定GABA 含量和pH 值变化,确定蓝靛果米糠酵素发酵的最佳温度。
1.3.7 时间对蓝靛果米糠酵素GABA 及pH 值的影响
将蓝靛果浆液与米糠上清液按照3∶1 的比例混合制备发酵培养基,按照66.7%的装液量装入300 mL 容量瓶中,121℃灭菌15 min,冷却至室温后,向发酵培养基中接入3%复合发酵菌种(植物乳杆菌与酿酒酵母的接种比例为1∶1),于28℃恒温培养箱中静置培养12、24、36、48、60 h 后测定GABA 含量和pH 值的变化,确定蓝靛果米糠酵素发酵的最佳时间。
1.3.8 正交试验
在单因素试验的基础上,以原料比例(A)、菌种比例(B)、装瓶量(C)、温度(D)、时间(E)5 个因素,以GABA 含量为指标,进行5 因素3水平正交试验,确定最佳发酵工艺,正交试验因素与水平见表1。
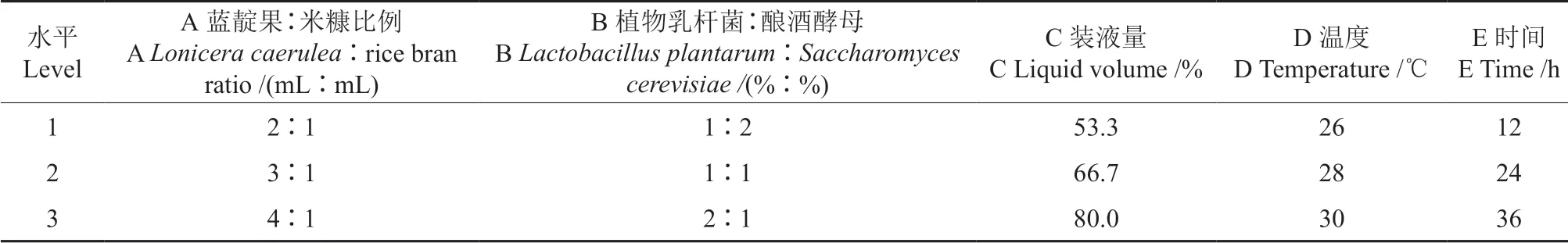
表1 因素水平Table 1 Factor level
1.3.9 代谢产物及抗氧化活性的测定
1)pH 值的测定
采用pH 计测定pH 值,按照说明书操作。
2)GABA 含量的测定
取0.6 mL 酵素样品,加入0.2 mol/L 的硼酸缓冲液(pH 值为9.0)0.4 mL,混匀后加入质量分数为6%的苯酚0.8 mL 和质量分数为5.25%的次氯酸钠溶液1.5 mL,充分振荡后在沸水浴中反应10 min,迅速在冰浴中冷却 20 min,待出现蓝绿色后于波长640 nm 处测定吸光度[11]。
3)总黄酮含量的测定
参考NaNO2-Al(NO3)3比色法[12]测定酵素中总黄酮含量。取400 μL 酵素样品,加入50 g/L NaNO2溶液150 μL,混匀静置 6 min,加入100 g/L Al(NO3)3溶液150 μL,混匀静置6 min,加入40 g/L NaOH 溶液2 mL,用去离子水定容至5 mL,混匀静置15 min,于510 nm 波长处测定吸光度。以芦丁作标准品制作标准曲线,建立线性回归方程,总黄酮含量以芦丁当量表示。
4)总酚含量的测定
参考福林法[13]测定酵素中的总酚含量。取400 μL 酵素样品,用去离子水稀释至0.5 mL,加入体积分数为10%的福林酚溶液2.5 mL,常温避光静置反应3 min 后,加入75 g/L Na2CO3溶液2 mL,混匀。于25 ℃反应1 h,于765 nm 波长处测定吸光度。以没食子酸作标准品制作标准曲线,建立线性回归方程,总酚含量以没食子酸当量表示。
5)花色苷含量的测定
参考pH 示差法测定酵素中花色苷的含量。取10 mL 酵素样品于100 mL 烧杯中,用0.1 mol/L柠檬酸-柠檬酸钠缓冲溶液调pH 至 3.0,再用上述缓冲溶液将调好pH 的酵素定容至100 mL 进行稀释。取1 mL 稀释样品,加入9 mL pH 为1.0 和4.5 的缓冲溶液,40℃水浴平衡20 min 后,于波长510 和700 nm 处测定吸光度[14]。
6)总酸含量的测定
参考GB/T 12456—2008《食品中总酸的测定方法》中的pH 电位法。
7)特征性有机酸含量的测定[15]
取400 μL 酵素样品,使用0.01 mol/L KH2PO4(pH 值为2.7)溶液稀释至1 mL,经0.22 μm 微孔膜过滤,待测。配制质量浓度均为1 mg/mL 的抗坏血酸、柠檬酸、乙酸、乳酸、草酸标准溶液经0.22 μm 微孔滤膜过滤,待测。
检测条件。色谱柱:UHPAQ C18 柱;流动相甲醇-KH2PO4(pH 值为2.7)2∶98(V∶V);流速:1.0 mL/min;柱温:25℃;进样量:10 μL;检测波长:210 nm。检测器:二极管阵列检测器。
8)DPPH 自由基清除能力测定
取2 mL 样液,加入0.1 mmol/L 的DPPH 溶液2 mL,摇匀,室温避光放置30 min,于波长517 nm 处测定吸光度[16]。以Trolox 为标准品作标准曲线,DPPH 自由基清除能力以μmolTrolox 当量(μmTrolox)/g 表示。
9)ABTS 自由基清除能力测定
ABTS 稀释液制备:称取96.02 mg ABTS 和16.55 mg 过硫酸钾,用5 mmol/L 的磷酸盐缓冲液(pH 值为7.4)定容至25 mL,在暗处室温放置12~16 h,使用前用上述磷酸盐缓冲液稀释,使其在波长734 nm 处的吸光度为(0.7±0.02)[17]。
取4 μL 酵素样品,用上述磷酸盐缓冲液稀释至300 μL,加入ABTS 缓冲液5 mL,于30℃下反应1 h。以去离子水为空白对照,于波长734 nm处测吸光度。以Trolox 为标准品作标准曲线,ABTS 自由基清除能力以μmol Trolox 当量(μmTrolox)/g 表示。
10)羟基自由基清除能力测定
取50 μL 酵素样品,依次加入50 μL 1.5 mmol/L的FeSO4和100 μL 6 mol/L 的H2O2,充分摇匀后室温下放置10 min,加入50 μL 20 mmol/L 的水杨酸,充分摇匀室温下放置30 min,于波长562 nm处测定吸光度[18]。以Trolox 为标准品作标准曲线,羟基自由基清除能力以μmol Trolox 当量(μmTrolox)/g 表示。
1.4 数据统计分析
试验数据以均值±标准差(Mean±SD)形式表示。采用最小显著性差异法和Duncan 法进行多重比较,应用SPSS 26.0 软件进行方差分析、显著性分析和相关性分析,应用Origin 8.6 软件绘制图表,所有试验均重复3 次。
2 结果与分析
2.1 发酵工艺单因素试验结果
2.1.1 原料比例对蓝靛果米糠酵素的影响
微生物中的乳酸菌、大肠杆菌、假单胞菌、酵母菌等均能产生GABA,包括乳杆菌在内的LAB 是细菌中GABA 的主要生产者。乳酸菌具有极强的GABA 发酵能力[5],可直接用于食品和医药产业,有望成为生物发酵生产GABA 的最理想菌种。利用乳酸菌发酵米糠具有很高的利用价值,因此本研究采用GABA 含量作为谷物酵素质量品质的重要理化指标;而酸度是衡量酵素成熟度及发酵液品质的主要指标之一[19],发酵液的pH 值变化可反映发酵过程是否正常[20]。蓝靛果米糠酵素发酵过程中pH 值、GABA 含量随原料比例的变化如图1所示,随着蓝靛果比例的增加,GABA含量也逐渐增加,蓝靛果与米糠比例为3∶1 时,GABA 含量达到最大值1.106 g/L,pH 值为4.09;蓝靛果与米糠比例为1∶2 时,GABA 含量最小,为0.278 g/L,pH 值最低,达到3.85。综合考虑GABA 含量与pH 值变化,选取蓝靛果与米糠的最佳配比为3∶1。战伟伟等[21]研究发现,活性物质含量随蓝靛果添加比例的提高而增加,达到一定浓度时,活性物质含量趋于平缓。因此,酵素产品在发酵过程中的发酵速度与原料比例有关,可能是由于不同原料比例所形成的发酵环境有所差别,从而影响发酵。
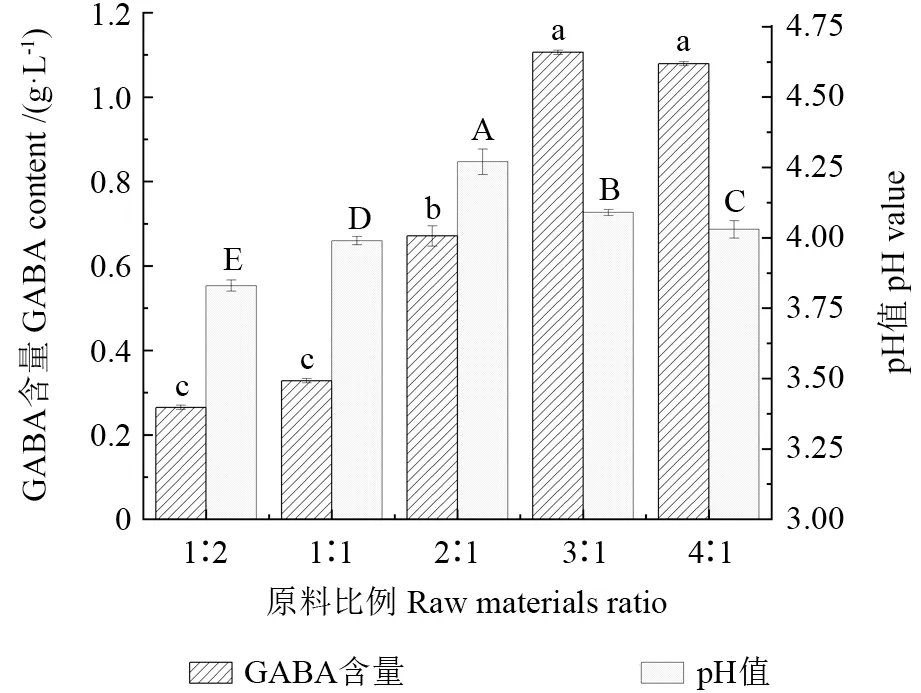
图1 原料比例对蓝靛果米糠酵素GABA 含量和pH 值的影响Fig.1 Effects of raw material ratios on the GABA content and pH value of Lonicera caerulea rice bran enzyme
2.1.2 菌种比例对蓝靛果米糠酵素的影响
蓝靛果米糠酵素发酵过程中pH 值、GABA 含量随菌种比例的变化如图2所示。在复合菌种中,随着植物乳杆菌比例的增加和酿酒酵母比例的减少,蓝靛果米糠酵素的GABA 含量不断上升,当植物乳杆菌与酿酒酵母接种比例达到1∶1 时,GABA 含量达到最高值1.411 g/L,pH 值为最低值4.2。到达最高点后随着植物乳杆菌接种比例的增加以及酿酒酵母接种比例的减少,GABA 含量随之减小,pH 值也随之先增大后减小。综合考虑GABA 含量与pH 值变化,选取植物乳杆菌与酿酒酵母接种比例1∶1 为最佳。高熳熳等[22]研究表明,混菌发酵的糙米酵素比单菌发酵的GABA 含量更高;骆雨雨等[23]研究表明,酿酒酵母和乳酸菌共同发酵有利于保持产品冷藏期间乳酸菌的活菌数的稳定,并且认为菌株之间可能存在共生作用。因此,酵素产品的发酵与菌种比例有关,因为酿酒酵母与乳酸菌之间存在共生作用,有利于活性成分的产生。
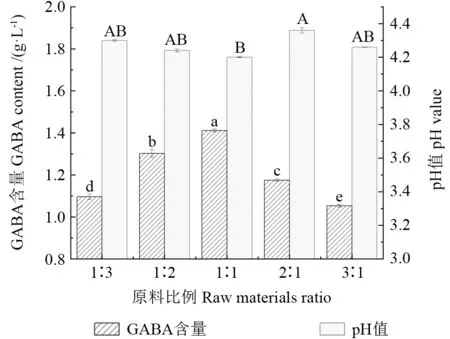
图2 菌种比例对蓝靛果米糠酵素GABA 含量和pH 值的影响Fig.2 Effects of strain ratios on the GABA content and pH value of Lonicera caerulea rice bran enzyme
2.1.3 装液量对蓝靛果米糠酵素的影响
蓝靛果米糠酵素发酵过程中pH 值、GABA 含量随装液量的变化如图3所示。蓝靛果米糠酵素的GABA 的含量随装液量的增加而上升,当装液量到达到66.7%时,GABA 含量达到最高值1.273 g/L,pH 值为4.29。到达最高点后,GABA 的含量随之减小;pH 值随装液量的增加逐渐降低,达到最低值后逐渐增加,当装液量为53.3%时,pH值达到最低值4.24,到达最低点后,pH值随之增大。综合考虑GABA 含量与pH 值变化,选取最佳装液量为66.7%。Bartle 等[24]研究表明,酵母菌与乳酸菌在共培养时会通过以氨基酸为主的营养代谢物质交换来维持自身或对方成长,除营养代谢产物交换以外,酵母或乳酸菌还可以分泌一些代谢产物直接促进或抑制另一微生物生长或代谢,生物量水平也随之发生变化。蓝靛果米糠酵素的发酵与装液量有关,分析其原因为装液量小于最佳装液量时,随着装液量的增加,体系含氧量降低,植物乳杆菌与酿酒酵母的无氧呼吸比例增加,生物量也随之增加;当装液量大于最佳装液量时,单位质量的米糠所能提供的碳源是固定的,装液量过多,会影响乳酸菌对米糠的利用,无氧呼吸比例过高时代谢物反而会抑制酵母菌的生长繁殖[25],最终导致生物量下降,从而影响GABA产量。
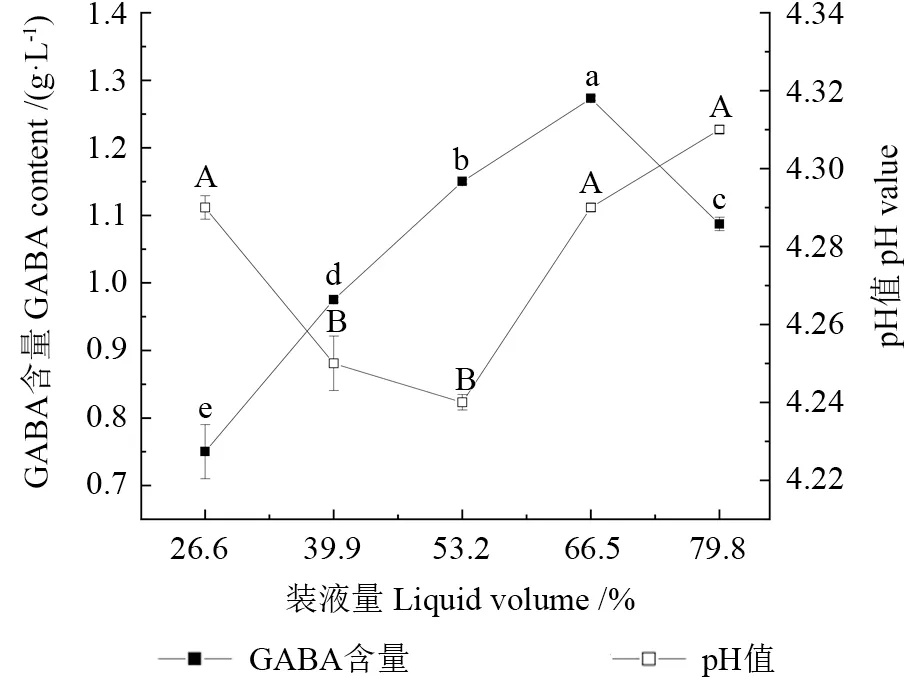
图3 装液量对蓝靛果米糠酵素GABA 含量和pH 值的影响Fig.3 Effects of bottling volume on the GABA content and pH value of Lonicera caerulea rice bran enzyme
2.1.4 温度对蓝靛果米糠酵素的影响
蓝靛果米糠酵素发酵过程中pH 值、GABA含量随温度的变化如图4所示。蓝靛果米糠酵素的GABA 含量随着温度的增加而上升,当温度达到28℃时,GABA 含量达到最高值1.301 g/L,pH 值为4.10。到达最高点后,GABA 含量随温度的增加而逐渐减小,pH 值也随之升高。综合考虑GABA 含量与pH 值变化,温度为28℃时最适合发酵。刘加友[26]研究表明,在一定范围内温度的升高有利于加快酶促反应的速度,从而利于GABA 的积累;温度过高会抑制酵母菌的活性,对原料的利用率也会随之降低[27]。因此,蓝靛果米糠酵素的发酵与温度有关,分析其原因为谷氨酸脱羧酶在较高的温度下被破坏,影响了GABA的生成。

图4 温度对蓝靛果米糠酵素GABA 含量和pH 值的影响Fig.4 Effects of temperature on the GABA content and pH value of Lonicera caerulea rice bran enzyme
2.1.5 发酵时间对蓝靛果米糠酵素的影响
蓝靛果米糠酵素发酵过程中pH 值、GABA 含量随时间的变化如图5所示。蓝靛果米糠酵素的GABA 含量随着时间的增加而上升,当时间达到24 h 时,GABA 含量达到最高值1.640 g/L,pH 值为4.0。随着时间的延长,GABA 的含量下降,pH值随之先升高后降低。综合考虑GABA 含量与pH值变化,选取时间24 h 为最佳。Liao 等[28]研究表明,发酵时间是GABA 积累的重要因素之一,发酵时间太短,谷氨酸钠转化率低,而发酵时间过长,GABA 被乳酸菌代谢利用。黄俊[29]研究表明,发酵前期大量酵母菌等微生物自溶,蛋白质分解导致游离GABA 含量迅速上升。因此,蓝靛果米糠酵素的发酵与时间有关,因为发酵时间过长,GABA 会在GABA-α-氧戊二酸转氨酶的作用下继续被降解,生成琥珀酸半醛。
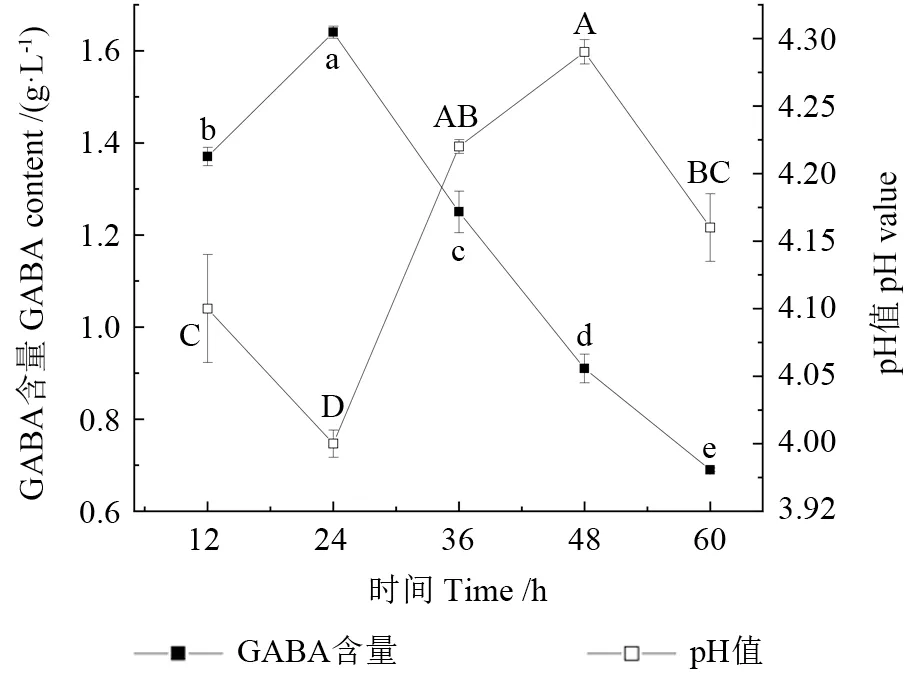
图5 时间对蓝靛果米糠酵素GABA 含量和pH 值的影响Fig.5 Effects of time on the GABA content and pH value of Lonicera caerulea rice bran enzyme
2.2 正交试验结果
由表2 可知,5 个因素的主次关系依次为E >D >B >C >A,即时间对蓝靛果米糠酵素的影响最大,其次依次为温度、菌种比例和装液量,原料比例的影响最小;由表3 可知,装液量、温度和时间对米糠蓝靛果酵素工艺优化均具有极显著影响(P<0.01),菌种比例具有显著影响(P<0.05),原料比例则对发酵工艺无显著影响。比较5 个因素的k值,可得出最优发酵工艺条件为A1B3C3D3E2,即米糠与蓝靛果比例为1∶2,植物乳杆菌与酿酒酵母接种比例为2∶1,装液量为80%,发酵温度为30℃,发酵时间为24 h,该最优组合与正交试验表中的试验3 不符,因此对该最优水平进行验证。通过验证,最优组合下蓝靛果米糠酵素的GABA 含量为2.203 g/L,pH 值为4.19,比试验3 的GABA 含量高。因此最终确定蓝靛果米糠酵素最佳生产工艺条件是米糠与蓝靛果比例为1∶2,菌种比例为1∶1,装液量为240 mL,发酵温度为30℃,发酵时间为24 h。
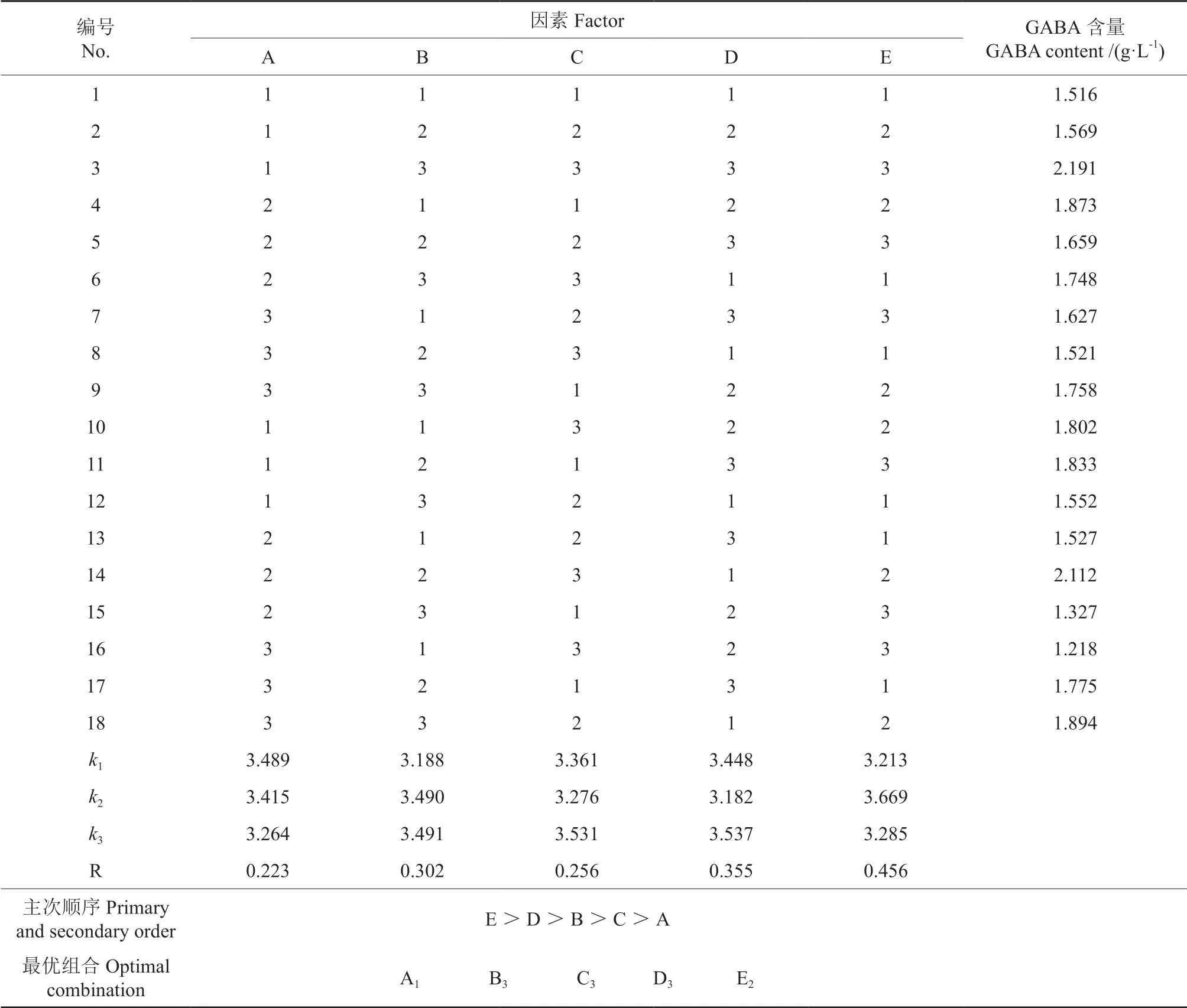
表2 蓝靛果米糠酵素发酵条件优化正交试验结果与分析Table 2 Results and analysis of the orthogonal experiment for the optimization of of Lonicera caerulea rice bran enzyme fermentation conditions
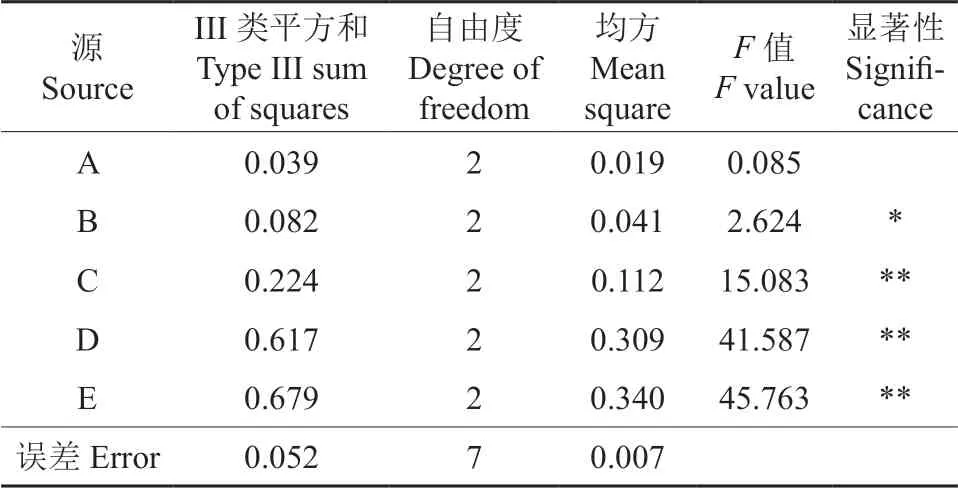
表3 以蓝靛果米糠酵素中GABA 含量为评价指标的方差分析†Table 3 Analysis of variance by using the GABA content in Lonicera caerulea rice bran enzyme
2.3 蓝靛果米糠酵素中代谢产物及抗氧化活性的变化
2.3.1 代谢产物测定结果
对蓝靛果米糠酵素的总酸、总黄酮、总酚和花色苷含量进行测定,结果如表4所示。总酸、总黄酮和总酚含量显著增加(P<0.05),而花色苷含量则显著下降(P<0.05)。总酸含量由(16.038±0.127)g/mL 增加至(35.538±0.943)g/mL, 其原因在于植物乳杆菌在发酵过程中会产生大量的乳酸和乙酸等有机酸。国田等[30]采用3 种方式发酵蓝莓后,酸类物质含量有所增加,这与本研究结果一致。总黄酮含量由发酵前的(0.395±0.013)mg/mL 增加至(0.576±0.025)mg/mL,分析其原因:一方面植物乳杆菌和酵母菌在发酵过程中分泌多种胞外酶,破坏细胞壁的显微结构,促进黄酮的溶出;另一方面微生物自身合成黄酮,导致酵素中黄酮浓度增加[26]。总酚含量由发酵前的(0.158±0.009)mg/mL 增加至(0.517±0.084)mg/mL,Chu 等[31]研究表明发酵过程中微生物会把复杂的大分子酚类物质转换成小分子物质,使酚类含量增加;Ghosh 等[32]研究表明乳酸菌产生的酶类及有机酸使酚类物质溶出并呈游离态,导致发酵过程中总酚含量上升,因此原料与发酵体系中微生物种类共同影响发酵过程中酚类物质的积累,这与叶盼等[33]的研究结果一致。花色苷含量由发酵前的(6.510±0.150)mg/mL 下降至(5.020±0.090)mg/mL,分析其原因为花色苷性质不稳定,在食品加工过程中,部分花色苷会发生降解或者与食品中的酶、糖、单宁等发生反应,转变为大分子衍生物[34]。研究表明β-葡萄糖苷酶会将花色苷分子水解为糖基和花色素,从而使得花色苷含量下降,这与本试验的结果一致[35]。
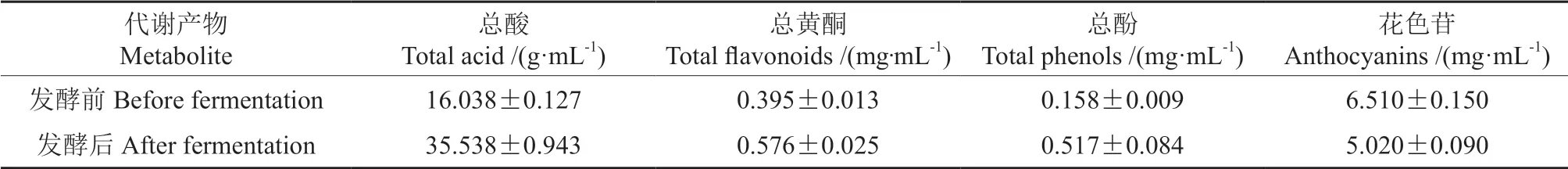
表4 蓝靛果米糠酵素代谢产物的分析测定Table 4 Analysis and determination of enzyme metabolites of Lonicera caerulea rice bran enzyme
2.3.2 蓝靛果米糠酵素中有机酸种类及含量分析
由图6 可知,5 种有机酸的分离效果较好,以各标准有机酸质量浓度X对峰面积Y进行线性回归,如表5所示,5 种有机酸标准曲线呈现良好的线性回归拟合度,R2均高于0.990。
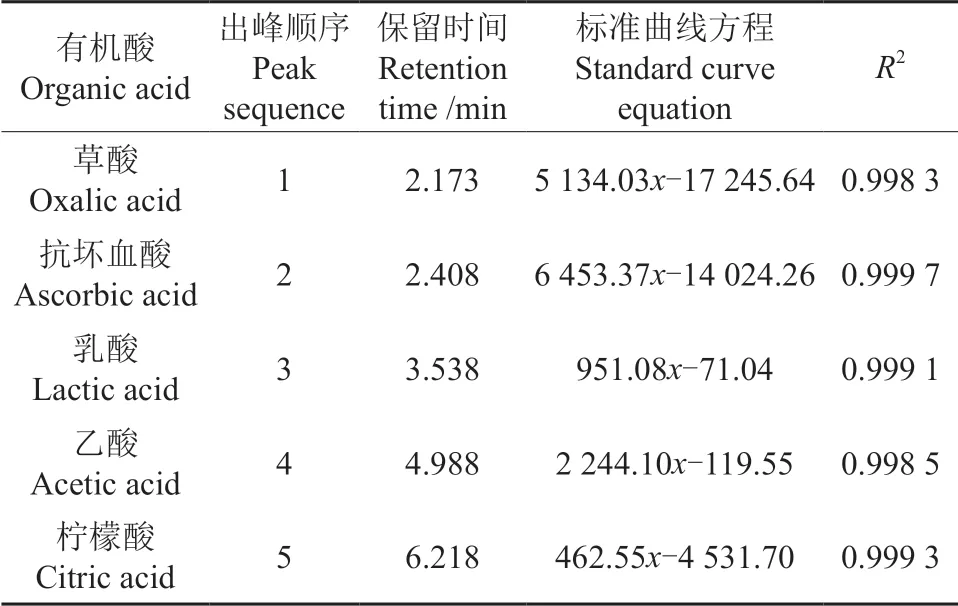
表5 有机酸保留时间及线性关系Table 5 Organic acid retention time and linear relationship

图6 标准有机酸(A)和蓝靛果米糠酵素有机酸(B)HPLC 分离图谱Fig.6 HPLC separation spectrum of standard organic acid(A)and Lonicera caerulea rice bran enzyme organic acid(B)
采用外标法测定蓝靛果米糠酵素中有机酸的种类和含量。经测定得到蓝靛果米糠酵素的有机酸种类和含量分别为:草酸(420.188±34.400)mg/L、抗坏血酸(373.584±49.784)mg/L、乳酸(326.125±17.561)mg/L、乙酸(92.636±4.281)mg/L 和柠檬酸(692.706±29.589)mg/L。其中草酸、柠檬酸和抗坏血酸是蓝靛果原料中最主要的有机酸[36],微生物发酵代谢产生乙酸和乳酸。发酵后蓝靛果米糠酵素的总有机酸含量显著升高(P<0.05),有机酸的累积除了来源于原料中的有机酸溶出,主要由发酵过程中的产酸微生物代谢产生。酵素主要发酵期间,酵母消耗糖原进行糖酵解和三羧酸循环等过程产生大量代谢产物包括酸类、醇类等其他物质,同时生成大量有机酸[37],分析有机酸含量发生变化的原因为微生物发酵代谢引起底物发生转化。
2.3.3 蓝靛果米糠酵素的抗氧化活性分析
如图7所示,蓝靛果米糠酵素的DPPH 自由基清除能力由发酵前的(233.170±13.677)μmol/g 增加至发酵后的(422.479±19.060)μmol/g,研究表明植物乳杆菌可以使黄酮转化为游离的黄酮苷元,而游离的黄酮苷元抗氧化能力更强[38];Seyda 等[39]研究表明酚类物质可提供大量氢离子,共振杂化后使之稳定,从而提高自由基清除能力。ABTS 自由基清除能力由发酵前的(747.574±18.398)μmol/g增加至发酵后的(874.910±14.308)μmol/g,Erel等[40]研究表明,有机酸、维生素和酚类物质具有清除ABTS 自由基的能力,其作用取决于分子质量、芳香环数量和羟基取代基等;Floegel 等[41]研究表明,对于色素含量较高和亲水性原料,ABTS 自由基的抗氧化活性比DPPH 的抗氧化活性效果好。羟基自由基清除能力由发酵前的(165.628±2.776)μmol/g 增加至发酵后的(339.415±10.546)μmol/g。包永春等[42]研究表明,乳酸、苹果酸等有机酸均具有清除羟基自由基的能力,酵母壁上的多糖具有一定的羟基自由基清除能力[43],因此分析其原因为蓝靛果米糠酵素中的有机酸具有自由羟基的酚类物质,A 环或B 环上有多羟基取代或有自由的3-羟基取代的黄酮化合物,因而呈现出自由基清除能力。ABTS 自由基清除能力为酵素中有机酸和多酚等物质的协同作用的结果,而酵母本身含有的活性物质及代谢产生的酶引起蓝靛果和米糠中成分的结构修饰,使其羟基自由基的清除能力得到增强。
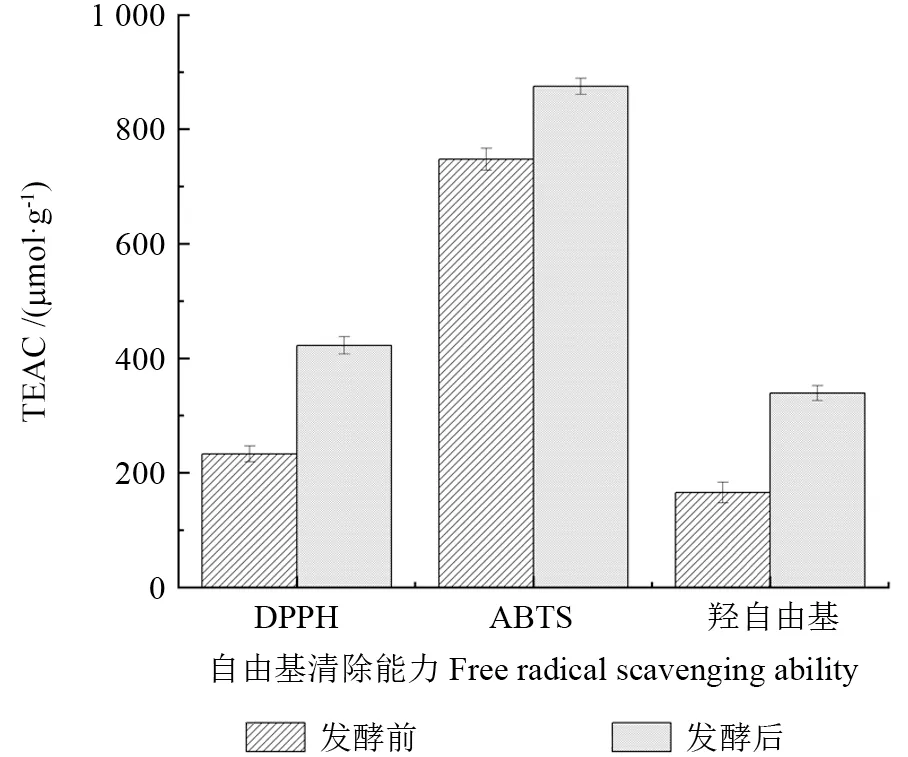
图7 蓝靛果米糠酵素抗氧化能力的变化Fig.7 Changes in the antioxidant capacity of Lonicera caerulea rice bran enzyme
2.3.4 相关性分析
为探究蓝靛果米糠酵素中代谢产物与抗氧化活性的相关性,对酵素中代谢产物与各自由基清除能力进行相关性分析。如表6所示,蓝靛果米糠酵素的自由基清除能力与总酚和总黄酮含量之间呈显著相关性(P<0.05),表明蓝靛果米糠酵素中的总酚及总黄酮具有一定的抗氧化能力。张业芳等[44]研究表明发酵后的猕猴桃样品中DPPH自由基清除率和ABTS 自由基清除率与总酚和黄酮含量显著正相关,抗氧化活性也呈明显的升高趋势;花色苷含量和草酸含量与ABTS 自由基清除能力之间存在显著的相关性(P<0.05),抗坏血酸含量与各自由基清除能力之间存在显著相关性(P<0.05),乙酸含量与DPPH 自由基清除能力之间存在显著相关性(P<0.05)。有机酸含量的升高会导致酵素的抗氧化能力大幅度提升,有机酸在三羧酸循环中的相互转化以及氨基酸的生物合成过程会释放大量的还原氢,还原氢具有抗氧化能力[45]。
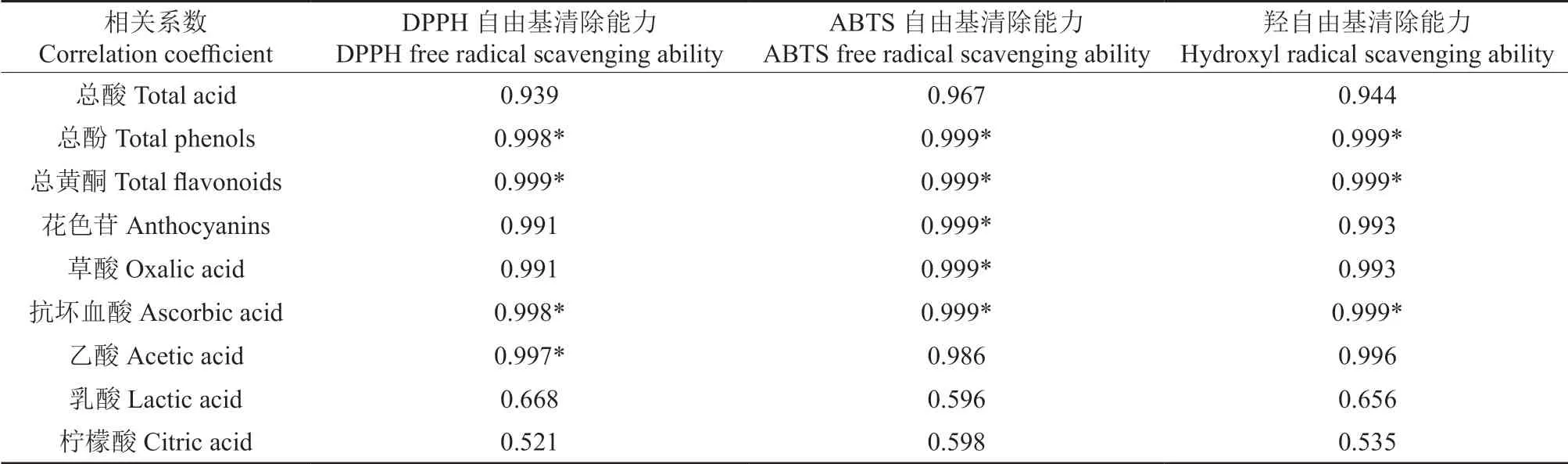
表6 蓝靛果米糠酵素各参数相关性†Table 6 Correlation of various parameters of Lonicera caerulearice bran enzyme
3 讨论
pH 值可以监控果蔬酵素发酵过程是否正常,GABA 含量则可以反映谷物酵素的质量品质。本研究以GABA 含量和pH 值为评价指标,对蓝靛果米糠酵素发酵工艺进行优化,得到最佳发酵工艺条件为:蓝靛果与米糠比例(mL∶mL)为2∶1,植物乳杆菌与酿酒酵母接种比例(%∶%)为2∶1,装液量为80%,发酵温度为30 ℃,发酵时间为24 h,该工艺条件下的γ-氨基丁酸的产量达到最高值2.203 g/L,同时测定了总酸、总酚、总黄酮、花色苷含量、DPPH 自由基清除能力、ABTS 自由基清除率和羟自由基清除率及特征性有机酸的种类和含量,结果表明:发酵结束时pH 值为3.98,总酸质量浓度达到(35.538±0.943)g/mL,总酚质量浓度达到(0.517±0.084)mg/mL,比发酵前的总酚含量提高了2.27 倍;总黄酮质量浓度达到(0.576±0.025)mg/mL,比发酵前的总黄酮含量提高了0.46 倍;花色苷质量浓度达到(5.020±0.090)mg/mL,比发酵前的花色苷含量降低了0.23 倍;DPPH 自由基清除能力达到(422.479±19.060)μmol/g;ABTS 自由基清除能力达到(874.910±14.308)μmol/g;羟自由基清除能力达到(339.415±10.546)μmol/g,抗氧化活性均呈提升的趋势,发酵后其抗氧化活性得到显著提升。
此外,蓝靛果米糠酵素中有机酸种类主要为柠檬酸、抗坏血酸、乙酸、乳酸和草酸。相关性分析结果表明,总酚、总黄酮和抗坏血酸含量与各自由基清除能力之间呈显著相关。代谢产物一直是酵素研究的热点,功能性产物的测定能证明酵素的功效。对于酵素食品而言,代谢目标产物是有功效性能的成分如抗氧化物、功效酶、有机酸等。酵素为混菌发酵食品,发酵菌之间互利共生,使得一些有害产物被重新代谢成利于人体吸收的营养成分。
综上,蓝靛果米糠酵素富含γ-氨基丁酸、有机酸、多酚类化合物、黄酮类化合物、花色苷等活性成分,还具有抗衰老、清除自由基等功效。以上代谢产物不仅丰富了酵素中营养物质的种类及含量,而且它们之间的相关性清晰地反映出发酵过程中营养物质的利用程度及生物活性物质的积累水平。由于本研究尚未深入研究酵素的功效酶活,所以后续仍需要进一步测定酵素中各种活性酶的种类和含量,加以研究代谢产物与功效特性的相关性,为蓝靛果米糠酵素的广泛应用提供相应的理论支持。
4 结论
研究结果表明蓝靛果米糠酵素具有良好的抗氧化性和丰富的有机酸,为具有保健功能酵素产品的加工工艺提供了参考,同时为酵素具有抗氧化功效和促进消化的功效提供了理论依据。通过对蓝靛果米糠酵素的研究,从代谢产物和抗氧化活性的变化等方面论证了高值化利用蓝靛果和米糠的可能性。除此之外,研究酵素中代谢产物和抗氧化活性的相关性对酵素发酵调控、品质控制和营养价值评价至关重要。

