樟叶越桔热激蛋白基因对温度胁迫的响应表达
李 雪,邵亚林,陈海涛,赵 平,丁 勇
(西南林业大学 a.云南省高校林木生物技术重点实验室,云南 昆明 650224;b.西南地区林业生物质资源高效利用国家林业与草原局重点实验室,云南 昆明 650224)
当生物在自然生长过程中遭受外界刺激如温度胁迫后其机体会发生响应、启动保护防御机制,而热激蛋白(Heat shock protein,HSP)则在这一过程中扮演重要角色[1]。多年生木本植物樟叶越桔Vaccinium dunalianum隶属于杜鹃花科Ericaceae 越桔属Vaccinium,主要分布于我国西南地区,国外常见于东南亚等地区[2],目前对该植物的利用仅见于我国云南地区,其鲜嫩叶芽在云南彝族民间可作为保健茶饮用,具祛风除湿、舒筋活络等功效[3],同时植物体内富含的熊果苷及其衍生物类活性物质CA 具有生产天然美白活性剂的潜在价值[4]。樟叶越桔生长适宜温度为(23±2)℃,受全球气候变化影响而产生的局部极端高温(35~40℃)或低温(-10~4℃)等恶劣环境[5]对当地樟叶越桔植物造成了逆境胁迫,这在一定程度上也影响了樟叶越桔野生资源的存量。目前,关于樟叶越桔HSP 及其基因的研究仍处于空白,因此开展樟叶越桔HSP基因在温度胁迫下的表达模式研究,阐明HSP 在樟叶越桔响应温度胁迫过程中的生物学功能和抵抗逆境的分子机制具有重要意义。
HSP 在生物体内广泛存在,主要参与生物体相关蛋白质的折叠、组装和转运等过程,用于维持蛋白质构象和功能的稳定[6]。通常将其分为5 个家族:HSP100、HSP90、HSP70、HSP60 和sHSP,在细胞质、线粒体和叶绿体中均发现有定位,而HSP90、HSP70 和sHSP 还发现定位于内质网中[7]。近年来关于热激蛋白及其相关基因参与逆境调控的研究已是热点话题,且主要集中在HSP90、HSP70 和sHSP 方面。研究表明植物中HSP90 主要参与信号转导、细胞周期控制、蛋白质的降解和运输[8],在植物生长发育和抗逆境的调节和应答等过程中也发挥着重要作用[9]。HSP70 作为分布较广泛、系统进化较保守的一类热激蛋白,发挥多项生理功能,如协助胞内蛋白的转运[10]、参与免疫物质的形成和分解[11]等。sHSP 是一类普遍存在于植物中的小分子热激蛋白,其主要功能是与HSP70 或HSP100 等热激蛋白一起作为分子伴侣,从而使细胞行使正常的功能,sHSP 不仅存在于植物不同生长时期,而且在温度、干旱和盐胁迫等逆境中高度表达[12]。
本试验根据课题组前期研究成果[13-14],从樟叶越桔转录组数据库中(NCBI 登录号:PRJNA285946)筛选获得VdHSP90、VdHSP70、VdsHSP热激蛋白基因和VdARP、VdGAPDH、VdEF-1α候选内参基因cDNA 序列,以樟叶越桔成熟叶片为试验材料,利用RT-qPCR 技术并结合软件BestKeeper、GeNorm、Normfinder 和RefFinder 综合分析3 个候选内参基因的表达稳定性,应用稳定性较好的内参基因为对照计算3 个热激蛋白基因在不同温度(4、25 和35℃)和不同处理时间(1、5、10 和15 d)下的相对表达量,分析樟叶越桔中HSP基因响应不同温度的表达模式,为后续揭示樟叶越桔HSP相关基因表达产物在樟叶越桔响应温度胁迫过程中的生物学功能奠定基础。
1 材料与方法
1.1 材料及试验处理
植物材料樟叶越桔Vaccinium dunalianumWight 为繁育于大棚内的2年生扦插苗,选取长势一致生长良好的苗木104 株于人工气候室中培养2 周,培养条件为:温度25℃,相对湿度60.0%,光照强度400 μmol·m-2·s-1,CO2浓度为400 μmol·mol-1,期间适时浇水。随机取以上预处理后的8 株苗木为试验对照组CK,将剩余苗木分别进行4、25 和35℃试验处理1、5、10 和15 d,各组8 株,人工气候室其他环境条件同上。取样时(8:00—9:00)选取8 株苗木相同部位(形态学上端至形态学下端第4~5 片叶)并做混合处理,13 个叶片组织样本在液氮中速冻后保存于-80℃冰箱,用于总RNA 提取。
1.2 试验方法
1.2.1 总RNA 提取及cDNA 第一链合成
试验样本总RNA 采用康为世纪生物科技有限公司的OminiPlant RNA Kit(DNase I)试剂盒提取,1%琼脂糖凝胶电泳后成像仪(Bio-rad Universal Hood Ⅱ)观察完整性,微量核酸蛋白浓度测定仪NanoDrop 2000(Thermo Scientific ™ NanoDrop ™)检测纯度。cDNA 第一链的合成采用宝生物工程(大连)有限公司反转录试剂盒(PrimeScript ™RT reagent Kit with gDNA Eraser)完成。
1.2.2 引物设计
从樟叶越桔转录组数据库(NCBI 登录号:PRJNA285946)中分析筛选获得3 个候选内参基因(VdARP、VdGAPDH、VdEF-1α)和3 个热激蛋白基因(VdHSP90、VdHSP70、VdsHSP) cDNA 序列,利用Primer Premier 5.0 设计引物(表1),并送至生工生物工程(上海)股份有限公司合成。
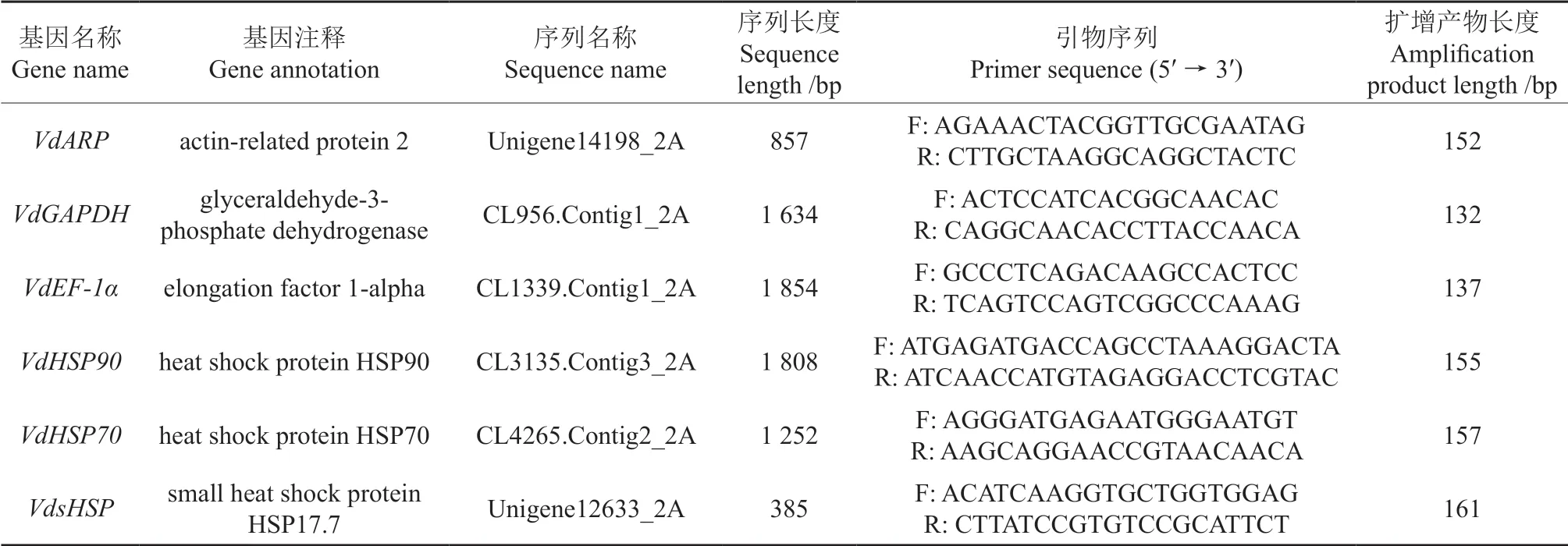
表1 相关基因序列和引物信息Table 1 Primer sequences information of candidate reference genes and target genes
1.2.3 RT-qPCR 扩增
取TB Green Premix Ex Taq II 12.5 μL、cDNA模板2.0 μL、正反引物各1.0 μL、ddH2O 8.5 μL,建立25 μL 的RT-qPCR 反应体系;RT-qPCR 扩增程序为95℃预变性30 s,95℃变性5 s、56℃退火30 s、72℃延伸30 s(共40 个循环),之后溶解阶段反应温度由65℃缓慢升至95℃,升温速度为0.5℃/5 s。每个样本每个基因3 次重复,同时以灭菌超纯水代替cDNA 模板作为阴性对照。以CK样品组的RT-qPCR 检测结果分析内参基因和目的基因引物的特异性。
1.2.4 内参基因稳定性筛选分析
分别利用BestKeeper、GeNorm和Normfinder[15]软件对所选内参基因进行稳定性分析,最后使用RefFinder[16]软件对内参基因的表达稳定性进行综合评价。其中,BestKeeper 分析时利用Ct 值计算出标准偏差(SD),当SD值越小,表明该基因稳定性越好,当SD值大于1 时,说明该基因稳定性较差[17]。GeNorm 和Normfinder 分析时需要将对应的Ct 值转换为相对表达量Q 值[18];GeNorm分析是根据稳定性指数(M),M值越小越稳定,且M值不大于1.5[19];而NormFinder 分析是通过稳定值(S)进行评价,S值越小,说明该内参基因稳定性越高[20]。RefFinder 分析则是整合上述3种分析方法得出综合值,综合值越小,表明内参基因稳定性越好。
1.2.5 目的基因表达分析
RT-qPCR 试验数据中,以VdARP基因为内参,以CK 处理组为对照,采用2-△△Ct方法[21]分析目的基因的相对表达量,后续数据通过SPSS 23.0 软件进行单因素方差分析,采用邓肯氏极差法进行差异显著性检测。
2 结果与分析
2.1 总RNA 提取
本试验中13个樟叶越桔样本总RNA电泳结果如图1所示,显示清晰且较为完整的28 S 和18 S rRNA两条带,浓度范围处于178.5~682.5 ng/µL 之间,A260/A280比值介于1.8~2.2(表2),表明提取的总RNA 质量较高,能够满足后续试验。
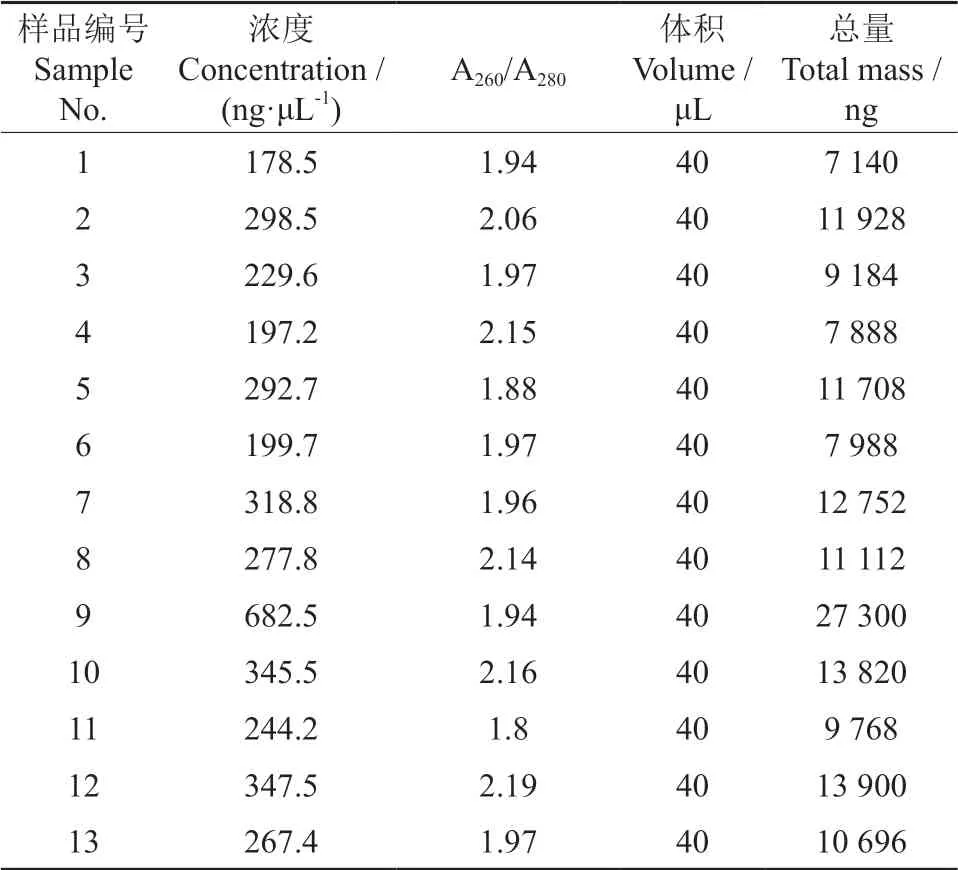
表2 樟叶越桔叶片总 RNA 的纯度和浓度测定结果Table 2 Purity and concentration of total RNA in leaves of Vaccinium dunalianum
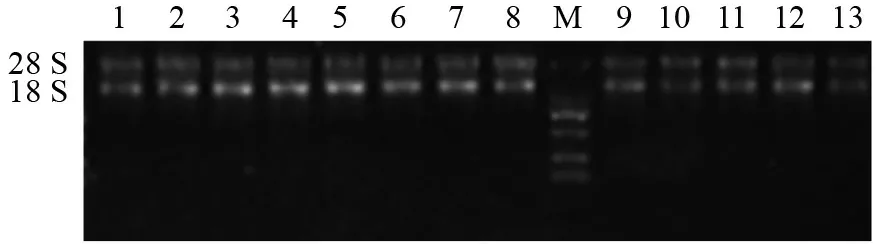
图1 不同温度处理下樟叶越桔叶片总RNAFig.1 The electrophoretogram of total RNA from V.dunalianum leaves under different temperature treatments
M:DL 2000 Marker;1:35℃ 1 d 处理;2:35℃ 5 d 处理;3:35℃ 10 d 处理;4:35℃ 15 d 处理;5:4℃ 1 d 处理;6:4℃ 5 d 处理;7:4℃ 10 d处理;8;4℃ 15 d 处理;9:25℃ 0 d 处理;10:25℃ 1 d 处理;11:25℃ 5 d 处理;12:25℃ 10 d处理;13:25℃ 15 d 处理。
2.2 内参基因和目的基因引物特异性检测
通过将提取的总RNA(标准浓度100 ng/µL)反转录成cDNA,采用表1 引物进行RT-PCR 扩增检测内参基因和目的基因产物特异性,同时以cDNA 为模板进行RT-qPCR 试验,如图2 结果所示,内参基因和目的基因对应的溶解曲线平稳,均呈现单一峰型,且每个基因复孔之间重复性好,表明所设计的引物特异性强高,试验结果可靠性高。
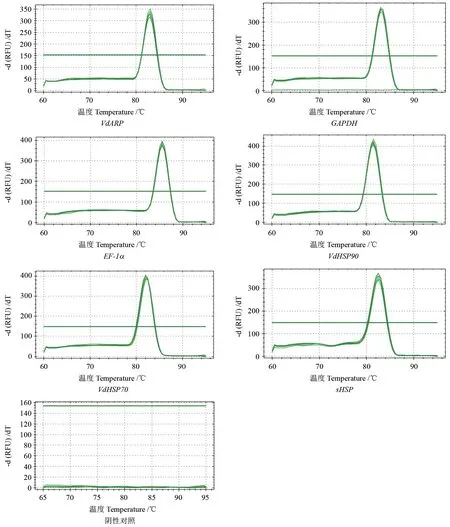
图2 樟叶越桔内参基因和目的基因溶解曲线Fig.2 Melting curves of candidate reference genes and target HSP genes of V.dunalianum
2.3 内参基因表达稳定性分析
根据内参基因稳定性分析软件BestKeeper、GeNorm、Normfinder 和RefFinder 对所选内参基因筛选的结果如表3所示,候选的3 个樟叶越桔内参基因表达稳定性高低顺序用BestKeeper 软件分析显示VdEF-1α>VdGAPDH>VdARP,用GeNorm 软件分析显示VdARP=VdGAPDH>VdEF-1α,用NormFinder 软件分析显示VdARP>VdGAPDH>VdEF-1α, 通过RefFinder 综合分析可得,3 个内参基因稳定性排序为:VdARP>VdGAPDH>VdEF-1α。因此本试验综合评价将VdARP作为首选内参基因,用于标定后续热激蛋白目的基因的表达。

表3 不同软件分析3 个内参基因的表达稳定性Table 3 Expression stability analysis of three candidate reference genes by different softwares
2.4 目的基因的表达分析
2.4.1 VdHSP90基因的表达分析
选择上述VdARP作为内参基因反映VdHSP90基因的表达情况,由图3 可以看出,每个样本中VdHSP90基因均有表达。25 ℃各处理组中VdHSP90基因表达量相比CK 组均显著上调(P<0.05),但除1 d 外,其他(5、10 和15 d)处理组的基因表达量无显著差异,这表明在正常适温生长环境下VdHSP90基因表达表现出整体趋于稳定的变化幅度。VdHSP90基因在4℃各处理组的表达量相比CK 均显著增加(P<0.05),10 d 时表达量为最高值,是CK 组的9.0 倍。35℃处理下VdHSP90基因表达量随时间延长先逐渐上升后逐渐下降,除15 d 处理组与CK 无显著差异外,其他各处理组均显著高于CK(P<0.05),5 d 处理组为最高表达量,为CK 的3.3 倍。在1、5 和10 d 时,4℃处理VdHSP90基因表达量均显著高于25℃和35℃处理组(P<0.05),15 d 时4℃处理VdHSP90基因表达量与25℃处理组无显著差异、但仍显著高于35℃处理组(P<0.05);35℃处理VdHSP90基因表达量在5 和10 d 时分别显著高于25℃处理(P<0.05),但在1 和15 d时却分别显著低于25℃处理(P<0.05)。表明VdHSP90基因对4℃零上低温的响应表达明显强于对35℃高温和25℃适温。
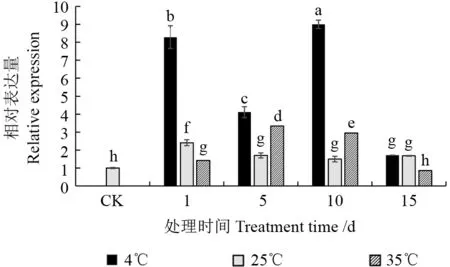
图3 不同温度处理下VdHSP90基因的表达分析Fig.3 The expression analysis of VdHSP90 gene under different temperature treatments
2.4.2 VdHSP70基因的表达分析
VdHSP70基因表达在试验各样本中均能检测到,在25℃处理下,除1 d 处理组表现出上调表达外,其他时间处理组无显著差异,表现出基因表达调控的动态平衡(图4)。4℃处理不同时间的VdHSP70基因表达量先持续显著上升,10 d时达到最大值、为CK 的13.2 倍,15 d 时又急剧下降,但仍显著高于CK(P<0.05);且4℃处理VdHSP70基因表达量显著高于同一时间点的25℃和35℃处理组(P<0.05),表明VdHSP70基因响应4℃零上低温的上调表达剧烈,其表达特征类似于VdHSP90基因。35℃处理下VdHSP70基因表达量表现出类似于4℃处理组的先持续显著上升后急剧下降的变化规律,10 d 时达到最大值、为CK的2.8倍,15 d时急剧下降至CK组表达水平,表明VdHSP70基因对35℃高温胁迫也表现出积极的上调响应表达,但上调表达幅度要低于其对4℃低温胁迫处理的响应。
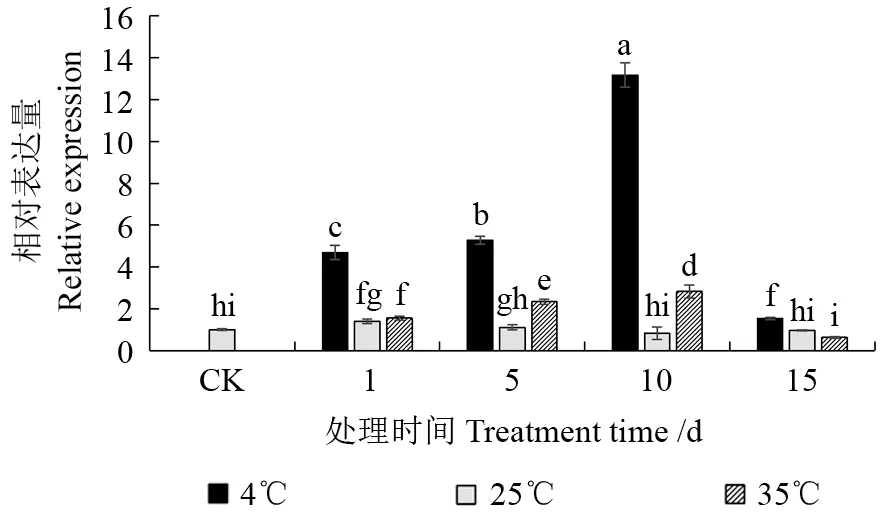
图4 不同温度处理下VdHSP70基因的表达分析Fig.4 The expression analysis of VdHSP70 gene under different temperature treatments
2.4.3 VdsHSP基因的表达分析
由图5 可以看出,25℃各处理组的VdsHSP基因表达量与CK 的无显著差异,均处于同一表达水平。4℃各处理组的VdsHSP基因表达量虽在P<0.05 水平与CK 的差异性不显著,但均低于CK,处于较低的表达水平。35℃各处理组VdsHSP基因表达量均显著高于CK(P<0.05),随时间延长,VdsHSP基因表达量先逐渐上升后下降,10 d时基因表达量最高,为CK 的19 倍。VdsHSP基因表达量在各时间处理组中均呈现35℃>25℃>4℃,且35℃处理组显著高于其他2 个处理组(P<0.05)。表明4℃低温能抑制VdsHSP基因表达,35℃高温诱导VdsHSP基因显著上调表达。
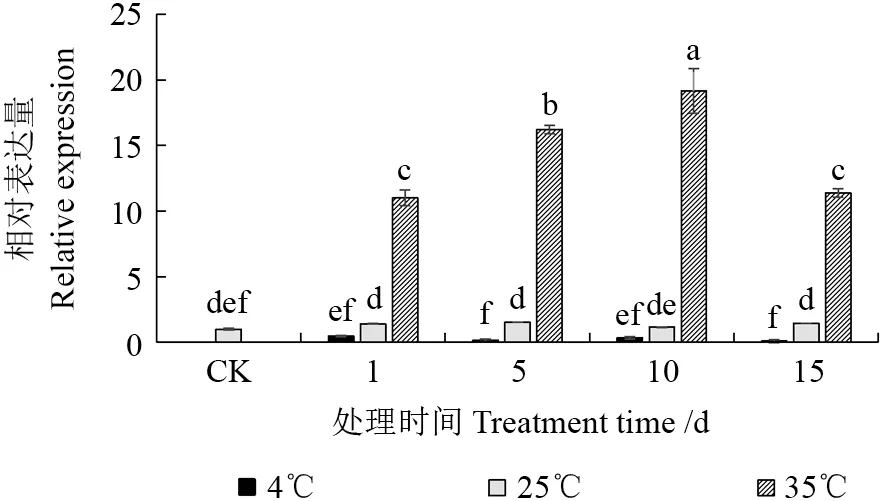
图5 不同温度处理下樟叶越桔VdsHSP基因的表达情况Fig.5 The expression analysis of VdsHSP gene under different temperature treatments
3 结论与讨论
3.1 结论
通过比较3 个内参基因VdARP、VdGAPDH和VdEF-1α的表达稳定性,筛选获得VdARP为不同温度处理下樟叶越桔叶片组织中其他功能基因表达研究首选的内参基因。VdHSP90和VdHSP70基因表达量在4℃低温胁迫处理一定时间内显著上调,VdsHSP基因表达量在35℃高温处理下显著上调,表明VdHSP90和VdHSP70基因对零上低温胁迫的响应表达剧烈,VdsHSP基因对高温胁迫的响应表达剧烈。推测HSP90 和HSP70 蛋白在樟叶越桔植物抵御零上低温胁迫过程中发挥重要功能,而sHSP 蛋白则主要参与了樟叶越桔对高温胁迫的响应过程。
3.2 讨论
RT-qPCR 技术已被广泛应用于功能基因的表达分析,试验材料、试验条件、选用相对稳定的内参基因等对于目的基因的表达显得尤为重要[22]。ACT、GAPDH和EF-1α等看家基因是较为常见、研究较多的内参基因[23],而肌动蛋白相关蛋白(Actin-related protein,ARP)作为内参基因的研究鲜有报道。ARP 和Actin 一样均属于生物细胞的actin 超家族成员,发挥着重要的细胞生物学功能[24],在一些植物中已被证明是组成型表达[25],在樟叶越桔不同组织中的表达也较稳定[13]。本研究应用RT-qPCR 技术比较ARP、GAPDH和EF-1α候选内参基因在不同温度处理下樟叶越桔叶片中的表达稳定性,发现VdARP基因的表达稳定性均优于VdGAPDH和VdEF-1α基因。因此,推测ARP 有望成为一个新型内参基因在更多生物中得以应用。
多数情况下,热激蛋白HSPs 是生物体在受到外界非生物胁迫因子的刺激下产生的高度保守的蛋白家族,一方面能降低不良环境所造成的伤害,另一方面又能提高生物体的耐受能力[26]。研究表明,HSP90、HSP70 和sHSP 家族相关基因在生物抗逆境过程发挥积极作用。Liu 等[27]发现小球藻CvHSP90基因在零上低温胁迫后表达水平显著增加;李慧聪等[28]研究发现,玉米热激蛋白ZmHSP70基因在响应温度胁迫的过程中,4℃冷胁迫能够诱导ZmHSP70基因表达量显著上调,表明ZmHSP70基因可能在参与抵御环境胁迫过程中发挥重要作用;李东宾等[29]运用RT-qPCR 技术分析了铁皮石斛DoHSP70基因在冷胁迫下的表达情况,发现铁皮石斛DoHSP70基因在4℃冷胁迫下被诱导表达,并且在一定时间内表达量维持在较高水平。本研究发现樟叶越桔VdHSP90和VdHSP70基因的表达量在4℃处理下均显著上调,表明VdHSP90和VdHSP70基因对零上低温冷胁迫响应剧烈,再次表明HSP90 和HSP70 蛋白在低温冷胁迫中发挥更重要的调控作用。
sHSP基因则积极参与植物高温热胁迫响应过程。Jung 等[30]通过RT-qPCR 试验表明水稻OsHSP16.9基因在受到热刺激后也能够迅速表达,此外,在水稻中过表达OsHSP16.9转基因植物对逆境胁迫更具有耐受性;陈江飞等[31]研究了茶树多个小分子热激蛋白基因(CsHSP22.4、CsHSP27.4、CsHSP17.5和CsHSP25.2)在高温胁迫下的表达分析,发现4 个小分子热激蛋白基因在高温胁迫下表达量呈爆发式增加,表明其均参与了茶树对高温胁迫的响应过程。本试验也发现樟叶越桔VdsHSP基因在35℃高温处理后的表达量显著增加,且在不同处理时间内均保持高表达水平,可见sHSP基因在不同植物高温热胁迫响应中均发挥重要的调控作用。而sHSP基因响应低温胁迫的表达研究却较少,该研究中4℃处理的VdsHSP基因表达量低于25℃处理并处于较低水平,表明零上低温能抑制樟叶越桔植物中sHSP基因表达,这与辣椒小分子热激蛋白基因CaHSP24的表达受到4℃低温抑制而微量表达[32]的现象相似,也符合sHSP基因表达一直以来被认为与生物的高温胁迫密切相关[33]的观点。本研究对樟叶越桔进行了不同时间阶段下的不同温度处理(4、25和35℃),但是温度设置点较少,仅考虑了零上低温、适温和高温3 个温度点,后期可扩大温度设置点。其次,材料组织仅为叶片,范围较窄,将在樟叶越桔其他组织中展开后续研究。

