基于GEO数据库的脑卒中相关靶点挖掘及与瓜子金皂苷己分子对接研究*
付旭阳,孙健淇,郭 裕,杨淋斐,刘泽儒,贾晓山,孙 玲,崔丽霞,石瑞丽,5,6
(1.包头医学院生理学教研室,内蒙古 包头 014040;2.内蒙古科技大学包头医学院第二附属医院;3.包头医学院乌兰察布临床医学院;4.内蒙古科技大学包头医学院图书馆;5.包头医学院神经科学研究所;6.内蒙古自治区低氧转化医学重点实验室)
脑卒中是由脑血管梗阻或脑血管破裂导致的一系列脑损伤疾病,根据发病原因分为缺血性卒中及出血性卒中,其中缺血性卒中占64.9 %[1]。由于缺血性卒中发病机制复杂,涉及的靶点众多,导致以单一靶点为目标的治疗手段难以达到理想的疗效。近年来,随着组学技术的飞速发展,越来越多的组学实验数据被应用于数据挖掘,从众多组学数据中筛选与脑卒中发生发展密切相关的关键基因,可能为后续抗脑缺血新药开发提供重要依据。瓜子金皂苷己(Polygalasaponin F, PGSF)是从瓜子金中分离得到的齐墩果烷型三萜皂苷单体,既往研究表明,PGSF具有神经保护作用,该化合物可通过抗炎、抗氧化、抗凋亡等多种途径发挥神经保护作用。本课题组前期工作发现 PGSF 能够在整体水平对抗大鼠脑缺血再灌注损伤(Cerebral ischemia-reperfusion injury, CIRI),但其作用机制不够清晰。本研究拟使用基因表达综合数据库(Gene Expression Omnibus, GEO)筛选CIRI中的关键靶点,并通过分子对接工具计算PGSF与关键靶点蛋白的结合能力,从而预测PGSF在治疗CIRI中的作用机制。
1 材料与方法
1.1数据来源 利用GEO数据库(https://www.ncbi.nlm.nih.gov/geo/),以“Cerebral ischemia-reperfusion injury”为检索词,下载GSE97537大鼠脑组织芯片数据集矩阵文件。该数据集内包含假手术对照组,和大鼠中动脉梗死模型组的数据。
1.2方法
1.2.1差异基因筛选及可视化 本研究的基因差异表达分析应用R语言limma包进行。下载R语言limma包,将1.1中下载得到的Count数据导入R语言,以丨LogFC丨≥1与P<0.05 为条件进行差异表达靶点筛选。应用R语言limma包绘制火山图,并对符合丨LogFC丨≥1与P<0.05条件的差异表达基因绘制热图。
1.2.2蛋白-蛋白相互作用分析 脑卒中发病机制复杂,存在多种病理过程,而这些病理过程由多种不同蛋白参与介导。蛋白-蛋白相互作用(Protein-protein interaction, PPI)分析能够挖掘多个蛋白间复杂的作用关系,从而发现药物发挥作用的间接靶点。为了探究差异靶点在疾病发生发展过程中的相互作用,本研究应用STRING数据库进行PPI分析,设定“Multiple proteins”模式,将差异表达靶点导入,下载分析结果。将上述PPI分析结果导入Cytoscape,绘制PPI网络并应用CytoHubba插件根据节点的拓扑参数筛选出其中的关键靶点蛋白。
1.2.3分子对接 为了验证蛋白和PGSF的结合亲和力,利用AutoDock Tools软件(Version 1.5.6)进行蛋白和化合物的修饰,利用AutoDock Vina软件(Version 1.1.2)[2]进行分子对接,得到对接分数结果,之后使用LigPlot软件[3]进行2D可视化处理。
2 结果
2.1差异靶点筛选 应用R语言plot数据包对GSE97537芯片数据表达矩阵进行差异分析,绘制火山图(图1)。筛选得到125个上调基因,12个下调基因。基于Count微阵列数据绘制137个差异表达的靶点热图(图2),总体数据取Log10,并对数据进行标准化处理。

图1 差异基因火山图
2.2蛋白-蛋白相互作用 为明确靶点间的相互作用关系,本研究将137个差异表达的蛋白靶点导入STRING数据库中,获得蛋白-蛋白相互作用关系。应用Cytoscape构建PPI网络(图 3),靶点大小由自由度决定,上调靶点为红色,下调靶点为蓝色。应用CytoHubba根据靶点拓扑参数筛选靶点,排名前五的靶点为:白细胞介素6(Interleukin-6, IL-6)、基质金属蛋白酶9(Matrix Metallopeptidase 9, MMP9)、CC型趋化因子配体2(C-C motif chemokine 2, CCL2)、细胞间黏附分子1(Intercellular adhesion molecule, ICAM1)和前列腺素G/H合酶2(Prostaglandin G/H synthase 2, PTGS2),均为上调靶点。
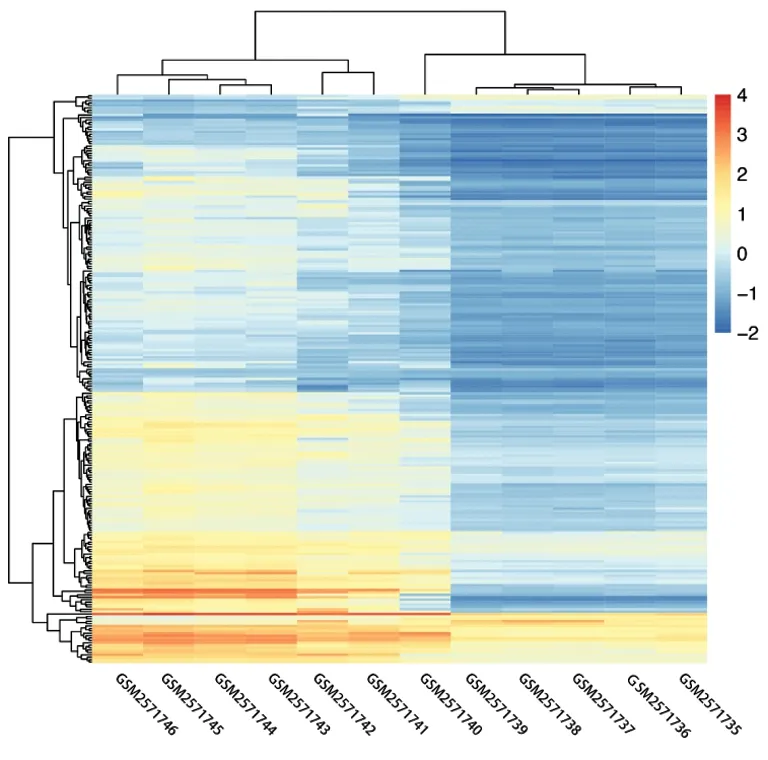
图2 差异基因热图

图3 PPI网络图
2.3分子对接 分子对接中配体与受体构象结合能越低,结合越稳定。将关键靶点蛋白和化合物PGSF进行分子对接(图 4),结果显示PGSF与PTGS2、CCL2等靶点结合能较高(表 1),表明PGSF与关键靶点蛋白有较强的亲和性,PGSF可能通过与其结合发挥抗脑缺血作用。

图4 PGSF和关键靶点蛋白相互作用二维图

表1 瓜子金皂苷己与关键靶点的结合得分
3 讨论
脑卒中是由脑血管供血绝对或相对不足导致的复杂脑损伤疾病。随着缺血时间的延长,脑组织中存在兴奋性毒性、氧化应激反应、血脑屏障破坏、炎症损伤等。由于其发病机制复杂,导致目前尚无能够完全治愈缺血性脑卒中的理想药物。本研究借助生物信息学方法,对组学数据进行分析,筛选得到上调靶点125个,下调靶点12个。应用STRING数据库分析差异表达靶点间的相互作用关系,确定了IL-6、MMP9、CCL2、ICAM1和PTGS2靶点为关键靶点,可应用于疾病的诊断或治疗中。
MMP9作为MMPs家族重要成员,可通过降解基底膜成分,破坏内皮的屏障功能。在中枢神经系统疾病中,炎症反应增加MMP9表达从而破坏了血脑屏障,加重脑水肿[4]。在发病早期,脑水肿程度是影响脑卒中死亡率的重要因素。脑水肿根据病因分为血管源性水肿及细胞毒性水肿,MMP9是血管源性水肿形成的重要成因之一,该蛋白通过上述分子机制促进体液进入脑组织,因此MMP9可作为治疗脑水肿、降低CIRI死亡率的靶点。
脑缺血后的炎症反应是重要的病理过程,介导神经元的早期损伤及后期修复作用。炎症反应是由促炎性前列腺素、细胞因子和趋化因子等因素驱动,这些因素趋化免疫细胞浸入脑组织,并引起急性期反应物的释放[5]。PTGS2和IL-6作为常见的炎性因子,在缺氧脑组织中大量表达,目前已有大量研究证明以PTGS2和IL-6为治疗靶点可明显缓解脑缺血导致的神经损伤[6,7]。此外,炎性因子ICAM-1介导的中性粒细胞黏附在脑卒中的病理生理中起重要作用[8]。在敲除ICAM-1基因小鼠的实验中,白细胞黏附明显减少,同时可改善脑血流量以及脑缺血和再灌注后的死亡率[9]。临床研究表明,大脑中的ICAM-1表达在缺血性卒中后显著升高,可溶性ICAM-1和脑脊液ICAM-1的循环水平同样增加,且血清中ICAM-1表达水平与神经功能损伤程度相关[10,11]。所有上述研究表明,ICAM-1可能参与了缺血性中风的发病机制。
CCL2是一种趋化因子,其受体是CC型趋化因子受体2(C-C chemokine receptor type 2, CCR2)。在脑组织中,CCL2生理状态下表达量极低,在脑缺血发生后,其表达量明显增加。CCL2不仅具有趋化单核细胞作用,还能够激活小胶质细胞从而加重炎症反应。在敲除CCL2的实验中,动物脑梗死体积明显降低,证明降低CCL2表达可作为治疗CIRI的途径之一[12]。
瓜子金皂苷己是由远志科远志属植物瓜子金中提取的齐墩果烷型三萜皂苷类化合物。在神经保护方面,PGSF可抑制脂多糖(Lipopolysaccharide,LPS)诱导的神经炎症模型中IL-1β的表达,主要的作用机制与下调NLRP3炎性小体及半胱氨酸蛋白酶11的激活相关[13]。PGSF还可以通过调节B细胞淋巴瘤/白血病-2(Bcl-2/Bax)表达,起到抗凋亡作用[14]。这些实验证明PGSF在体外实验中具有良好的抑制神经炎症作用,但在整体水平的抗炎作用目前尚未研究。本研究应用分子对接验证了PGSF与IL-6、MMP9、CCL2、ICAM1、PTGS2有良好的结合能力,预测PGSF可能通过CCL2抑制炎性细胞的浸润,降低炎性因子IL-6、ICAM1、PTGS2表达,从而发挥良好的抗炎作用;此外PGSF可能通过降低MMP9抑制血脑屏障破坏,缓解脑水肿程度。本研究为PGSF发挥抗炎、神经保护作用的机制研究奠定了基础,为后续的研究提供了理论线索。

