内质网应激预处理保护大鼠肝脏缺血再灌注损伤机制研究
周倜 蓝海斌 马遥 朱剑 高山*
肝脏缺血再灌注(ischemia reperfusion,I/R)损伤是肝脏外科手术以及肝脏移植中经常遇到的问题。预处理是一种有效的降低肝脏I/R 损伤的方法,在损伤发生前,通过短时间的缺血或低剂量的药物等低强度刺激,诱导肝细胞的应激,以获得抵御高强度缺血缺氧的能力。研究表明,在细胞受到因缺血缺氧等因素刺激时,会影响蛋白的正常表达和修饰,导致未折叠蛋白在内质网腔内的聚集,引起细胞的内质网应激(endoplasmic reticulum stress,ER stress),细胞发生内质网应激的过程中,能够启动未折叠蛋白反应(unfolded protein response,UPR)来使细胞适应外界应激刺激,恢复细胞内环境稳定以及细胞的正常功能[1]。本研究旨在通过药物预处理诱导大鼠肝脏的内质网应激,观察其对大鼠肝脏I/R损伤的保护作用,并探讨其相关机制。
1 材料与方法
1.1 材料 衣霉素(Tunicamycin/TM)购自美国Sigma公司,大鼠GRP78、IRE1α 多克隆抗体及小鼠抗GAPDH 抗体购自美国Santacruz 公司,HRP 标记山羊抗小鼠IgG(H+L)购自上海生工生物技术公司,BCA 蛋白定量试剂盒购自北京康为世纪生物科技有限公司。
1.2 实验动物分组 6 周龄SPF 级雄性Sprague-Dawley(SD)大鼠20 只,体重160~180 g,购自江苏卡文斯实验动物有限公司(许可证号:SCXK(苏)2021-0013)。分笼饲养于标准鼠笼中,5 只/笼,自由饮食,控制温度范围为22℃±2℃,湿度范围为40%~70%,所有动物的饲养及实验均符合实验动物伦理标准。所有动物适应环境1 周后,按照随机数字表法随机分为4 组,每组5 只,其中空白对照组(Vehicle Sham)按体重予0.9%氯化钠溶液(1 mL/100 g)腹腔注射,3 d 后仅行开关腹假手术;TM 对照组(TM Sham)动物予100μg/kg 的衣霉素行腹腔内注射,3 d 后行假手术;I/R 损伤组(Vehicle I/R)按体重予0.9%氯化钠溶液(1 mL/100 g)注射3 d 后行肝脏I/R 损伤手术,TM 预处理组(TM I/R)在行100μg/kg的衣霉素腹腔注射预处理3 d 后行肝脏I/R 损伤处理。
1.3 大鼠缺血再灌注损伤模型的建立 根据文献报道,本实验大鼠I/R 损伤模型采用肝中叶及肝左叶(全肝70%)缺血再灌注的方法,具体操作如下:实验动物于术前1 d 禁食,手术采用10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉,术中乙醚吸入维持麻醉,麻醉成功后,仰卧位固定于操作台,背部垫高以暴露手术视野。碘伏消毒手术区域后,沿腹部正中切口剪开腹腔并向两侧牵开暴露肝脏,首先游离肝周围韧带及肝叶间韧带,将肝中叶及肝左叶向上翻起,暴露出供应肝左叶及肝中叶的肝蒂。对照组(Vehicle Sham 组及TM Sham 组)动物进行至此步骤即停止操作,温盐水纱布覆盖切口4 5 min 后关腹。肝I/R 损伤模组(Vehicle I/R 组及TM I/R 组)用微型血管夹钳夹闭供应肝左叶及肝中叶的肝蒂,随后用温盐水纱布覆盖腹腔切口,阻断肝蒂45 min 后放开血管夹,待观察到缺血肝叶血流重新灌注后,将肝脏小心复位,关腹并消毒切口。肝血流再灌注24 h后,按前述步骤麻醉开腹,取出肝脏标本后处死动物。
1.4 肝脏病理学检查 肝脏标本取出后置于冰上,迅速用眼科剪在肝脏相同位置剪取一小块肝脏组织放入干净的EP 管内保存于液氮中,用于后期蛋白水平检测。其余部分肝脏固定于10%中性福尔马林溶液内。经脱水、包埋、烘干后行苏木精-伊红(hematoxylin-eosin staining,HE)染色。
1.5 血清转氨酶检查 各组动物分别于术前,假手术或I/R 损伤处理后6 h 及12 h 采用断尾取血法采集外周血全血1 mL,放置于4℃冰箱内静置2 h 后,4℃离心5 min(3,000rpm),用移液器吸取上层血清至洁净EP管内,用全自动血生化分析仪测量血清中谷丙转氨酶(Alanine transaminase,ALT)及谷草转氨酶(Alanine transaminase,AST)水平。
1.6 免疫印迹实验 从液氮中取出保存的肝脏组织样本放入研钵内,加入少量液氮后迅速研磨至粉末状,收集组织于离心管内,加入预冷过的裂解液,冰上裂解20 min 后使用超声裂解10 次,再继续冰上裂解10 min,充分裂解后放入4℃离心机离心20 min(12,000 rpm),收集上清液,即为蛋白溶液,BCA 法测定蛋白浓度,调整浓度值10 μg/uL 后分装,采用SDS-PAGE 电泳法电泳后转膜、抗体杂交、显色扫描后使用Alpha 软件处理系统分析目标条带。
1.7 统计学方法 采用 SPSS 25.0 统计软件。计量资料符合正态分布以(±s)表示,采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组动物血清转氨酶水平 结果显示,仅注射0.9%氯化钠溶液的Vehicle Sham 组动物与TM Sham组动物各时间点两种转氨酶水平无显著差异(图1 A、B;P>0.05),两组动物假手术前后转氨酶水平无差异(P>0.05),表明单纯TM 腹腔注射不会造成明显的肝功能损害,是一种较为安全的预处理方式。在行I/R 损伤处理的两组动物中,血清转氨酶检测结果显示(图1C、D):两组动物血清转氨酶水平在I/R 损伤处理后均明显升高,至I/R 损伤后6 h,ALT 及AST 水平升至峰值,但TM I/R 组动物外周血两种转氨酶的水平在I/R 损伤后6 h 均显著低于I/R 对照组(Control)(P<0.05),I/R损伤6 h 后,两组动物血清ALT 及AST 均出现下降,提示肝功能逐渐恢复,至I/R 损伤后12 h,Vehicle I/R 组血清ALT 水平仍明显高于TM 预处理组(P<0.05),I/R损伤后12 h,两组间AST 水平无显著差异(P>0.05)。
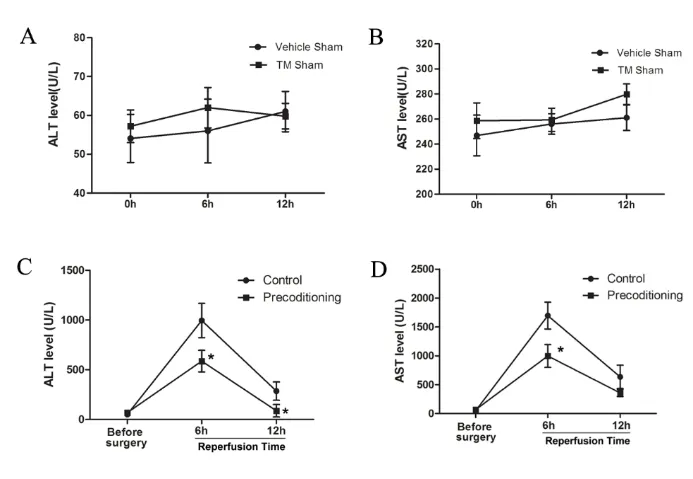
图1 各组动物血清转氨酶水平
2.2 肝脏组织学改变 肝脏标本HE 染色结果显示(见图2),Vehicle Sham 组动物肝脏镜下肝细胞形态正常,大小均匀,排列有序,具有正常的中央静脉结构;TM Sham 组动物肝脏镜下可见肝细胞轻度水肿;Vehicle I/R 组肝脏可见肝组织内充血明显,肝细胞水肿改变,大小不等,排列紊乱,肝细胞片状坏死,汇管区内可见明显的炎细胞浸润; TM I/R 组动物肝脏镜下可见肝细胞间血细胞及少量炎细胞浸润,少量肝细胞坏死,肝小叶结构大致正常。
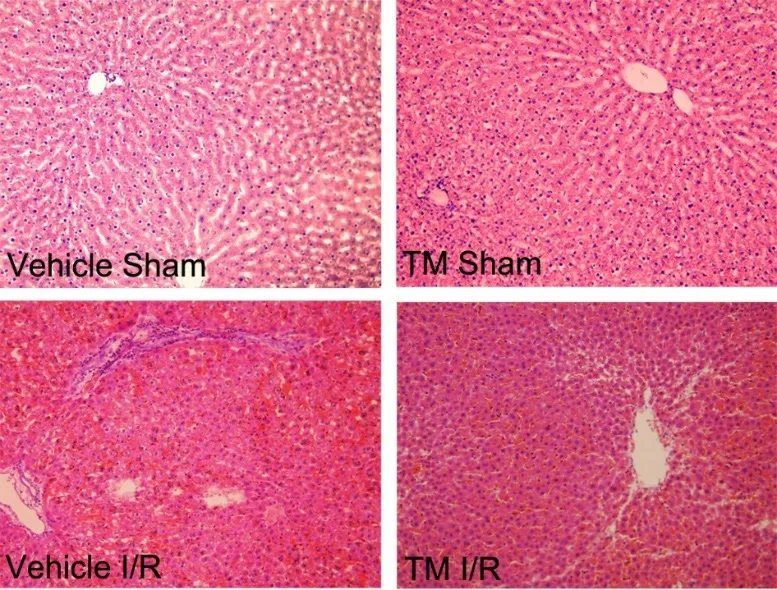
图2 肝脏组织病理(HE ×200)
2.3 内质网应激标志蛋白GRP78 表达水平 结果显示(见图3),Vehicle Sham 组GRP78 水平显著低于其他组,与Vehicle Sham 组相比,TM Sham 组GRP78 的水平显著升高,表明100 μg/kg 剂量的TM 预处理能够引起肝细胞发生明显的内质网应激反应。与Vehicle I/R 组相比,TM I/R 组GRP78 水平升高更为明显(P<0.05)。随后,检测了不同处理后,内质网应激信号分子IRE1α 的激活情况,结果显示,各组动物肝细胞内IRE1α 的水平无显著差异,但各组动物肝细胞内pT-IRE1α 的水平存在显著差异,在肝脏发生I/R 损伤时,肝细胞内pTIRE1α 的水平显著高于空白对照组(P<0.05)。同时,TM I/R 组动物发生I/R 损伤后,其肝细胞内pT-IRE1α的水平显著高于Vehicle I/R 组(P<0.05)。

图3 各组肝组织内质网应激相关蛋白表达水平(*P<0.05)
3 讨论
在肝脏外科手术及肝移植过程中,肝脏I/R 损伤是手术医师经常遇到的问题,常关系到术后肝功能的恢复甚至移植肝的存活。研究表明,肝脏I/R 损伤的病理生理机制主要包括缺血所直接引起细胞缺氧损伤,以及血流再灌注恢复后,肝脏炎性细胞浸润及细胞氧化应激反应所导致的损伤[2]。为减轻手术过程中肝脏I/R 损伤,临床医师探索了众多方法,缺血预处理被认为是目前预防肝脏I/R 损伤较为有效且实用的手段,预处理能够使肝脏可以耐受后期手术中更长时间及强度的I/R[3]。但这一方法也存在诸多限制,近年来,通过药物预处理的方法减轻肝脏I/R 损伤程度正成为研究的热点,通过在术前给予一定剂量的药物处理,以达到减轻术中可能需要长时间肝脏缺血阻断的肝脏I/R 损伤目的[4]。
研究表明,肝脏及多种脏器的I/R 损伤均与内质网应激存在着密切的联系,发生I/R 损伤时,缺血、缺氧、肝脏内自由基以及炎症因子的释放均可导致组织细胞发生内质网应激反应[5-6]。在I/R 发生的早期,缺血缺氧导致肝细胞的蛋白合成功能障碍,大量错误折叠蛋白及未折叠蛋白在内质网腔聚集,这会诱发细胞的未折叠蛋白反应(UPR)以适应这一应激,UPR 能够通过激活一系列细胞内分子通路,减少未折叠蛋白在内质网内的聚集,促进内质网正常功能的恢复[7]。这一特殊的自我保护机制提示可以通过刺激细胞发生内质网应激并诱发UPR 作为减轻I/R 损伤的新策略。
衣霉素是一种特异度的内质网应激诱导药物,能够阻碍新生蛋白在内质网腔内的糖基化修饰,从而引发细胞的内质网应激反应[8]。但目前大多衣霉素诱导的内质网应激模型多在细胞实验中进行,缺少动物体内特异度内质网应激的模型,通过本课题组前期预实验,建立了衣霉素腹腔注射诱导大鼠肝脏内质网应激的模型,在大鼠肝脏I/R 损伤前3 d 给予100 μg/kg 的衣霉素腹腔注射,能够明显减轻I/R 所造成的肝脏损伤。本实验中,各组动物的血清转氨酶水平检测显示,给予100 μg/kg 衣霉素预处理3 d 后,在接受I/R 损伤处理后,与Vehicle I/R 组相比较,TM I/R 组动物术后外周血清中ALT 及AST 水平均明显降低(P<0.05),这一结果说明,在接受衣霉素预处理后,在发生肝脏I/R 损伤时,肝脏损伤程度较轻,预处理对肝脏I/R 起到了保护作用,此外还观察到,与Vehicle Sham 组相比,TM 组动物ALT 及AST 水平虽然表现出一定程度升高,但与Vehicle I/R 相比,这样轻度的损害对肝功能的影响较为轻微,且能够在短时间内恢复正常。术后各组动物的肝脏组织病理学结果也表明,Vehicle I/R 组动物肝脏出现明显的炎细胞浸润,I/R 损伤程度较重,而TM I/R 组动物肝脏组织的炎症反应程度则相对比较轻微。这一结果表明,TM 能够在不显著损伤肝功能的基础上,对肝脏I/R 损伤起到明显的保护作用。
目前研究认为,在细胞内主要有3 条UPR 信号传导通路,分别由存在于细胞内质网膜上的三种跨膜蛋白IRE1α、PERK、以及ATF6 感受和传导,在正常生理状态下,IRE1α、PERK、以及ATF6 与内质网腔内的葡萄糖调节蛋白78(GRP78/Bip)相结合,处于失活状态[9]。在细胞发生内质网应激后,内质网腔内的未折叠蛋白能够与GRP78 相结合,导致GRP78 与IRE1α、PERK、以及ATF6 几种传导分子解离,导致这些感受态蛋白的激活,引起一系列下游信号通路的传导,从而减少错误折叠蛋白在内质网内的聚集。因此,GRP78 常被视为细胞发生UPR 的标志性蛋白[10]。在本实验中,通过免疫印迹的方法检测了不同分组情况下,肝组织细胞的GRP78 表达水平,实验结果表明,空白对照组动物的肝脏组织内GRP78 的表达水平显著低于其他各组(P<0.05),这就说明在正常的生理状态下,GRP78在肝脏组织内的表达量较低。而采取TM 腹腔注射后,笔者观察到肝脏组织内GRP78 的水平显著升高,表明TM 处理能够诱发肝细胞发生比较明显的内质网应激,而这一预处理所诱发的UPR 能够对肝脏I/R 损伤起到较明显的保护作用。
在本实验中,笔者发现在肝脏发生内质网应激及I/R 损伤的过程中,均观察到IRE1α 通路的激活,免疫印迹实验结果表明,IRE1α 的表达水平在各组无明显差异,说明在生理状况下,IRE1α 处于失活的状态,而IRE1α 激活的标志是其发生了磷酸化,通过检测各组肝脏组织标本内磷酸化的IRE1α 水平,Vehicle Sham组的肝脏组织内,磷酸化的IRE1α 水平显著低于其他组,而TM 预处理及I/R 处理均能够引起显著的IRE1α磷酸化水平升高(P<0.05)。同时,还观察到,与I/R 组动物相比,TM I/R 组动物肝脏组织内磷酸化IRE1α 的水平升高更为明显(P<0.05),但TM 组动物肝脏的损伤程度却相对较轻,提示IRE1α 的激活及磷酸化可能与TM 预处理对肝脏I/R 损伤的保护作用相关,这一结果提示TM 预处理所引起的IRE1α 的磷酸化激活可能作为一种保护性机制,减轻了I/R 所致的肝脏损伤。
综上所述,本实验验证了TM 预处理对大鼠肝脏I/R 损伤的保护作用,发现IRE1α 的磷酸化激活可能与内质网应激预处理在肝脏I/R 损伤中的保护作用相关,其下游相关分子通路及调控机制有待进一步深入研究。

