合生元制剂对抗生素诱导肠道紊乱的改善作用
李金星,蒋丰岭,周青青,罗雅亭,王家妮,程如越,沈曦,何方
(四川大学四川大学华西公共卫生学院/四川大学华西第四医院,四川 成都 610041)
人体肠道是一个复杂而庞大的系统,其中栖息着约100亿个微生物,这些微生物的总质量约占人体体重的2.5%。肠道细菌具备多种功能,包括调节代谢、屏障效应和营养功能,因此肠道菌群失调可能对人体健康造成负面影响[1]。肠道菌群、营养物质、宿主细胞相互作用保持肠道内稳态,这是机体生长发育至关重要的过程。
抗生素对各种病原菌感染症具有广泛的治疗作用,近年来儿童抗生素的使用率越来越高,其对肠道菌群的发育和相关代谢过程的影响在公共卫生领域里引起广泛的关注,有待深入研究。头孢曲松属于第三代头孢菌素,是世界卫生组织基本药物标准清单中推荐的卫生系统需要的最安全有效的药物之一[2]。已有研究表明,生命早期头孢曲松暴露会显著损伤肠道上皮组织并影响肠道菌群的构建,对儿童的生长发育可能有一定的潜在危害[3-5]。前期研究表明,头孢曲松能够损伤生命早期小鼠肠道菌群的正常结构,影响肠上皮发育,而益生菌有助于改善其造成的不良影响[6]。
目前针对益生菌改善抗生素诱导的肠道菌群失调的效果,已有研究者提出益生菌可抑制抗生素诱导的肠道菌群失调导致的肠道细菌释放过多脂多糖[7]、改善伴随抗生素诱导的肠道菌群失调出现的肠道短链脂肪酸和胆汁酸异常[8-9],以及缓解抗生素诱导的肠道菌群失调引起的对宿主免疫功能损害[10]等多种可能性。但益生菌对抗生素造成的肠道菌群失调的改善作用相关研究依然偏少,并且存在结论不一致及作用机理不明的现象,因此还有待进一步研究。
本研究选择头孢曲松对4周龄幼年期雄性Balb/c小鼠进行短期干预,观察小鼠体重、脾脏细胞因子、肠道组织结构、肠道菌群及其代谢产物等指标的变化,探究合生元制剂对抗生素引起的肠道菌群失调的改善效果,同时为临床治疗用抗生素诱导的肠道菌群失调提供参考。
1 材料与方法
1.1 实验动物
45只SPF级4周龄雄性Balb/c小鼠:成都达硕实验动物有限公司[生产许可证号:SCXK(川)2014-028]。小鼠饲养于四川大学华西公共卫生学院实验动物中心,适应性喂养3 d,动物房室温(24±2)℃,湿度50%~70%,12 h昼夜节律,饲养期间自由饮食、饮水。
1.2 试剂与材料
头孢曲松:上海阿拉丁生化科技股份有限公司;粪便细菌DNA提取试剂盒:北京天根生化科技有限公司;动物组织RNA提取试剂盒:成都福际生物技术有限公司;合生元制剂:益加生物科技成都有限公司;Mouse Premixed Multi-Analyte Kit:安诺论(北京)生物科技有限公司;Qubit dsDNA HS分析试剂盒:赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 实验动物分组
45只4周龄雄性Balb/c小鼠适应性喂养3 d后随机分为对照组、抗生素组、实验组(n=15/组),第1周实验组每天灌胃200 mg/mL头孢曲松0.2 mL和5×109CFU/mL合生元制剂0.2 mL,以生理盐水作为溶剂,合生元制剂在灌胃抗生素2 h后再灌胃;抗生素组每天灌胃200 mg/mL头孢曲松0.2 mL;对照组灌胃等量生理盐水,小鼠自由摄食摄水3周。
1.3.2 苏木精-伊红(hematoxylin-eosin,HE)染色
实验28 d后处死小鼠后,取小鼠回肠、结肠各1 cm,组织固定液固定,HE染色后观察回结肠结构,在100倍视野下拍照,以100倍比例尺为标准,利用Image-Pro Plus 6.0分别测量每张切片5根完整绒毛的高度(mm)和深度(mm)。
1.3.3 粪便DNA提取
实验结束时收集小鼠粪便。严格按照粪便总DNA提取试剂盒推荐的实验步骤提取小鼠粪便DNA。
1.3.4 脾脏细胞因子mRNA相对表达量测定
采用RNA提取试剂盒提取小鼠脾脏RNA,实验步骤严格按照产品说明书进行。纯化后的RNA在特异性引物的参与下进行实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR),反应条件:98℃预热 30 s,98℃变性 5 s,引物结合和延伸 5 s[白介素-6(interleukin-6,IL-6):55 ℃,IL-10:57.7℃,IL-12:59.5℃,肿瘤坏死因子-α(tumor necrosis factor α,TNF-α):59.5 ℃],从第二步开始循环39次。以β-actin作为内参基因计算脾脏细胞因子mRNA相对表达量。
1.3.5 血清细胞因子测定
实验结束后,眼球采血,血液样品室温(25±5)℃静置2 h后,2 000×g离心20 min,吸取上清液,相同转速二次离心5 min,采用Mouse Premixed Multi-Analyte Kit测定小鼠血清 IL-6、IL-10、IL-12、TNF-a,实验步骤严格按照试剂盒说明书进行。
1.3.6 粪便短链脂肪酸(short-chain fatty acids,SCFAs)测定
实验结束后,采集小鼠粪便,称取100 mg样品,前处理后取上清液上机测定。色谱条件:色谱柱Agilent HP-INNOWAX毛细管柱(30 m×0.25 mm内径×0.25 μm);分流进样,进样量 1 μL,分流比 10 ∶1;进样口温度250℃;载气为氦气,载气流速1.0 mL/min。以乙酸、丙酸、丁酸的标准曲线进行内标法定量计算粪便中SCFAs的含量。
1.3.7 二代测序
聚合酶链式反应(polymerase chain reaction,PCR)扩增粪便细菌DNA后纯化,用琼脂糖凝胶电泳法检测DNA的浓度及纯度。用Qubit试剂盒进行PCR扩增产物定量,检测文库的大小后上机测序,具体实验步骤参考文献[11]并稍作修改。
1.4 统计分析
采用GraphPad Prism 8.0.2统计软件对数据进行统计分析。定量变量采用平均数±标准差的形式描述集中程度和离散趋势,组间比较用方差分析或Wilcoxon秩和检验。以P<0.05为显著性检验水准。
2 结果与分析
2.1 体重和脾脏系数测定结果
头孢曲松处理对小鼠体重和脾脏系数的影响见表1。

表1 小鼠体重和脾脏系数Table 1 Weight and spleen index of tested mice
由表1可知,抗生素组和对照组相比,体重和脾脏系数无明显差异。已有研究发现高剂量的抗生素灌胃会损伤小鼠肠道上皮组织,导致小鼠体重下降,影响宿主的生长发育[11]。另外,使用一次性治疗剂量的抗生素会增加小鼠体重累积的速度,小鼠体重却没有明显增长[12]。然而,长期低剂量抗生素使用会增加肠黏膜的通透性从而导致小鼠的总体重、腹腔和内脏脂肪增加[13]。故头孢曲松对小鼠体重等的影响是可逆的,益生菌制剂能够加快这种恢复过程。
2.2 肠道组织损伤情况
头孢曲松处理对小鼠肠道组织的影响见图1。
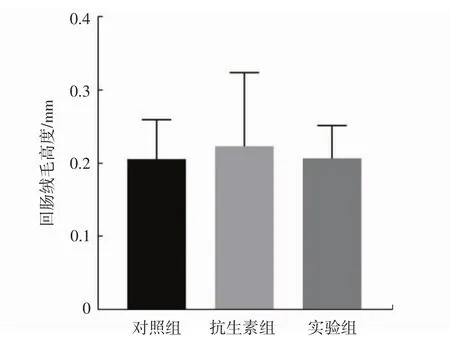
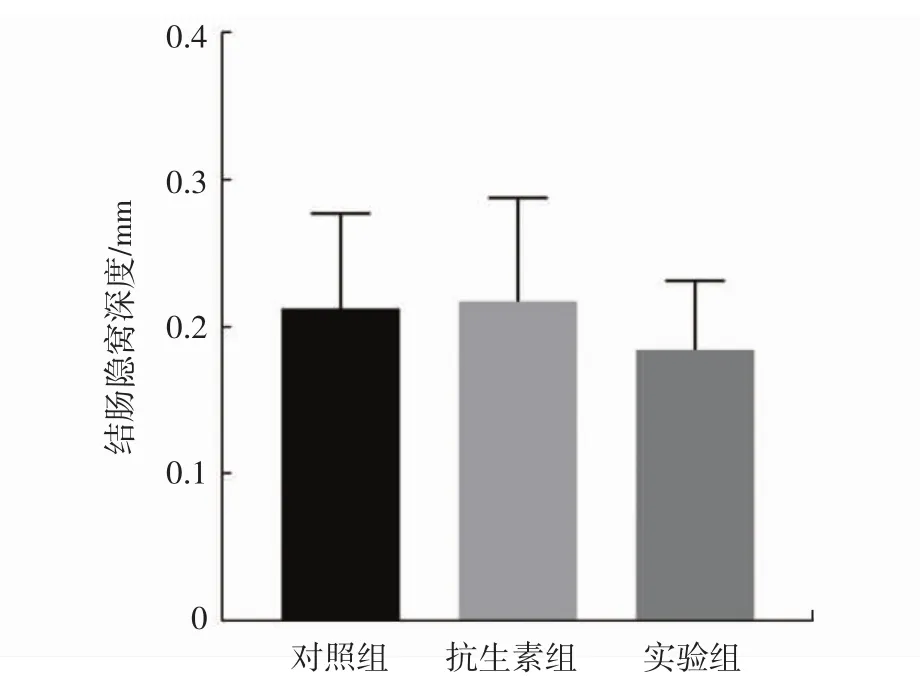
图1 小鼠肠道组织损伤情况Fig.1 Intestinal development of tested mice
由图1可知,停止治疗剂量的抗生素干预后3周,小鼠回肠绒毛高度和结肠隐窝深度差异均无统计学意义,与体重和脏器系数的结果类似。因此,推测治疗剂量的抗生素导致的小鼠肠道组织的损伤在停止干预后可能可以自然恢复。
2.3 脾脏细胞因子mRNA相对表达量
头孢曲松处理对小鼠脾脏细胞因子的影响见表2。

表2 小鼠脾脏细胞因子mRNA表达量Table2 The mRNA expression of cytokines in spleen of tested mice pg/mL
由表2可知,抗生素组和对照组相比,各细胞因子mRNA相对表达量无显著差异。而实验组的IL-6和IL-12的mRNA相对表达量显著低于抗生素组,IL-10表达量显著低于对照组和抗生素组。已有研究发现,益生菌可介导调节宿主免疫功能,发挥抗肥胖、抗糖尿病、抗炎、抗过敏等作用,例如益生菌可特异性地影响或者调节免疫细胞及组织释放各种炎症性细胞因子[14]。表明抗生素对免疫系统无直接影响,而合生元制剂可能有助于降低炎症因子的表达,从而减轻炎症反应。
2.4 血清细胞因子测定
头孢曲松处理对小鼠血清细胞因子的影响见表3。

表3 小鼠血清细胞因子含量Table 3 Serum cytokines of tested mice pg/mL
由表3可知,抗生素组和对照组相比,血清细胞因子含量无明显差异,但实验组的TNF-α含量明显低于对照组。尽管抗生素组和实验组的TNF-α、IL-6、IL-10和IL-12含量的差异无统计学意义,但实验组的细胞因子含量仍低于抗生素组。
抗生素组与对照组各血清细胞因子水平无明显差异,表明短期使用抗生素且停用一段时间后未对小鼠的免疫功能造成显著影响。在使用抗生素的同时补充合生元制剂,可显著降低血清炎症性细胞因子TNF-α的含量,表明该合生元制剂可通过抑制炎症性细胞因子的产生表现出一定的抗炎症性免疫调节作用。
2.5 粪便SCFAs测定
头孢曲松处理对小鼠粪便SCFAs的影响见表4。
由表4可知,抗生素组的乙酸、丙酸和丁酸含量显著高于对照组;而实验组的乙酸、丙酸、丁酸显著低于抗生素组,而与对照组无显著差异。
SCFAs是某些肠道菌群发酵膳食纤维的产物,能够激活在肠内分泌L细胞上表达的特定G蛋白耦联受体从而参与调节能量代谢和肠道屏障功能的肠道肽的分泌,还可以通过抑制组蛋白去乙酰化酶活性来调节基因转录[15]。SCFAs还是肠道上皮细胞的重要能量来源,CHO等[13]发现给刚断乳的C57BL/6J小鼠灌胃亚治疗剂量的青霉素、万古霉素、氯四环素会升高抗生素组小鼠的肠道SCFAs含量,这可能与抗生素摄入升高SCFAs来诱导肥胖表型有关。而PERRIN等[16]给无菌雌性小鼠灌胃亚治疗剂量和治疗剂量的环丙沙星,未观察到组间粪便SCFAs有显著差异,表明抗生素对SCFAs影响可能与抗生素类型、小鼠品系、性别等有关。
本研究发现,使用高剂量的头孢曲松会大量增加SCFAs的产生,与CHO等[13]观察到的趋势一致,表明SCFAs水平并不是越高越好,过高的SCFAs可能对机体健康有不良影响。而同时使用头孢曲松和益生菌制剂的实验组,其SCFAs的产生量恢复至对照组水平,表明本研究使用的益生菌制剂具有缓解头孢曲松等抗生素引起的肠道SCFAs代谢异常的可能性。
2.6 小鼠肠道菌群结构分析
2.6.1 肠道菌群多样性
头孢曲松处理对小鼠肠道菌群alpha多样性的影响见表5。

表5 小鼠肠道菌群alpha多样性指数测定结果Table 5 Alpha diversity of intestinal microbiota of tested mice
由表5可知,抗生素组和实验组的alpha多样性指数 ACE、chao1、shannon 和 PD_whole_tree均显著低于对照组,而实验组的simpson指数也低于对照组。实验组的ACE、chao1和PD_whole_tree指数高于抗生素组,但差异无统计学意义。
头孢曲松处理对小鼠肠道菌群beta多样性的影响见图2。

图2 基于bray_curtis距离的PCoA分析Fig.2 PCoA analysis based on bray-curtis distance
由图2可知,基于bray_curtis距离的PCoA分析可看出各组内聚集性高,组间差异大,PC1具有61.78%的解释度,表明3组之间肠道菌群beta多样性也具有显著差异,且使用抗生素是主要影响因素。
肠道菌群多样性分析和PCoA分析表明,短期使用抗生素会对肠道菌群多样性和群落结构造成影响,且这种影响会持续一段时间,应用合生元制剂对抗生素造成的肠道菌群失调的改善作用并不明显。
2.6.2 肠道菌群群落结构
头孢曲松处理对小鼠肠道菌群群落结构门水平的影响见表6和图3。

表6 小鼠粪便肠道菌群门水平优势菌相对丰度Table 6 Relative richness of primary fecal microbiota in phylum of tested mice
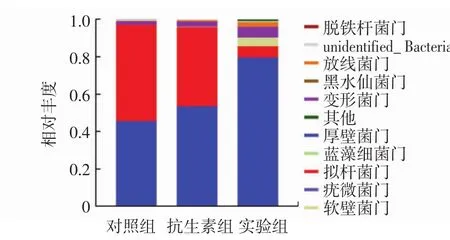
图3 小鼠粪便肠道菌群门水平群落结构Fig.3 Structure of fecal microbiota in phylum of tested mice
由表6和图3可知,在门水平,对照组和抗生素组的厚壁菌门、拟杆菌门、变形菌门和F/B无显著差异;而实验组的厚壁菌门、变形菌门和F/B显著高于对照组和抗生素组,拟杆菌门显著低于对照组和抗生素组。
头孢曲松处理对小鼠肠道菌群群落结构属水平的影响见表7和图4。

表7 小鼠粪便肠道菌群属水平优势菌相对丰度Table 7 Relative richness of primary fecal microbiota in genus of teated mice%

图4 小鼠粪便肠道菌群水平群落结构Fig.4 Structure of fecal microbiota in genus of tested mice
由表7和图4可知,在属水平,抗生素组的拟普雷沃菌属的相对丰度明显低于对照组,而实验组的拟杆菌属、乳杆菌属和拟普雷沃菌属的相对丰度明显低于对照组,不确定的毛螺菌属的相对丰度明显低于抗生素组。
肠道菌群群落结构的结果也进一步提示,在使用抗生素的同时联用合生元制剂对抗生素诱导的肠道菌群失调的改善效果并不明显。在前期对幼年期小鼠进行为期1周的头孢曲松和鼠李糖乳杆菌干预研究中,发现干预结束后第4周实验组乳杆菌属的相对丰度低于空白组和对照组,表明在抗生素紊乱肠道菌群的同时投用益生菌制品可能会干扰益生菌的正常定殖[17]。但是,另外一项研究发现短期使用头孢曲松的同时补充植物乳杆菌PC170似乎不能达到益生菌对肠道菌群紊乱的预期改善效果,而使用抗生素的同时且在停止抗生素干预之后再持续补充益生菌能够更有效地增加肠道菌群的自然恢复速度[18]。除此之外,本研究选用的是合生元制剂,并不是单一的益生菌制剂。研究表明益生元增加双歧杆菌和乳杆菌数量、降低有害病原菌等有益肠道健康作用是某些类别特有的[19],且联合使用益生菌益生元时,有益作用可能会被掩盖[20],这可能是导致其效果并不理想的潜在因素。这些研究表明益生菌的制剂选择和干预方式是影响其对抗生素诱导的肠道菌群失调的改善效果的重要因素之一。
3 结论
肠道屏障由肠道菌群及其产物、黏液层、宿主分泌的抗菌物质、上皮组织和皮下免疫组织组成,具有选择透过性,既能有效防止有害微生物和物质进入人体,又能吸收营养物质以供宿主生长发育。抗生素可能通过扰乱肠道菌群的正常结构、破坏肠道上皮细胞、影响宿主免疫系统等方面对宿主的生长发育和远期健康产生危害。
在本研究中,头孢曲松能够显著破坏肠道菌群组成和SCFAs代谢,而对小鼠体重、脾脏脏器系数及肠道上皮组织无显著不良影响。合生元制剂能够调节抗生素诱导的菌群失调小鼠的免疫功能,这种调节可能通过影响SCFAs的合成来实现,而不是通过调节肠道菌群结构。