PCT、CRP、NLR对COPD并发肺部感染患者的诊断价值*
余国庆 孙红 周丽玲 姚婵娟 戴瑾 赵越
慢 性 阻 塞 性 肺 疾 病(chronic obstructive pulmonary disease,COPD),是影响老年人生活质量的常见呼吸系统疾病,其发病率和死亡率是全世界最高疾病之一,主要临床特征为部分可逆的气流阻塞的慢性气管炎和/或肺气肿,肺结构发生改变的同时造成肺实质损伤,导致患者肺部弹性逐渐减弱,进而不能正常回缩[1]。COPD患者年老体弱,气道功能受限,难以抵御外部感染,且免疫功能下降,因此病原菌容易侵入COPD患者,造成的感染以肺部居多[2-3]。COPD患者病情发生变化,肺部感染可使病情迁延难愈,延长住院时间并增加医疗成本,导致分泌物增多加重患者咳嗽、咳痰及呼吸道黏膜水肿充血症状,常导致患者心力衰竭和呼吸衰竭,甚至导致患者死亡[4]。为改善COPD合并肺部感染患者预后并降低死亡率,要做到早期评估、早期干预治疗。目前临床上主要依靠症状判断COPD患者是否合并肺部感染,但文献[5]中报道一些炎症指标对该病的鉴别诊断有参考价值。本文主要研究外周血降钙素原(PCT)、C反应蛋白(CRP)和中性粒细胞/淋巴细胞比值(NLR)在COPD并发肺部感染患者表达情况及三种指标的诊断价值,以期为临床早期诊断提供一定的参考依据,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2019年1月-2020年12月安徽医科大学附属海螺医院呼吸内科收治的100例COPD患者的临床资料。纳入标准:(1)符合文献[6]中华医学会呼吸病学分会慢性阻塞性肺疾病学组制定的《慢性阻塞性肺疾病诊治指南》中COPD的诊断标准;(2)入院前未使用抗生素治疗;(3)肺部感染患者除肺部感染外无其他部位存在感染,非肺部感染者无感染;(4)资料完整。排除标准:(1)合并急性脑梗死;(2)合并严重心、肝、肾等脏器功能不全;(3)伴有明显精神异常;(4)自身免疫性疾病。按照是否合并肺部感染分为肺部感染组(n=39)和非肺部感染组(n=61)。肺部感染组男30例,女9例;年龄63~91岁,平均(77.26±6.89)岁。非肺部感染组男48例,女13例,年龄52~88岁,平均(75.39±6.68)岁。两组性别、年龄比较,差异均无统计学意义(P>0.05)。本研究已获得医院伦理委员会批准同意。
1.2 方法
两组患者均于入院次日清晨空腹抽取静脉血,PCT检测采用罗氏电化学发光分析仪(Cobas E601),试剂采用罗氏原装配套试剂;CRP检测(免疫比浊法)采用罗氏C701全自动生化分析仪,试剂由浙江夸克生物科技有限公司提供;采用迈瑞5180CRP全自动血液分析仪检测白细胞,根据中性粒细胞与淋巴细胞计算NLR,试剂为迈瑞血液分析仪原装配套试剂。所有数据检测均遵照本科室标准作业程序(SOP)文件操作规程,试剂均在有效期内使用,室内质控在控,标本依正常流程送检。
1.3 统计学处理
采用SPSS 16.0统计软件进行数据处理,对所有数据进行单样本K-S检验是否符合正态分布。符合正态分布的计量资料以(±s)表示,比较采用t检验;非正态分布资料以M(P25,P75)表示,采用Mann-WhitneyU秩和检验;并对PCT、CRP、NLR诊断COPD合并肺部感染作ROC曲线分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组PCT、CRP、NLR水平比较
肺部感染组外周血中PCT、CRP及NLR的水平均高于非肺部感染组,差异均有统计学意义(P<0.05),见表 1。
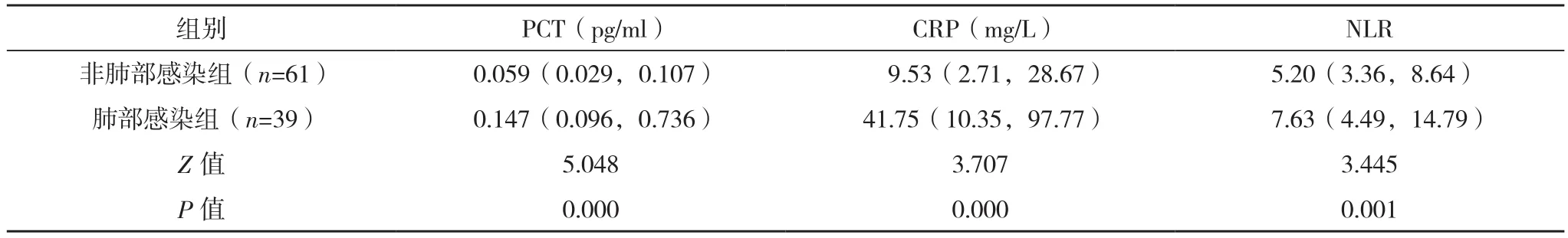
表1 两组PCT、CRP、NLR水平比较[M(P25,P75)]
2.2 ROC曲线分析
检测PCT、CRP、NLR单独诊断COPD合并肺部感染曲线下面积分别为0.800、0.720、0.705;PCT、CRP、NLR联合诊断COPD并发肺部感染的曲线下面积为0.818,PCT、CRP、NLR联合监测预测价值优于单独CRP、NLR、PCT,见表2、图1。

表2 ROC曲线参数
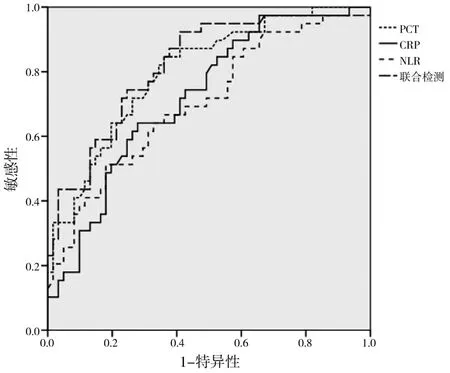
图1 ROC曲线
3 讨论
COPD是老年人群的常见病、多发病,慢阻肺患者因呼吸道病毒、细菌、衣原体等感染及空气污染等诱因易急性加重而成为慢性阻塞性肺疾病急性加重期。急性加重期患者气道伴有中性粒细胞炎性浸润及特异性抗原抗体反应,炎症和临床症状均加重,需要住院治疗[7]。患者气道中性粒细胞浸润及痰液分泌增多,进一步阻塞气道,加重了病情,常导致患者病情恶化合并肺部感染。COPD患者合并肺部感染会导致患者病情更加复杂,使用抗生素的过程中还可能导致细菌的耐药,不仅住院周期延长,而且加重患者经济负担,甚至危及患者生命[8]。同时肺部感染致使炎症物质增加,进而激活单核巨噬细胞系统产生细胞因子,传导细胞信号,而进一步导致C反应蛋白、中性粒细胞等指标的升高[9]。因此COPD患者合并肺部感染的早期发现尤为重要,而PCT、CRP、NLR在监测感染疾病临床意义重大。
PCT主要由甲状腺滤泡旁细胞分泌,小肠和肺中的神经内分泌细胞也有部分分泌,它是一种由116个氨基酸组成的无活性的糖蛋白,经剪切修饰最终形成能调节钙、磷代谢的有活性的降钙素。正常生理状态下机体PCT含量极低,而当机体存在细菌感染特别是革兰阴性杆菌感染时升高显著,特别是在全身性炎症(如脓毒症)升高更为显著[10]。PCT作为判断细菌感染的灵敏指标,不仅能够区分细菌感染和非细菌感染,而且还能反映细菌感染的严重程度。索丹等[11]研究发现慢性阻塞性肺疾病急性加重期患者血清PCT水平升高,而且随着治疗后症状好转,PCT水平显著降低,对COPD患者预后评估有很高的价值。本研究发现COPD患者合并肺部感染患者血清中PCT水平显著高于未合并肺部感染的COPD患者,提示在合并肺部感染后PCT有上升趋势。采用ROC曲线分析,PCT诊断COPD合并肺部感染曲线下面积为0.800,准确性为72.00%。提示在鉴别诊断COPD患者是否存在肺部感染有一定的临床价值和准确度。诊断COPD合并肺部感染患者PCT最佳截断值为0.067 pg/ml,敏感性为84.61%,高于CRP及NLR,特异性为63.93%,诊断的特异性低于CRP和NLR。
CRP是一种急性时相蛋白,当机体处于组织损伤和感染引起的急性炎症时,由白介素-6、白介素-1等细胞因子诱导肝脏产生,同时CRP又能结合相应受体激活巨噬细胞,释放细胞因子扩大炎症反应[12]。CRP在感染性炎症特别是细菌感染性炎症中升高更明显,监测CRP水平对评估COPD患者严重程度及指导抗生素治疗有积极的意义[13]。但CRP诊断感染性疾病缺乏特异性,不能很好地鉴别感染性炎症和非感染性炎症,在一些非感染性炎症如缺血性脑血管病、慢性肾病中也会升高[14]。本文研究结果也显示COPD患者CRP水平升高,且合并肺部感染患者CRP水平显著高于未合并肺部感染组。检测CRP诊断COPD合并肺部感染ROC曲线下面积为0.720,CRP作为COPD合并肺部感染的诊断指标最佳截断值为21.53 mg/L。CRP有一定的诊断价值,但诊断效果弱于PCT,灵敏度低于PCT。
NLR作为一个单独的炎症标志物,近年来备受临床关注,在败血症、脑梗死、子宫肌瘤等疾病都有升高[15]。NLR反映了中性粒细胞和淋巴细胞之间的平衡,当机体出现非感染性或感染性炎症,中性粒细胞升高的同时而抑制免疫系统,致使淋巴细胞下降,NLR整合了两种细胞亚型的作用而作为一个指标,能够比中性粒细胞、淋巴细胞各自的变化更灵敏地反映机体炎症状况。王月平等[4]研究COPD合并肺部感染患者血液指标发现,NLR值在正常对照组最低,未合并感染的COPD患者显著高于正常对照组;而肺部感染组患者NLR值最高,显著高于其他两组。以上结果与本研究一致,非肺部感染组COPD患者的NLR中位数值为5.20,而肺部感染组NLR中位数值为7.63,肺部感染组NLR水平显著高于非肺部感染组。采用ROC曲线分析NLR诊断COPD合并肺部感染价值,NLR曲线下面积为0.705,NLR截断值9.89时,特异性(81.96%)高于PCT和CRP,敏感性仅为51.28%,预测COPD合并肺部感染的发生有一定的价值但灵敏度低。PCT、CRP、NLR三者联合检测,ROC曲线下面积最大,且三者联合检测灵敏度和特异性能互相补充,故建议临床结合多指标进行判别。
综上所述,COPD合并肺部感染患者外周血PCT、CRP、NLR水平显著升高,对诊断COPD合并肺部感染有一定的临床参考价值,且三者联合检测优于单项检测,有助于临床早期发现和治疗。

