血栓通注射液与黄芪注射液的配伍稳定性研究
黄运琦 招丽君 杨妹妹 梁咏梅 刘 洋 梁云飞 兰 星 郑志远 吕林艳
血栓通注射液与黄芪注射液的配伍稳定性研究
黄运琦1,2,3招丽君1,2,3杨妹妹1,2,3梁咏梅1,2,3刘 洋1,2,3梁云飞1,2,3兰 星1,2,3郑志远1,2,3吕林艳1,2,3
(1.广西梧州制药(集团)股份有限公司,广西 梧州 543000;2.广西三七综合利用技术重点实验室,广西 梧州 543000;3.广西药物提纯工程技术研究中心,广西 梧州 543000)
目的:考察血栓通注射液与黄芪注射液的配伍稳定性。方法:将血栓通注射液与黄芪注射液依照临床使用的质量浓度配伍,分别用5%葡萄糖注射液(5%GS)、10%葡萄糖注射液(10%GS)、0.9%氯化钠注射液(0.9%NS)稀释,考察室温下放置0 h、2 h、4 h、6 h、8 h后配伍溶液的性状、pH值、不溶性微粒、渗透压摩尔浓度以及三七总皂苷的含量等关键指标,综合评价药物配伍后稳定性变化。结果:血栓通注射液与黄芪注射液配伍后8 h内性状、pH值、不溶性微粒、渗透压摩尔浓度及三七总皂苷的含量均无明显变化。结论:血栓通注射液与黄芪注射液配伍后8 h内基本稳定。
血栓通注射液;黄芪注射液;葡萄糖注射液;氯化钠注射液;配伍;稳定性
引言
血栓通注射液是由从中药三七中提取的有效活性成分三七总皂苷制成的灭菌溶液,临床用于脑血管疾病包括急性缺血性脑血管疾病、脑血管出血后遗症、瘫痪及视网膜静脉阻塞等的治疗[1]。而黄芪注射液在临床上也广泛应用于循环系统、呼吸系统、泌尿系统及消化系统、免疫系统疾病的治疗,且对心血管药理作用最为显著。二者在临床同时使用的情况比较多,有文献表示与其配伍使用不良反应发生率最高的前3种中药注射剂分别为注射用血栓通、注射用血塞通、舒血宁注射液[2]。依据2020版《中国药典》指导原则9001中注射剂稳定性试验的相关要求及实际用药情况,本研究通过血栓通注射液与黄芪注射液配伍后pH、不溶性微粒、含量变化等关键指标的考察,确定其质量稳定性,为临床安全合理用药提供用药依据。
1 仪器与试药
1.1 仪器
电子天平(型号:XPE205DR,厂家:METTLER TOLEDO);超净工作台(型号:CJ-840,厂家:上海珂淮仪器有限公司);pH计(型号:FE28,厂家:METTLER TOLEDO);渗透压测定仪(型号:OM819.C,厂家:北京雅森博科科学仪器有限公司);智能微粒检测仪(型号:GWJ-16,厂家天津市天大天发科技有限公司);澄明度检测仪(型号:YB-2,厂家:天津市天大天发科技有限公司);Millopore超纯水仪[型号:Mill-Q,厂家:默克集团(Merck KGaA)];高效液相色谱仪[型号:U3000,厂家:赛默飞世尔科技(中国)有限公司]。
1.2 试药
血栓通注射液(广西梧州制药(集团)股份有限公司,规格:2 mL,批号200104);5%葡萄糖注射液(规格:250 mL,批号P20042409,广西裕源药业有限公司;批号E120091801,贵州科伦药业有限公司)、10%葡萄糖注射液(规格:250 mL,批号P19122408,广西裕源药业有限公司;批号E120101607,贵州科伦药业有限公司)、0.9%氯化钠注射液(规格:250 mL,批号P20010306,广西裕源药业有限公司;批号E120101812,贵州科伦药业有限公司)、黄芪注射液(规格10 mL,批号210811D1,神威药业)。
对照品:三七总皂苷对照品(110870-202105,含R19.6%、Rg135.2%、Re4.7%、Rb129%、Rd3.8%)购自中国食品药品检定研究院。
2 方法与结果
2.1 溶液的配制
2.1.1使用0.9%氯化钠注射液作为溶剂
参考药品说明书,考察最大使用浓度,开展相关样品的配制。
配伍溶液A1:取血栓通注射液2支与配伍药品黄芪注射液4支置于500 mL塑料容量瓶中,用相应的稀释液定容至刻度,小心翻转20次,使溶液混合均匀,即得配伍溶液。
对照溶液A1:取配伍药品黄芪注射液4支,置于500 mL塑料容量瓶中,用相应的稀释液定容至刻度,小心翻转20次,使溶液混合均匀,即得对照溶液。
配伍溶液B1:精密量取血栓通注射液10 mL与配伍药品黄芪注射液25 mL置于50 mL容量瓶中,并用0.9%氯化钠定容至刻度,小心翻转20次,使溶液混合均匀,即得配伍溶液。配制完成后于室温条件下在超净工作台中静置,分别于0 h、2 h、4 h、6 h、8 h精密量取1 mL,作为供试品溶液。
三七总皂苷对照品:精密称取5.063 mg对照品粉末,加入甲醇稀释,并定容至20 mL容量瓶,即得对照品溶液,分装于1 mL进样小瓶中,置于-20℃环境保存。
2.1.2使用5%葡萄糖注射液作为溶剂
配制方法同0.9%氯化钠注射液,即得配伍溶液A2、B2,对照溶液A2、三七总皂苷对照品用“2.1.1”项的溶液。
2.1.3使用10%葡萄糖注射液作为溶剂
配制方法同0.9%氯化钠注射液,即得配伍溶液A3、B3,对照溶液A3、三七总皂苷对照品用“2.1.1”项的溶液。
2.2 血栓通注射液与黄芪注射液配伍后性状变化
在拟定的时间点内取“2.1”项下配伍药液,分别在黑色和白色背景下目视,观察配伍液的颜色,是否有气体产生,有无浑浊或沉淀。结果见表1,配伍溶液在8 h内始终保持澄清透明,无气体、沉淀产生,性状较稳定。

表1 血栓通注射液与黄芪注射液配伍后性状变化
2.3 血栓通注射液与黄芪注射液配伍后pH变化测定
在拟定的时间点内取“2.1”项下配伍药液,按照《中国药典》2020年版四部0631项下pH值测定法测定。结果见表2,变化趋势见图1。配伍药液pH值在8 h内无显著变化,稳定性良好。

表2 血栓通注射液与黄芪注射液配伍后的pH

图1 血栓通注射液与黄芪注射液配伍后pH变化趋势
2.4 血栓通注射液与黄芪注射液配伍后渗透压变化测定
在拟定的时间点内取“2.1”项下配伍药液,按照《中国药典》2020年版四部0632项下渗透压摩尔浓度测定法测定,平行测定3次,取均值,结果见表3,变化趋势见图2。渗透压在8 h内保持稳定,无明显变化,说明配伍溶液渗透压较稳定。
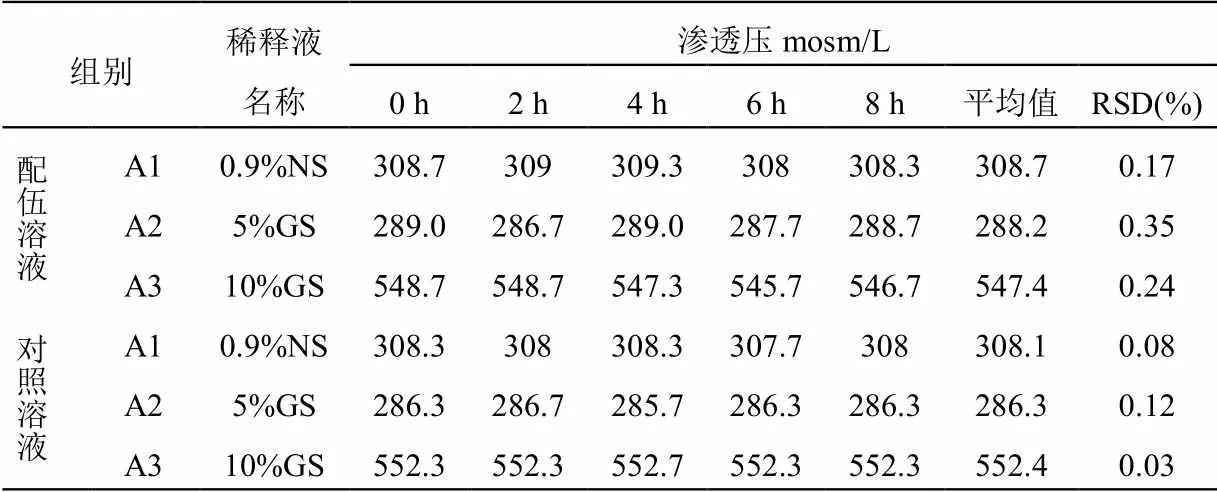
表3 血栓通注射液与黄芪注射液配伍后的渗透压

2.5 血栓通注射液与黄芪注射液配伍后不溶性微粒变化测定
在拟定的时间点内取“2.1”项下配伍药液,按照《中国药典》2020年版四部0903项下不溶性微粒检查法检查平行测定4次,去除第一次测定数据,取后3次的均值,结果见表4,变化趋势见图3。血栓通注射液与黄芪注射液配伍后8 h内,不溶性微粒呈减少趋势,且均符合《中国药典》2020版不溶性微粒显微计数法规定光阻法测定结果“标示装量为100 mL或100 mL以上的静脉用注射液除另有规定外,每1 mL中含10 μm以上的微粒数不得过25粒,含25 μm及25 μm以上的微粒数不得过3粒”。
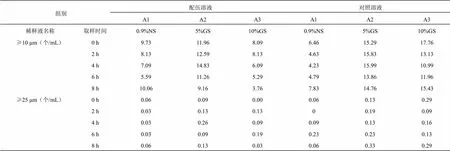
表4 血栓通注射液与黄芪注射液配伍后的不溶性微粒

图3 血栓通注射液与黄芪注射液配伍后不溶性微粒的变化趋势
2.6 血栓通注射液与黄芪注射液配伍后含量变化测定
2.6.1色谱条件和系统适应性试验
色谱柱;以乙腈为流动相A,以水为流动相B,按下表进行梯度洗脱;检测波长为203 nm,流速1 mL/min,波长203 nm,进样体积10 µL。

表5 流动相梯度
2.6.2 对照品溶液的制备
精密称定三七皂苷R1对照品16.60 mg、人参皂苷Rd对照品16.42 mg、人参皂苷Re对照品15.50 mg分别置5 mL容量瓶中,加甲醇至刻度,摇匀;再分别精密量取上述溶液各1 mL及精密称定人参皂苷Rg1 13.30 mg、人参皂苷Rb1 11.21 mg置10 mL容量瓶中,加甲醇至刻度,摇匀,即得三七皂苷R1浓度为0.3001 mg/mL,人参皂苷Rd浓度为0.3025 mg/mL,人参皂苷Re浓度为0.2911 mg/mL,人参皂苷Rg1浓度为1.2502 mg/mL,人参皂苷Rb1浓度为1.0224 mg/mL的单体混合对照溶液。
2.6.3 供试品溶液的制备
取“2.1”项下的配伍溶液B1、B2、B3,即得。
2.6.4 含量测定结果
按照上述高效液相色谱法检测注射用血栓通注射液(冻干)与黄芪注射液配伍后8 h内三七总皂苷的含量变化,结果见表6,变化趋势见图4。注射用血栓通注射液(冻干)与黄芪注射液配伍,在三种稀释剂中主成分含量在8 h内皆RSD值≤2%无显著变化,稳定性良好。

表6 血栓通注射液与黄芪注射液配伍后三七总皂苷的含量

图4 血栓通注射液与黄芪注射液配伍后三七总皂苷含量的变化趋势
3 讨论与分析
本研究结果表明,血栓通注射液与黄芪注射液配伍后药液在8小时内的外观、pH值、渗透压、不溶性微粒及含量变化均无显著变化,理化性质稳定性良好。对于减少中药注射剂的不良反应,笔者有以下几点建议。(1)静脉滴注时应谨慎使用10%GS稀释剂。实验数据表明10%GS稀释剂配制的对照和配伍溶液的渗透压均≥310 mosm/L,属于高渗溶液[3],静脉滴注时具有一定风险。(2)建议在中药注射剂的使用时遵循中医理论[4]。在药物的不良反应方面,有学者整理了2009年至2018年十年中监测到的药物不良反应,发现化学药物不良反应占80%~90%,而中成药只占10%~20%[5]。不良反应中中成药占比低,很大程度上是中医中“整体统一”理论有效实践的结果。
我国对于中药的使用历史悠久,人用经验丰富,但成分复杂,且中医治病遵循“辩证论治”“整体统一”的理论,与之前“组方合理+成分可知+动物试验”的评审理念相冲突,致使以往的中医药行业发展缓慢。针对此困境,我国已经出台系列政策[6,7],给出以“临床价值”为导向的药物创新方向,“中医药理论+人用经验+临床试验”三结合的审评理念,至此中医药发展进入了快车道。作为我国传统文化的一部分,中药一直都有广泛市场空间和民众基础,尤其是在疑难杂病的治疗领域。在2020年爆发的新型冠状病毒肺炎疫情中,血必净注射液等中药注射剂,对于危、重患者在改善患者呼吸困难、降低患者体内炎症因子方面有着明显的效果,被《新型冠状病毒感染的肺炎诊疗方案(试行第七版)》收录[8]。
4 结论
本实验根据临床使用实际情况,以多种关键质量属性作为考察指标,对血栓通注射液与黄芪注射液在8 h内配伍稳定性进行考察,配伍后药液在8 h内的外观、pH值、渗透压、不溶性微粒及含量变化均无显著变化,表明血栓通注射液与黄芪注射液配后理化性质稳定性良好,建议在临床上8 h内使用完毕。
[1]于栋伟,顾琴华,卢恒清,等. 中药注射剂临床安全使用的管理规范[J]. 医药导报,2012,31(7): 962-965.
[2] 易晓霞. 中药注射剂不良反应分析[J]. 实用中医药杂志,2021,37(3): 504-506.
[3] 陆再英,钟南山. 内科学(第7版)[M]. 北京: 人民卫生出版社,2008.
[4] 王焱. 74例中药注射剂不良反应报告分析与探讨[J]. 中药新药与临床药理,2020,43(21): 4347.
[5] 王丹,任经天,董铎,等. 药品不良反应监测年度报告十年趋势分析[J]. 中国药物警戒,2020,17(5): 276-283.
[6] 国务院. 国务院关于改革药品医疗器械审评审批制度的意见[EB/OL]. http://www.gov.cn/zhengce/content/2015-08/18/ content_10101.htm,2015-8-18.
[7] 国家药监局. 国家药监局关于促进中药传承创新发展的实施意见[EB/OL]. http://www.gov.cn/zhengce/zhengceku/ 2020-12/26/content_5573463.htm,2021-12-21.
[8] 国家卫生健康委,国家中医药管理局. 新型冠状病毒肺炎诊疗方案(试行第7版)[J]. 中国医药,2020,15(6): 801-805.
Study on Compatibility Stability of Xueshuantong Injection and Astragalus Injection
Objective: To investigate the compatibility stability of Xueshuantong injection and astragalus injection. Methods: Xueshuantong injection and astragalus injection were diluted with 5% glucose injection (5%GS), 10% glucose injection (10%GS) and 0.9% sodium chloride injection (0.9%NS) according to the mass concentration of clinical use. The properties, pH value, insoluble particles, osmotic molar concentration and the content of total saponins of panax notoginseng were investigated after the compatibility solution was placed at room temperature for 0h, 2h, 4h, 6h and 8h, and the stability of the solution was comprehensively evaluated. Results: The properties, pH value, insoluble particles, osmotic molar concentration and total saponins content of panax notoginseng had no significant changes in 8h after the compatibility of Xueshuantong injection and astragalus injection. Conclusion: Xueshuantong injection and astragalus injection are basically stable within 8h after compatibility.
Xueshuantong injection; astragalus injection; glucose injection; sodium chloride injection; compatibility; stability
F
A
1008-1151(2022)12-0049-05
2022-10-08
梧州市科技计划项目202102011;广西科技基地和人才专项(桂科AD20297068)。
黄运琦(1995-),男,湖南邵阳人,广西梧州制药(集团)股份有限公司助理工程师,研究方向为中药经典名方开发研究及三七综合利用研究。
刘洋(1979-),男,广西藤县人,广西梧州制药(集团)股份有限公司高级工程师,研究方向为药物研发、药物分析研究。
——2017年渗透压相关高考真题赏析

