艾普拉唑肠溶片应用于消化性溃疡患者的临床效果与血清炎性因子指标观察
叶朝华(广东省江门市新会区人民医院,广东 江门 529100)
消化性溃疡是消化系统疾病的一种,该病临床症状主要有恶心呕吐、反酸、上腹部疼痛、嗳气等。近些年,随着人们工作、生活压力的增加,人们的生活及饮食方式均发生一定变化,从而致使消化性溃疡发病率不断提升,对患者日常工作、生活产生严重影响。当前,消化性溃疡临床治疗方式众多,该病治疗的关键在于清除幽门螺旋杆菌、减少胃酸分泌,常用药物为奥美拉唑、呋喃唑酮、克拉霉素等[1]。但是大量临床实践证实,此种治疗方案虽然可有效改善患者病情,但是治愈后易复发。艾普拉唑是质子泵抑制剂的一种,此药具备较长的半衰期,活性持久,受个体间差异影响较小,可对胃酸分泌进行有效抑制,并具备显著的抗Hp感染作用[2]。本次研究对消化性溃疡患者应用艾普拉唑肠溶片治疗的效果作对比分析。
1 资料与方法
1.1 一般资料 选取本院收治的消化性溃疡患者72例(2020年5月-2021年5月),分组方式为抽签分组,每组各36例。对照组男∶女为21∶15,年龄范围21-68岁,平均(44.64±2.76)岁,病程0.3-10.6年,平均(5.38±0.71)年,溃疡位置:十二指肠溃疡14例、胃溃疡17例、复合溃疡5例。观察组男∶女为20∶16,年龄范围22-67岁,平均(44.48±2.81)岁,病程0.4-10.5年,平均(5.29±0.83)年,溃疡位置:十二指肠溃疡13例、胃溃疡19例、复合溃疡4例。两组一般资料基本相同(P>0.05),可对比。
1.2 方法
1.2.1 对照组 应用奥美拉唑肠溶片治疗,20mg/次,2次/d,口服,患者持续治疗4周。
1.2.2 观察组 应用艾普拉唑肠溶片治疗,10mg/次,1次/d,口服,患者持续治疗4周。
1.3 观察指标 ①于治疗前后分别收取两组患者3ml空腹静脉血,离心(3000r/min,15min),应用酶联免疫吸附法对患者IL-17(白细胞介素-17)、IL-10(白细胞介素-10)、NO(一氧化氮)水平进行检测[3]。②比较两组症状改善时间,包含腹痛、反酸消失时间[4]。③记录对比两组不良反应发生状况,包含头晕、腹泻、胃肠胀气、恶心、皮疹[5]。④比较两组临床疗效,分为显效(临床症状改善明显,溃疡面彻底消失,但溃疡周围依然存在炎症)、有效(临床症状减轻与缓解,溃疡面减小超过50%,溃疡周围存在炎症反应)、无效(症状没有改善,甚至恶化,溃疡面减小低于50%)[6]。
1.4 统计学处理 统计分析利用SPSS24.0,t和χ2分别检验计量资料及计数资料,P<0.05说明差异具备统计学意义。
2 结果
2.1 对比治疗前后两组患者血清炎症因子水平 治疗前,两组血清炎症因子水平不具备明显差异(P>0.05);治疗后,两组血清炎症因子(IL-17、IL-10、NO)水平下降,两组对比,观察组更低(P<0.05)。见表1。
表1 两组患者血清炎症因子水平对比(±s)
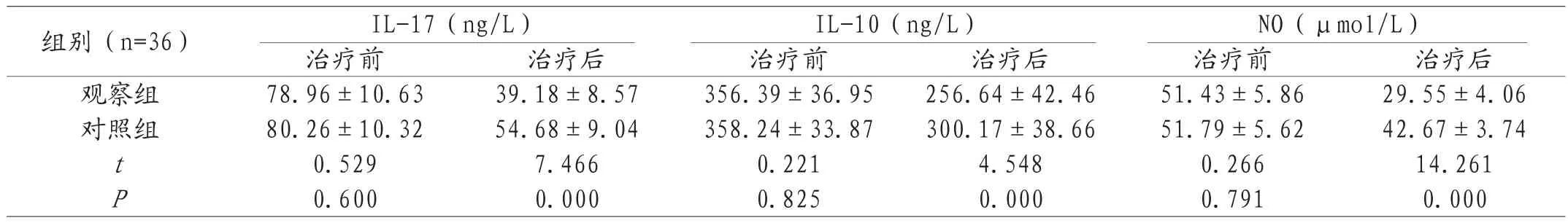
表1 两组患者血清炎症因子水平对比(±s)
组别(n=36) IL-17(ng/L) IL-10(ng/L) NO(μmol/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 78.96±10.63 39.18±8.57 356.39±36.95 256.64±42.46 51.43±5.86 29.55±4.06对照组 80.26±10.32 54.68±9.04 358.24±33.87 300.17±38.66 51.79±5.62 42.67±3.74 t0.529 7.466 0.221 4.548 0.266 14.261 P0.600 0.000 0.825 0.000 0.791 0.000
2.2 对比两组症状改善时间 相较于对照组腹痛、反酸消失时间,观察组明显更短(P<0.05)。见表2。
表2 两组症状改善时间对比(±s,h)
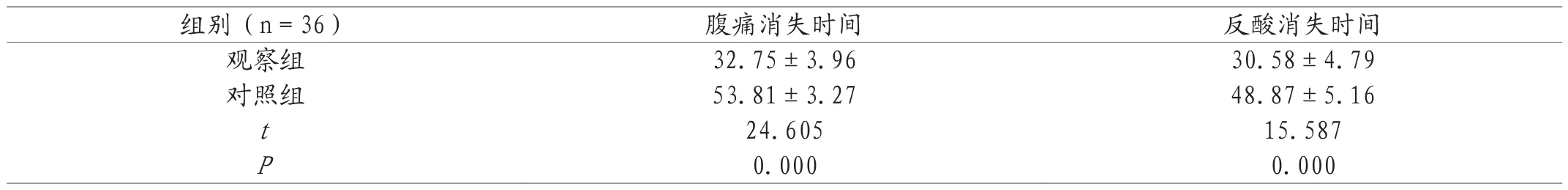
表2 两组症状改善时间对比(±s,h)
组别(n=36) 腹痛消失时间 反酸消失时间观察组 32.75±3.96 30.58±4.79对照组 53.81±3.27 48.87±5.16 t24.605 15.587 P0.000 0.000
2.3 对比两组不良反应发生状况 观察组、对照组不良反应发生率分别为8.33%、11.11%,差异不明显(P>0.05)。见表3。

表3 两组不良反应发生状况对比[n(%)]
2.4 对比两组临床治疗效果 观察组显效∶有效∶无效为19∶16∶1,治疗有效率97.22%(35/36),对照组显效∶有效∶无效为15∶12∶9,治疗有效率75.00%(27/36),观察组更高(P<0.05)。
3 讨论
消化性溃疡是慢性消化道疾病的一种,该病发病原因主要为胃酸分泌过量及Hp感染,该病会对患者日常工作与生活产生严重影响[7]。当前,该病治疗方式有清除幽门螺旋杆菌、减少胃酸分泌量、改善胃黏膜血流、保护胃黏膜等,常用药物有奥美拉唑、呋喃唑酮等[8]。艾普拉唑是质子泵抑制剂的一种,患者服药后,经胃酸分解后为亚磺酰胺,亚磺酰胺结合胃部微环境中-K+、H+、-ATP酶,可对胃酸分泌进行有效抑制,进而阻止胃酸进一步损伤溃疡面。相较于奥美拉唑,艾普拉唑具备更长的半衰期,并且胃酸抑制效果更为理想[9]。
IL-17是由活化CD4+T细胞产生,其致炎作用较强,可刺激局部趋化因子、炎性因子与造血因子产生,而中性粒细胞与趋化因子会促使白细胞聚集,使炎症反应增强;IL-10是抗炎因子的一种,待机体遭受病毒或细菌侵袭时,IL-10水平升高,并产生局部炎症反应;NO为人体不稳定自由基,其通过直接或间接方式参与机体各项病理活动,其水平可对患者溃疡程度与Hp感染程度予以直接反映[10]。本次研究显示,治疗后,两组血清炎症因子(IL-17、IL-10、NO)水平降低,观察组明显低于对照组(P<0.05),表明于消化性溃疡治疗中,奥美拉唑与艾普拉唑均可降低炎症因子水平,减轻患者炎性反应,但艾普拉唑效果优于奥美拉唑。研究显示,与对照组腹痛、反酸消失时间相比,观察组时间明显更短(P<0.05),表明于消化性溃疡治疗中,应用艾普拉唑肠溶片治疗加快患者康复速度。观察组、对照组不良反应发生率分别为8.33%、11.11%,组间差异不明显(P>0.05),表明于消化性溃疡治疗中,奥美拉唑治疗与艾普拉唑肠溶片治疗安全性均较高。相较于对照组治疗有效率(75.00%),观察组(97.22%)明显更高(P<0.05),表明于消化性溃疡治疗中,应用艾普拉唑肠溶片治疗效果理想。
综上所述,于消化性溃疡患者治疗期间,应用艾普拉唑肠溶片治疗效果理想,可减轻炎症反应,改善临床症状,较为安全,值得进一步推广。

