水杨酸对干旱胁迫下桔梗幼苗生理生化指标及相关基因表达的影响
孙晓春, 黄文静, 李铂
(陕西中医药大学陕西中药资源产业化省部共建协同创新中心,陕西省中药基础与新药研究重点实验室,陕西 咸阳 712083)
桔梗(Platycodon grandiflorus(Jacq.)A.DC)为桔梗科多年生草本植物,具有祛痰止咳、抗肿瘤、降血糖等多种药理功效[1-2]。目前,随着桔梗越来越多的药用价值与经济价值被发现,人们对桔梗的需求量逐年增大。干旱已成为影响植物生长的普遍存在的问题。植物通过形态变化、渗透调节物质积累、抗氧化酶活性提高等应答机制来抵御干旱胁迫[3]。叶绿素是植物叶绿体内参与光合作用的物质基础,叶绿素的生物合成由多基因调控。叶绿素酸酯a氧化酶(chlorophyllide a oxygenase,CAO)催化叶绿素酸酯b的形成,叶绿素合酶(chlorophyll synthase,CHLG)催化叶绿素酸酯a、b合成叶绿素 a、b[4]。干旱胁迫下,植物体内的脯氨酸作为渗透调节物质被积累,其含量的升高有利于提高植物对干旱胁迫的抗性。吡咯啉-5-羧酸还原酶(pyrroline-5-carboxylate reductase,P5CR)是广泛存在于原核和真核生物中的重要看家蛋白,其主要功能是在NAD(P)H的作用下,将吡咯啉-5-羧酸(P5C)转化为脯氨酸[5]。过氧化物酶(peroxidase,POD)催化过氧化氢参与各种还原剂的氧化反应[6]。研究表明,添加外源物质可提高植物的抗逆能力[7-8]。水杨酸(salicylic acid,SA)是植物体内的一种小分子酚类物质,能调节植物的生长发育,包括种子萌发、果实成熟、开花、衰老以及对生物和非生物胁迫的防御反应[9]。SA能有效增强紫御谷对干旱、高温的抵抗能力[10]。马乐元等[11]研究表明,外源添加水杨酸能够降低干旱胁迫下小冠花叶片的活性氧水平,提高小冠花叶片抗氧化能力。蒋明敏等[12]研究表明,较低浓度水杨酸可显著提高石蒜的抗旱性,而高浓度则发生毒害作用。
本研究室前期研究表明,20%PEG胁迫下,外源添加水杨酸可提高桔梗叶片中超氧化物歧化酶、过氧化物酶、抗坏血酸过氧化物酶活性及可溶性糖和脯氨酸含量[13]。而不同程度干旱胁迫下,水杨酸对桔梗生理生化指标的影响以及分子机制尚未见报道。因此,本研究以不同浓度PEG6000模拟干旱胁迫,同时外源添加不同浓度水杨酸处理,对不同处理下桔梗叶片和根中叶绿素、丙二醛、渗透调节物质的含量和保护酶活性进行比较;同时检测叶绿素合成相关基因CAO、CHLG、POD和脯氨酸代谢相关基因P5CR表达量的变化,为解析外源SA提高桔梗抗干旱能力的分子机制提供理论依据。
1 材料与方法
1.1 试验材料
桔梗种子购自河北省保定市安国中药材推广站。选取颗粒饱满、大小均一的桔梗种子播种于装有营养土的花盆中,在14 h光照/10 h黑暗、25℃恒温培养,光照强度4 000 lx;培养60 d后,将长势基本一致的桔梗幼苗移栽于装有石英砂的塑料花盆中(口径7 cm,高8 cm),每盆移栽幼苗3棵。
1.2 试验设计
移栽后,每天向盆中一次性浇灌10 mL Hoagland营养液,培养7 d后进行PEG干旱和SA处理。PEG质量浓度设置为0(P0)、5%(P5)、10%(P10)、15%(P15)和20%(P20),每日向盆中一次性浇灌10 mL PEG溶液。同一PEG处理下,每天上午10:00分别用喷壶向桔梗叶片喷洒0(S0)、10(S10)、20(S20)和30(S30)mg·L−1SA 溶液。每个处理3盆植株,重复3次。处理5 d后分别收取桔梗全部叶片和根,液氮冷冻后置于−80℃冰箱。叶片用于生理指标的测定和RNA的提取;根用于生理指标的测定。
1.3 指标测定
1.3.1 生理指标检测 丙二醛(malondial-dehyde,MDA)、可溶性糖(soluble sugar,SS)、脯 氨 酸(proline,Pro)、超 氧 化 物 歧 化 酶(Superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)活性的检测均按照试剂盒说明书进行(苏州科铭生物技术有限公司)。叶绿素(chlorophyll,Chl)和可溶性蛋白(soluble protein,SP)含量检测参照张以顺等[14]的方法进行。
1.3.2 RNA提取和实时荧光定量PCR 将采集的桔梗叶片在液氮中研磨,按照试剂盒说明书(北京天根生化科技有限公司)提取桔梗总RNA,1.0%琼脂糖凝胶电泳检测完整性,核酸浓度检测仪测定RNA的纯度及浓度,依据试剂盒说明书(日本TaKaRa有限公司)进行RNA反转录。然后,以各处理cDNA为模板,actin基因作为内参,采用实时荧光定量PCR法检测POD、P5CR、CAO和CHLG基因的表达量。基因相对表达量的计算采用 2−△△Ct法[15-16]。基因序列由本课题组前期桔梗转录组测序结果获得,引物采用Primer Premier 5.0设计,由生工生物工程(上海)股份有限公司合成,引物序列详见表1。

表1 引物序列Table 1 Primer sequence
1.4 数据处理
采用SPSS 22.0软件对数据进行统计分析,采用Duncan法进行差异显著性分析,采用Excel 2013软件进行绘图。
2 结果与分析
2.1 水杨酸对干旱胁迫下桔梗叶片叶绿素含量的影响
如图1所示,随干旱胁迫程度的加剧,叶绿素含量逐渐降低。未添加SA时,P20处理的叶绿素含量为对照(P0处理)的39.87%。在10%和15%PEG处理下,S10和S20处理的叶绿素含量均显著高于S0处理,其中S20处理的叶绿素含量最高。在10%和15%PEG处理下,S20处理的叶绿素含量分别是S0处理的1.22和1.32倍;当SA达到30 mg·L−1时,叶绿素含量反而有所降低。由此表明,干旱胁迫下,外源施加20 mg·L−1SA时可有效抑制叶绿素的降解。

图1 不同处理下桔梗叶片的叶绿素含量Fig.1 Chlorophyll contents in Platycodon grandiflorus leaves of different treatments
2.2 水杨酸对干旱胁迫下桔梗叶片和根中MDA含量的影响
对不同处理叶片中MDA含量进行分析,结果(图2)表明,未添加SA时,叶片中MDA含量随干旱胁迫程度的加剧逐渐增加,P5、P10、P15和P20处理的MDA含量分别为对照(P0处理)的1.45、1.76、1.87和1.99倍,表明干旱胁迫下叶片中膜脂过氧化物不断积累,细胞氧化损伤增加。在5%、10%和15%PEG浓度下,S20处理的MDA含量较S0处理分别显著降低了18.73%、25.76%和16.70%,表明外源添加水杨酸有效缓解了干旱胁迫下桔梗叶片的膜脂过氧化程度。在20%PEG浓度下,添加SA处理与S0处理间MDA含量无显著差异。
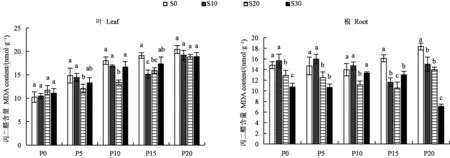
图2 不同处理下桔梗叶片和根中MDA含量Fig.2 MDA contents in Platycodon grandiflorus leaves and roots of different treatments
对不同处理下根中MDA含量进行分析,结果(图2)表明,未添加SA时,P20处理根中MDA含量为P0处理的1.24倍;添加SA后,S20处理的MDA含量在不同质量浓度PEG(0、5%、10%、15%和20%)胁迫下均显著低于S0处理,分别降低了12.88%(P0)、14.78%(P5)、20.17%(P10)、34.57%(P15)和23.95%(P20)。表明水杨酸质量浓度为20 mg·L−1时,可有效缓解干旱胁迫下桔梗根细胞的膜脂过氧化程度。
2.3 水杨酸对干旱胁迫下桔梗叶片和根中渗透调节物质含量的影响
如图3所示,叶片可溶性糖含量随干旱胁迫程度增加呈上升趋势。在10%和15%PEG胁迫下,S10和S20处理均能显著提高叶片中可溶性糖含量,表明外源添加水杨酸可通过提高叶片可溶性糖的含量从而缓解干旱胁迫对植株造成的损伤;而添加SA对不同干旱胁迫下根中可溶性糖含量均无显著影响。在10%和15%PEG胁迫下,S10和S20处理均能显著提高叶片和根中可溶性蛋白含量;在15%PEG处理下,S30处理显著提高了叶片可溶性蛋白含量,而根中可溶性蛋白含量显著降低。在10%和15%PEG胁迫下,S20处理能显著提高叶片和根中脯氨酸含量;在15%和20%PEG胁迫下,S30处理叶片和根中脯氨酸含量显著降低。上述结果表明,在干旱胁迫下高质量浓度SA会抑制脯氨酸的累积。
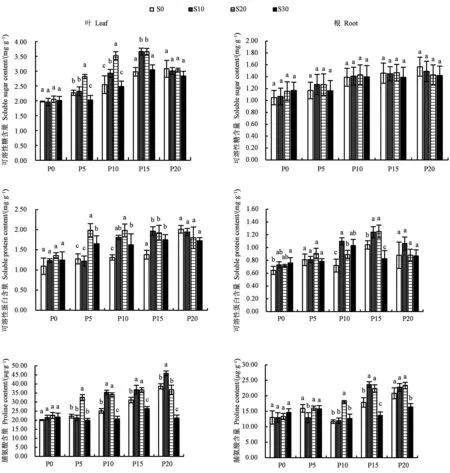
图3 不同处理下桔梗叶片和根的可溶性糖和蛋白及脯氨酸含量Fig.3 Contents of SS,SP and Pro in Platycodon grandiflorus leaves and roots of different treatments
2.4 水杨酸对干旱胁迫下桔梗叶片和根中抗氧化酶活性的影响
如图4所示,SOD活性随PEG质量浓度的增加逐渐升高,POD和CAT活性随PEG质量浓度增加呈先升高后降低趋势。不同PEG胁迫(5%、10%、15%和20%)下,S20处理叶片和根中SOD活性显著提高,S10和S20处理均能显著提高叶片和根中POD和CAT活性,而S30处理的POD和CAT活性显著降低。综上所述,适量施用SA能提高桔梗叶片和根中抗氧化酶活性,缓解干旱胁迫造成的损伤,而高质量浓度SA可能引起POD活性降低,以SA 质量浓度为20 mg·L−1时效果最佳。
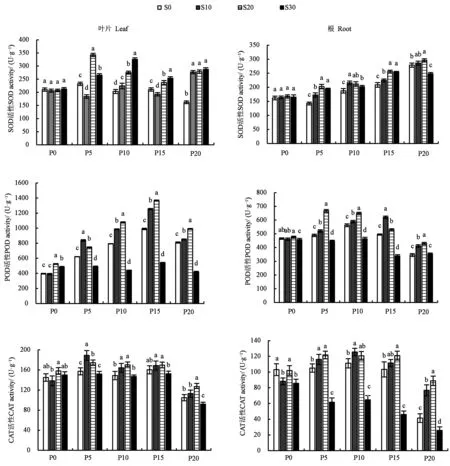
图4 不同处理下桔梗叶片和根中抗氧化酶活性的影响Fig.4 Activities of antioxidant enzymes in Platycodon grandiflorus leaves and roots of different treatments
2.5 水杨酸对干旱胁迫下桔梗叶片相关基因表达的影响
如图5所示,S0处理叶片中CAO和CHLG基因的表达量随干旱程度的加剧呈下降趋势,与叶绿素含量变化规律一致。在10%、15%和20%PEG胁迫下,外源添加SA处理叶片中CAO和CHLG基因的表达量均显著提高;PEG质量浓度为0和5%时,S20和S30处理叶片中CHLG基因表达量显著提高,而CAO基因表达量无显著变化。由此表明,不同干旱胁迫程度下,SA能诱导不同叶绿素合成相关基因的表达,从而抑制叶绿素的降解。
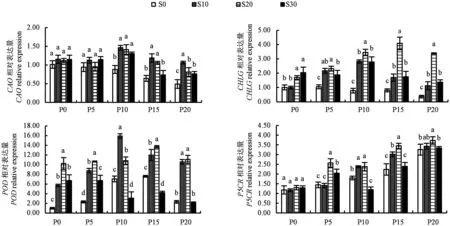
图5 不同处理下COA、CHLG、POD和P5CR基因在叶片中的相对表达量Fig.5 Related expression of COA,CHLG,POD and P5CR genes in Platycodon grandiflorus leaves
S0处理叶片中POD基因的表达量随干旱胁迫程度的加剧呈先增加后降低的趋势,与POD活性变化规律一致;而P5CR基因的表达量随干旱胁迫程度的加剧呈上升趋势(图5)。在不同质量浓度PEG胁迫下,S10和S20处理叶片中POD基因的表达量均显著提高;在10%和15%PEG胁迫下,S30处理抑制了POD基因的表达,与POD活性测定结果一致。在10%和15%PEG胁迫下,S10和S20处理叶片中P5CR基因的表达量均显著提高,与脯氨酸含量测定结果一致。
3 讨论
干旱是自然界常见的逆境胁迫因素,对植物生长具有严重影响。水杨酸是植物莽草酸代谢途径中的一种酚类衍生物,对植物的种子萌发、生长、开花等一系列生理生化过程[11]有影响。在非生物胁迫下,水杨酸能够减轻植物光合色素含量的下降程度,从而使叶片保持较高的光合速率来保证植物正常生长[17]。本研究结果表明,随干旱胁迫程度的加剧叶绿素含量逐渐降低,在10%和15%PEG胁迫下,外源添加10和 20 mg·L−1SA可显著提高叶片叶绿素含量,由此表明,适宜质量浓度的水杨酸处理有利于植物保持较高的叶绿素含量。对叶绿素合成途径中两个关键酶基因CAO和CHLG的表达量进行分析表明,外源添加SA显著提高了叶片中CAO和CHLG基因的表达量,从分子水平验证了干旱胁迫下外源添加SA可减轻叶绿素含量的下降程度。叶绿素的生物合成是多种酶参与的过程,本文仅对其中两种酶基因的表达量进行了检测,对于在干旱胁迫下,添加外源水杨酸对其他叶绿素合成途径中酶基因表达量的影响仍有待于进一步研究。
抗氧化酶类可有效清除自由基,保护膜系统,缓解植物受到的胁迫伤害。SA作为信号分子,可以激活多种与胁迫应答有关的基因表达,并通过调节活性氧、抗氧化酶及非酶促抗氧化体系而提高植物的抗逆性[11],本研究表明,在干旱胁迫下对桔梗进行一定质量浓度的水杨酸处理,可以提高桔梗幼苗叶片和根中抗氧化酶活性,减轻干旱胁迫对桔梗幼苗的危害。可溶性糖和蛋白及脯氨酸等渗透调节物质的累积对植物抵抗干旱胁迫具有重要意义,本研究表明,在干旱胁迫下,外源添加适宜质量浓度的SA能够增加桔梗叶片和根中可溶性蛋白质、可溶性糖和脯氨酸含量。由此表明,适宜质量浓度的SA可以有效促进桔梗叶片和根中渗透调节物质的累积,从而提高植物的抗逆性,缓解逆境对植物造成的损伤。研究表明,脯氨酸不仅具有渗透调节作用,还对渗透保护动能具有重要意义,其代谢和积累有利于维持干旱胁迫下细胞内结构和膜的稳定性,同时具有清除超氧阴离子等自由基的作用[18-19]。OAT和P5CS分别是合成脯氨酸鸟氨酸途径和谷氨酸途径中的限速和调节酶[20],而P5CR催化脯氨酸生物合成的最终反应。本研究对PEG胁迫下桔梗幼苗叶片中P5CR基因的表达量进行分析表明,在10%和15%PEG胁迫下,外源添加10或20 mg·L−1SA均能显著提高叶片中P5CR基因的表达量,与脯氨酸含量测定结果相一致。综上所述,外源添加适量SA可提高抗氧化酶活性,促进渗透调节物质的累积,从而提高桔梗幼苗的抗干旱能力。
——辨别味之苦甜

