鳜鱼传染性脾肾坏死病和弹状病毒病二联灭活疫苗毒种及种子批的研究
罗 霞,付小哲,林 强,刘礼辉,牛银杰,梁红茹,李宁求
(中国水产科学研究院 珠江水产研究所,农业农村部渔用药物创制重点实验室,广东省水产动物免疫技术重点实验室,广东 广州 510380)
鳜鱼(Sinipercachuatsi)是我国重要的名特优水产养殖品种之一,随着养殖规模的扩大以及养殖水环境的恶化,鳜鱼的养殖病害日益严重。目前,传染性脾肾坏死病毒(infectious spleen and kidney necrosis virus,ISKNV)和弹状病毒(Sinipercachuatsirhabdoviruses,SCRV)已成为威胁鳜鱼养殖业健康发展的主要因素之一。免疫预防是防治病毒病暴发最有效的措施。国内Dong等[1]建立了ISKNV敏感的鳜鱼仔鱼细胞系MFF-1,随后研制出了鳜鱼ISKNV灭活疫苗(新兽药证书:(2019)新兽药证字75号),在实验室和田间免疫保护率超过90%。本课题组研制了鳜鱼ISKNV编码蛋白疫苗和DNA疫苗,免疫保护率均超过60%[2-4]。Zhang等[5]发现,以壳聚糖作为佐剂,ISKNV灭活疫苗的保护率可达到58%。Chen等[6]构建了SCRV G蛋白DNA疫苗,对鳜鱼的保护率为77.5%。Zhang等[7]筛选到1株SCRV弱毒株MSRV-SS-7,将其制成弱毒疫苗,通过浸泡和注射均可对鳜鱼提供100%的免疫保护率。上述疫苗对鳜鱼病毒病的暴发起到了一定的预防作用,但存在的关键问题是只能预防单一病种。为解决此难题,实现一针防两病的目的,本课题组在多年流行病学调查的基础上[8],初步研制出了安全、有效的鳜鱼ISKNV和SCRV二联灭活疫苗,该疫苗对ISKNV和SCRV感染可分别提供90%和80%以上的免疫保护率。
毒种质量直接影响着疫苗的安全性和有效性,因此合格、适宜代次的毒种是疫苗生产所必需的。为了建立鳜鱼ISKNV和SCRV二联灭活疫苗毒种库及种子批,本研究以筛选得到的ISKNV-QY0910株和SCRV-GM1503株为原始毒种(制苗及攻毒用毒株相同),将其扩繁10代后,鉴定各代次毒种的毒力、增殖稳定性、特异性、纯粹性、免疫原性以及保存期等,以期为鳜鱼ISKNV和SCRV二联灭活疫苗的研制及种子批的建立奠定基础。
1 材料与方法
1.1 毒种、细胞和试验鱼
鳜鱼脑组织细胞系(Chinese perch brain cell line,CPB)[9]、SCRV-GM株和ISKNV-QY株,均由本实验室保存;试验用鳜鱼,购自广东省清远市某养殖场,PCR检测不携带ISKNV和SCRV等病毒,细菌分离鉴定无细菌感染;L15培养基,购自Gibco公司;DNA提取试剂盒,购自OMEGA试剂公司;TRIzol,购自Invitrogen公司;反转录试剂盒,购自艾科瑞(AG)试剂公司;试验所用引物,均由广州艾基生物科技有限公司合成。
1.2 ISKNV和SCRV毒种的扩繁及滴度测定
采用异步接毒法,在原始种子的基础上对ISKNV、SCRV分别扩繁10代(F1~F10)。将F1~F10代ISKNV按照感染复数(MOI)为1、SCRV按照MOI为0.01分别接种对数生长期的CPB细胞,28 ℃吸附1~2 h后,加含体积分数5%血清的L15培养液,28 ℃继续培养。以未接种病毒的CPB细胞为对照。每日观察细胞病变(CPE)情况,当细胞病变达80%以上时,将CPB细胞置-80 ℃冻融2次收获病毒液。
将F1~F10代病毒液用L15培养液依次作10倍系列稀释,取10-5~10-12稀释度的病毒液,按100 μL/孔的量接种长满CPB细胞单层的96孔板中,最后一列作为对照,每个稀释度设8个平行,28 ℃孵育1~2 h后,补加含体积分数5%血清的L15培养液,置于28 ℃培养箱继续培养,每日观察记录细胞病变孔数,SCRV接种细胞观察7~10 d,ISKNV接种细胞观察10~15 d。用Reed-Muench法[10]计算半数组织培养感染剂量(TCID50),即病毒滴度。
1.3 ISKNV和SCRV毒力的测定
选取体长12~15 cm的健康鳜鱼160尾,分为8组,每组20尾,在25~28 ℃的循环水中暂养2周。停止喂饲24 h后攻毒,1,2和3组分别背部肌肉注射F1、F5和F10代SCRV-GM株病毒液(病毒含量为106.5TCID50/mL)0.1 mL/尾;4,5和6组分别背部肌肉注射F1、F5和F10代ISKNV-QY株病毒液(病毒含量为104TCID50/mL)0.1 mL/尾;第7组注射等量的PBS(PBS组);第8组为空白对照组,不进行注射操作。攻毒后连续14 d统计死亡率,对病死鳜鱼进行剖检,并采用qPCR法检测SCRV[11]、ISKNV[12]。
1.4 ISKNV、SCRV毒种的特异性检测
1.4.1 ISKNV主衣壳蛋白基因序列分析 用DNA提取试剂盒提取F1、F5和F10病毒基因组,备用。根据 GenBank 登录的ISKNV主衣壳蛋白(major capsid protein,MCP)序列(GenBank登录号AF371960.1),用Primer 5软件设计1对引物,用于扩增MCP基因全长(1 300 bp),引物序列如下:ISKNV-MCP-F:5′-ATGTCTGCAATCTCAGGT-3′;ISKNV-MCP-R:5′-TTACAGGATAGGGAAG-CCTG-3′。MCP基因扩增PCR反应体系:Premix ExTaq12.5 μL,上下游引物(10 μmol/L)各1 μL,DNA模板1 μL,加双蒸水至25 μL。反应程序:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,共30个循环;72 ℃延伸 10 min。试验同时设置阳性对照(用实验室保存的ISKNV基因组DNA作模板)和阴性对照(用水代替模板)。PCR产物经1%琼脂糖凝胶电泳后送广州艾基生物科技有限公司测序,将测序结果与GenBank中序列进行BLAST比对。
1.4.2 SCRV G蛋白基因序列分析 采用TRIzol法提取F1、F5和F10病毒总RNA,备用。根据GenBank登录的鳜鱼弹状病毒G蛋白基因序列(GenBank登录号:DQ399789.1),用Primer 5软件设计1对引物,用于扩增G基因全长(1 500 bp),引物序列如下:SCRV-G-F:5′-ATGAAATCAAT-CATTGCACTTACGT-3′;SCRV-G-R:5′-TTAGG-GAACAAATTGATACTGCTGC-3′。G基因RT-PCR反应体系:2×RT-PCR预混液12.5 μL,上下游引物(20 μmol/L)各0.4 μL,RNA模板2 μL,加双蒸水至25 μL。反应程序:50 ℃反转录30 min;94 ℃ 3 min,94 ℃ 30 s,58 ℃ 45 s,72 ℃ 2 min,共30个循环;72 ℃延伸10 min。试验同时设置阳性对照(用实验室保存的SCRV基因组RNA作模板)和阴性对照(用水代替模板)。PCR产物经1%琼脂糖凝胶电泳后送广州艾基生物科技有限公司测序,将测序结果与GenBank中序列进行BLAST比对。
1.5 ISKNV、SCRV毒种的纯粹性检测
1.5.1 细菌、霉菌和支原体检测 按现行《中华人民共和国兽药典》[13]附录对F1、F5和F10代ISKNV、SCRV毒种进行细菌、霉菌、支原体检测。
1.5.2 外源病毒检测 (1) RANA检测。采用PCR方法检测ISKNV、SCRV毒种是否有鳜鱼蛙病毒(RANA)污染。参照王庆等[14]设计的引物(RANA-F:5′-TATGTGCTCAACTCTTGGCTGGTC-3′;RANA-R:5′-CACGATGGGCTTGACTTCTCC-3′)进行PCR扩增。PCR反应体系:10×TaqPCR Master Mix 2.5 μL,NTP mix(2.5 mmol/L )0.4 μL,上下游引物(20 μmol/L)各0.4 μL,TaqDNA酶0.3 μL,ISKNV或SCRV基因模板2 μL,加双蒸水至25 μL。PCR反应程序:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 45 s,72 ℃ 60 s,共30个循环;72 ℃延伸10 min。试验同时设置阳性对照(用实验室保存的RANA基因组DNA作模板)和阴性对照(用水代替模板)。PCR产物经1%琼脂糖凝胶电泳检测。
(2)NNV 检测。 采用RT-PCR方法检测ISKNV、SCRV毒种是否有神经坏死病毒(NNV) 污染。参照Liu等[15]设计的引物(NNV-R3:5′-CGAGTCAACACGGGTGGAGA-3′;NNV-F2:5′-GTGTCAGTCATGTGTCGCT-3′)进行RT-PCR扩增。RT-PCR反应体系:5×逆转录酶缓冲液10 μL,上下游引物(20 μmol/L)各1 μL,MgCl2(25 mmol/L)5 μL,dNTPs(10 mmol/L )1 μL,逆转录酶(5 U/μL)1 μL,RNase抑制剂(20 U/μL)0.5 μL,DNA聚合酶(5 U/μL)1 μL,ISKNV或SCRV基因模板10 μL,加双蒸水至50 μL。RT-PCR反应程序:42 ℃ 30 min,95 ℃ 5 min;95 ℃ 40 s,55 ℃ 40 s,72 ℃ 40 s,共35个循环;72 ℃延伸5 min。试验同时设置阳性对照(实验室保存的NNV基因组cDNA作模板)和阴性对照(用水代替模板)。RT-PCR产物经1%琼脂糖凝胶电泳检测。
1.6 ISKNV、SCRV毒种的免疫原性检测
分别将F1、F5和F10代ISKNV(106TCID50/mL)、SCRV(106.5TCID50/mL)病毒液用甲醛灭活后制备灭活疫苗,备用。选取体长8~10 cm的健康鳜鱼540尾,分成9组,每组60尾,25~28 ℃的循环水暂养2周,停止喂饲24 h后注射免疫。其中1~3组腹腔注射免疫各代次的SCRV灭活疫苗,4~6组腹腔注射免疫各代次的ISKNV灭活疫苗,7~8组腹腔注射PBS(对照组),免疫组和对照组试验鱼的注射剂量均为0.1 mL/尾。第9组为空白对照组,不进行注射操作。免疫后21 d,各组均取50尾鳜鱼进行攻毒,1,2,3和7组注射SCRV-GM株病毒液(106.5TCID50/mL);4,5,6和8组注射ISKNV-QY株病毒液(104TCID50/mL),方法、剂量同1.3节。攻毒后连续观察14 d,待鱼体稳定后统计死亡率并计算免疫保护率(RPS):RPS=(1-免疫组死亡率/对照组死亡率)×100%。对死亡鱼进行剖检,并采用qPCR法检测SCRV[11]、ISKNV[12]。
1.7 ISKNV、SCRV毒种的保存期检测
将1.2节收获的ISKNV和SCRV湿毒保存于-80 ℃冰箱,每6个月取3支检测病毒滴度。
2 结果与分析
2.1 ISKNV、SCRV毒种对CPB细胞的致病性和滴度
2.1.1 对CPB细胞的致病性 F1~F10代ISKNV感染CPB细胞后产生的CPE形态及病变速度基本相同。F10代ISKNV感染后1~2 d,CPB细胞未见明显变化,只有极少数细胞由纤维状慢慢聚拢变圆(图1-A);感染后3~4 d部分细胞开始聚缩、肿大,少数细胞发生脱落(图1-B);感染后5 d,90%以上CPB细胞出现CPE,细胞脱落现象加剧,直至几乎全部脱落,培养液变得浑浊(图1-C)。

A~C.分别为感染后2,4,5 d的CPB细胞;D.对照CPB细胞A-C.CPB cells at 2,4 and 5 days post infection;D.Mock-infected CPB cells
F1~F10代SCRV感染CPB 细胞后产生的CPE形态及病变速度也基本相同。F10 SCRV感染后12 h少数CPB细胞开始脱落(图2-A);感染后24 h,CPB细胞出现拉丝现象,细胞脱落加剧(图2-B);感染后36 h 90%以上的CPB细胞脱落(图2-C)。
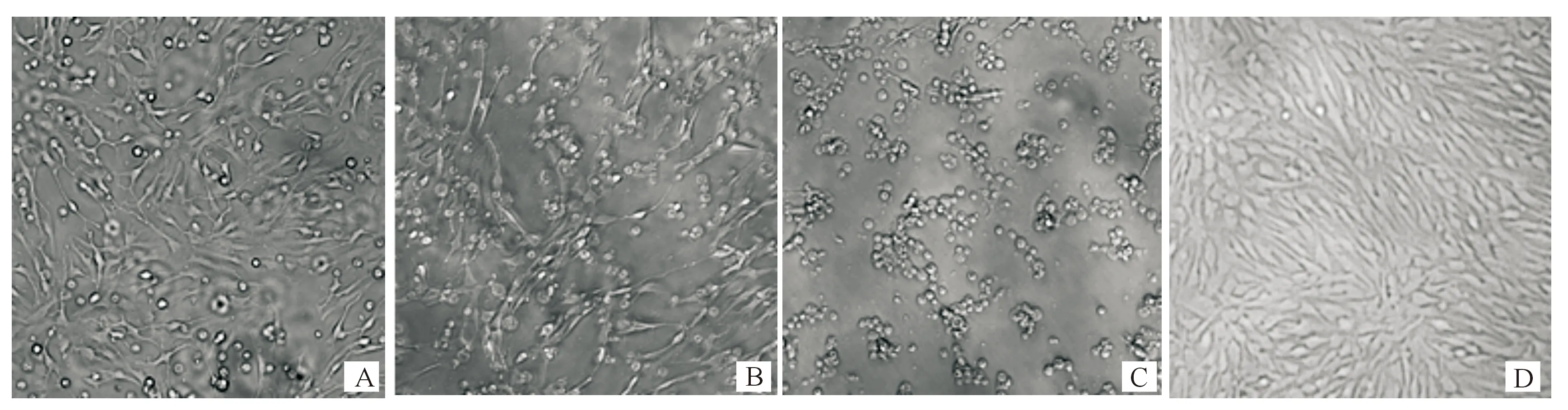
A~C.分别为感染后12,24,36 h的CPB细胞;D.对照CPB细胞A-C.CPB cells at 12,24 and 36 hours post infection;D.Mock-infected CPB cells图2 F10代SCRV感染CPB后细胞病变情况(×10)Fig.2 Cytopathic effects of CPB cells infected with SCRV(×10)
2.1.2 病毒滴度 由图3可以看出,各代次病毒接种CPB细胞后,SCRV滴度稳定在108.58~108.875TCID50/mL,ISKNV滴度稳定在107.38~107.625TCID50/mL,各代次间无显著差异。
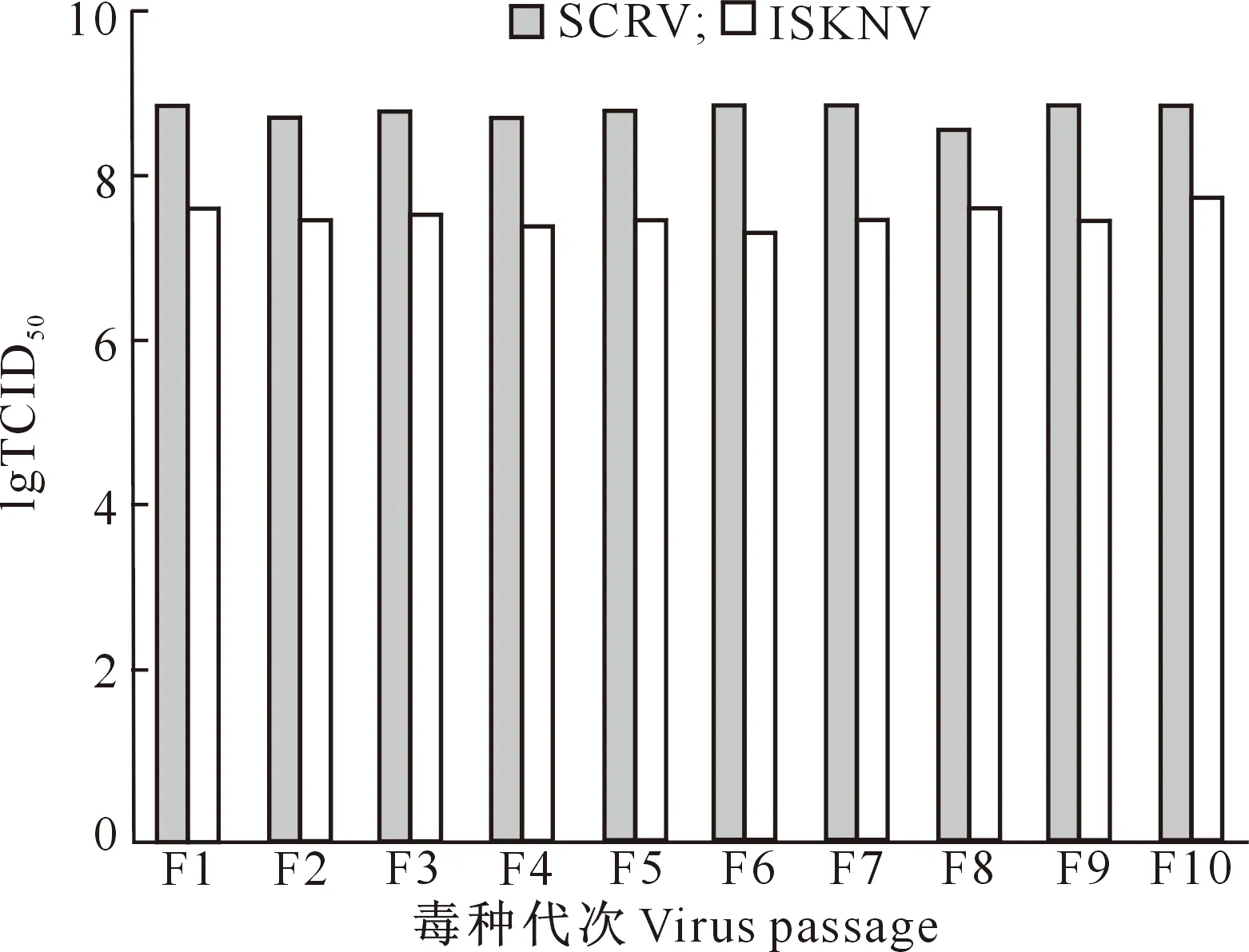
图3 ISKNV和SCRV不同代次毒种的滴度Fig.3 TCID50 of ISKNV and SCRV at different passages
2.2 F1、F5和F10代ISKNV和SCRV对鳜鱼的致病力
F1、F5、F10代SCRV接种鳜鱼均在攻毒1 d后开始死亡,持续到第5 天死亡率达90%以上(图4);解剖可见,病死鳜鱼鳃丝和鳍条基部有出血点,肝脏和脾脏有出血点,肾脏肿大、出血;qPCR试验可检测到SCRV。F1、F5、F10代ISKNV接种鳜鱼均在攻毒后第5天开始死亡,持续到第10天,死亡率达95%以上(图4);解剖可见,病死鳜鱼体色变黑,脾、肾肿大,呈暗红色;qPCR试验可检测到ISKNV。PBS注射组和空白对照组在整个试验过程中均无病死鱼。结果表明,10代以内的SCRV和ISKNV 对鳜鱼具有极强的致病力,致死率均可达90%以上。

图4 感染SCRV和ISKNV后鳜鱼的累积死亡率Fig.4 Cumulative mortality of mandarin fish challenged with SCRV and ISKNV
2.3 ISKNV和SCRV毒种的特异性
如图5所示,F1、F5和F10代SCRV扩增得到了约1 500 bp的目的条带,ISKNV扩增得到了约1 300 bp的目的条带,均与预期结果一致。测序结果经BLAST比对,本试验ISKNVMCP基因与GenBank 登录的ISKNVMCP序列(登录号:AF371960.1)一致,SCRVG基因与GenBank 登录的SCRVG序列(登录号:DQ399789.1)一致,同源性均为100%。
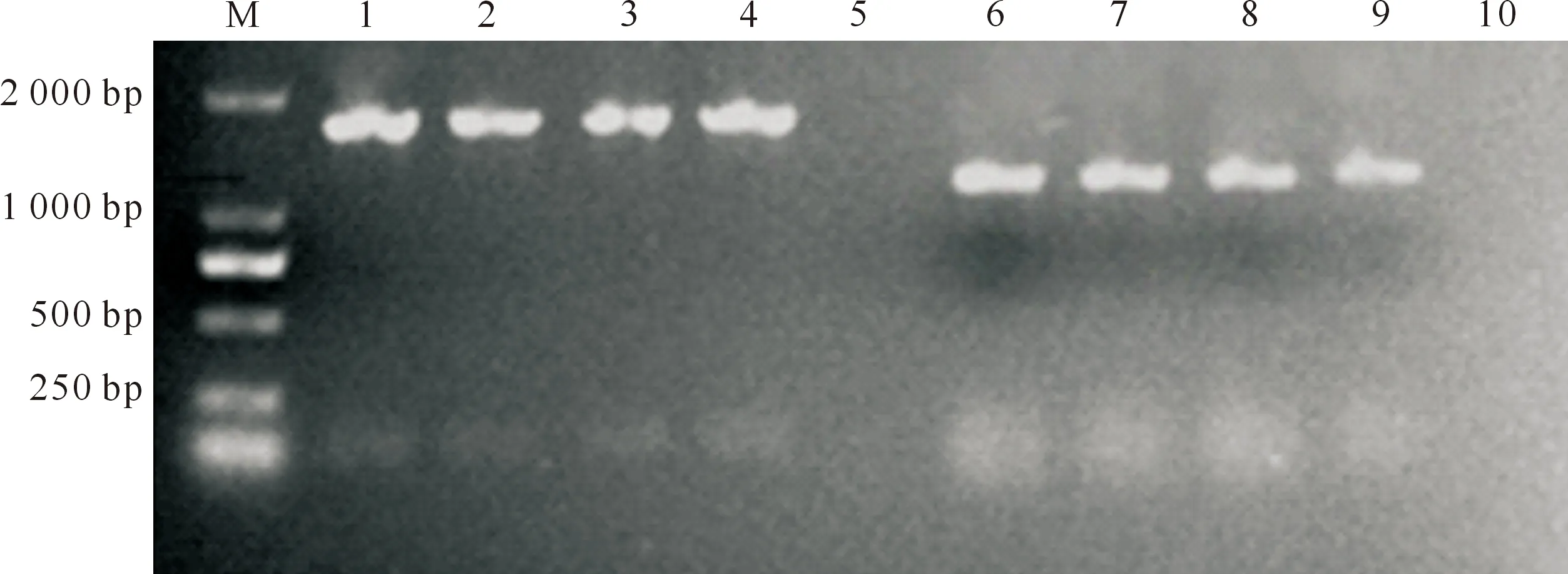
M.DL2000 DNA Marker;1~5.分别为SCRV G基因扩增的阳性对照和F1、F5、F10代病毒及阴性对照; 6~10.分别为ISKNV MCP基因扩增的阳性对照和F1、F5、F10代病毒及阴性对照M.DL2000 DNA Marker;1-5.G gene amplification of SCRV for positive control,F1,F5,F10 and negative control;6-10.MCP gene amplification of ISKNV for positive control,F1,F5,F10 and negative control图5 F1、F5和F10代SCRV G基因和ISKNV MCP基因PCR扩增结果Fig.5 Amplification of G gene for SCRV and MCP gene for ISKNV with passages F1,F5 and F10
2.4 ISKNV和SCRV毒种的纯粹性检验
经检验,F1、F5和F10代ISKNV和SCRV毒种均无细菌、霉菌、支原体及外源病毒污染。如图6所示,ISKNV毒种PCR扩增产物经1%琼脂糖凝胶电泳后置紫外灯下观察,RANA检测阳性对照出现475 bp的电泳条带,NNV检测阳性对照出现421~430 bp的电泳条带,阴性对照和F1、F5、F10 ISKNV毒种均无扩增条带,说明ISKNV毒种无RANA和NNV污染。SCRV毒种也未检测到RANA和NNV污染(图略)。
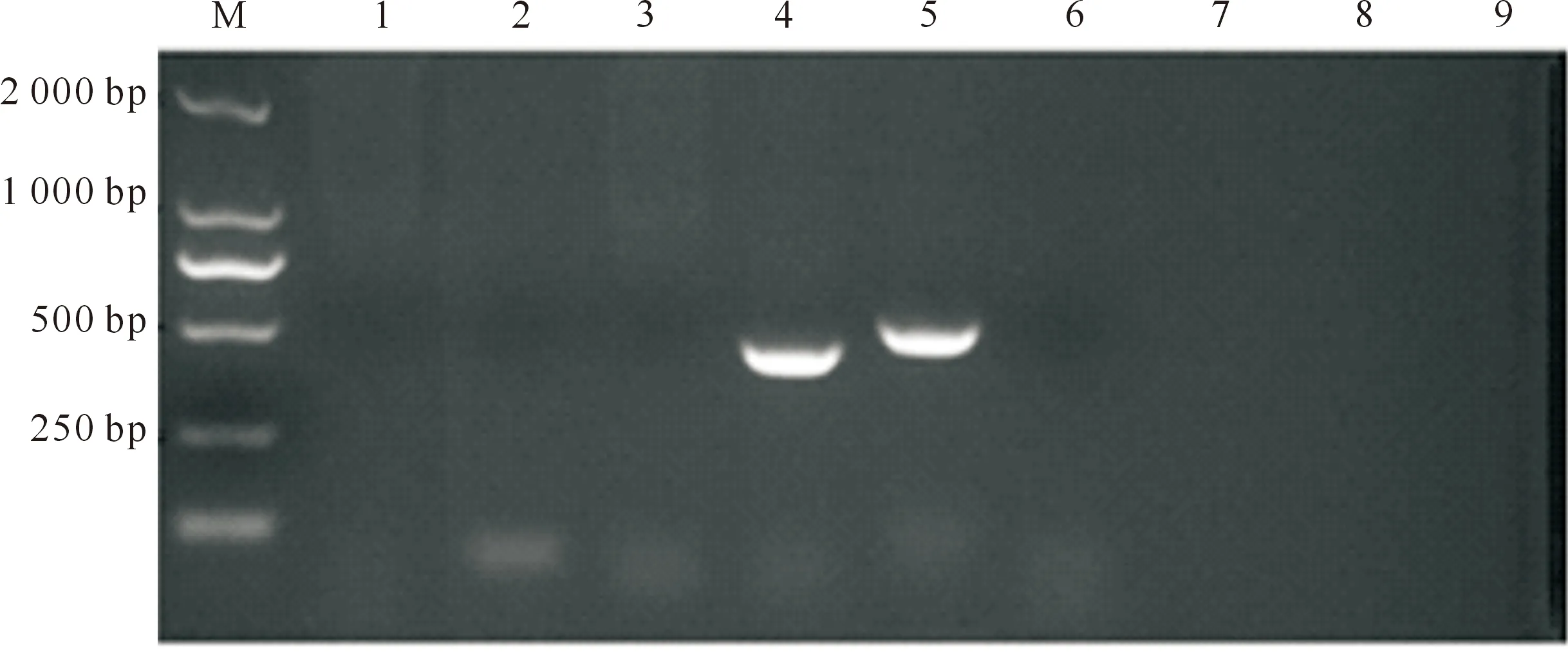
M.DL2000 DNA Marker;1~4.分别为F1、F5、F10代毒种的NNV检测及阳性对照;5~8.分别为RANA检测的阳性对照及F1、F5、F10代毒种;9.阴性对照M.DL 2000 DNA Marker;1-4.NNV detection for F1,F5,F10 and positive control;5-8.RANA detection for positive control,F1,F5 and F10;9.Negative control图6 F1、F5和F10代ISKNV毒种的NNV和RANA PCR检测Fig.6 PCR detection of NNV and RANA for ISKNV with passages F1,F5 and F10
2.5 ISKNV和SCRV毒种的免疫原性
SCRV攻毒后,对照组鳜鱼第2天开始出现死亡,持续到第5天,死亡率达90%;免疫组第3天开始出现死亡,持续到第7天,用F1、F5和F10代SCRV疫苗免疫的死亡率分别为12%,10%和14%。病死鱼的剖检病症同2.2节,qPCR试验均检测到SCRV。计算各组的RPS,结果(图7)表明,10代以内的SCRV 毒种制备的疫苗可为鳜鱼提供良好的免疫保护力,RPS均在84%以上。
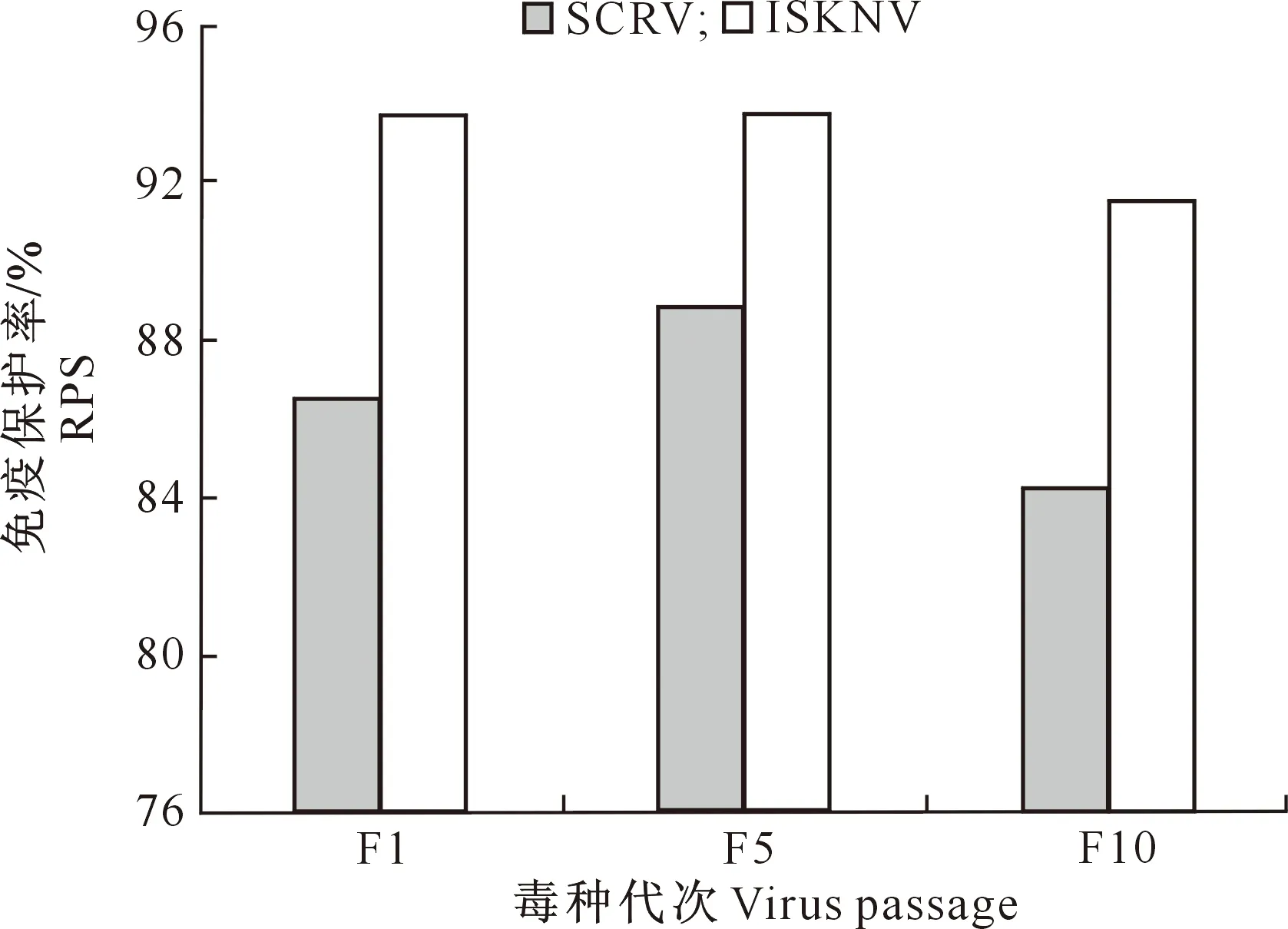
图7 ISKNV和SCRV的F1、F5和F10代毒种制备疫苗的免疫保护率Fig.7 RSP of vaccines prepared with ISKNV and SCRV at passages F1,F5 and F10
ISKNV攻毒后,对照组第5天开始出现死亡,持续到第10天,死亡率达95%;免疫组死亡时间有所推迟,从第7天开始出现死亡,持续到第12天,用F1、F5和F10代ISKNV疫苗免疫组的死亡率分别为6%,6%和8%。病死鱼剖检症状同2.2节,qPCR试验均检测到ISKNV。空白对照组在整个试验过程中均无病死鱼。计算各组的RPS,结果(图7)表明,10代以内的ISKNV 毒种制备的疫苗可为鳜鱼提供良好的免疫保护力,RPS均在92%以上。
2.6 ISKNV和SCRV毒种保存期
由图8可知,ISKNV和SCRV湿毒保存于-80 ℃,36个月内F1、F5和F10代病毒滴度(TCID50)均无显著变化,ISKNV高于107.25TCID50/mL,SCRV高于108.5TCID50/mL。因此,2种病毒的保存期暂定为36个月。
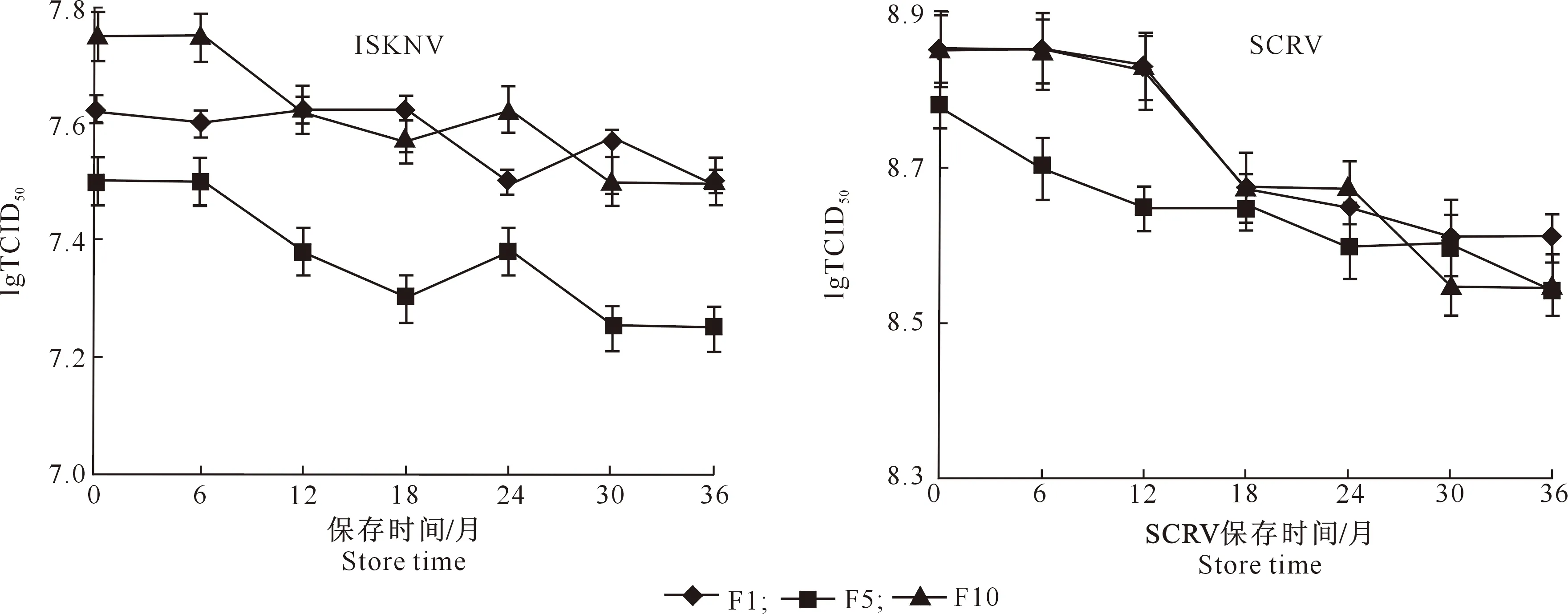
图8 ISKNV和SCRV于-80 ℃条件下保存36个月内的滴度变化Fig.8 Titer variation of ISKNV and SCRV stored at -80 ℃ within 36 months
3 讨 论
近年来,随着水产养殖业的规模化发展,多种疾病经常并发或相继发生[16-17]。联合疫苗在降低成本的同时可以减轻对接种对象的应激反应,起到“一针防多病”的目的,在国内外已经得到广泛的研究和推广应用。在国外,多种鱼用联合疫苗,如杀鲑气单胞菌、鳗弧菌二联灭活疫苗和鲤弹状病毒、传染性胰脏坏死病毒二联疫苗等已经被商品化。在鳜鱼的养殖业中,传染性脾肾坏死病和弹状病毒病造成的损失惨重,鉴于目前已报道研发的疫苗仅仅针对单种疾病的现状,安全有效的二联疫苗的研发、推广势在必行。疫苗生产过程中,毒种质量严重影响疫苗的免疫效果和稳定性。本研究结果证明,鳜鱼传染性脾肾坏死病、弹状病毒病二联灭活疫苗制苗和攻毒用毒种在10代以内的增殖量、特异性、毒力、免疫原性、保存期、纯粹性等均相对稳定,为二联疫苗生产和检验用毒种的选用奠定了基础。
G蛋白是SCRV抗原决定簇的主要蛋白,具有4个结构域,不同弹状病毒G 蛋白差异性很大,但都具有保守的结构组成[18-21]。本研究选取G蛋白基因作为SCRV鉴定的特异性基因,3个代次的病毒种均能扩增出与GenBank中登录序列一致的G基因全长序列,同源性为100%,表明10代以内SCRV的G基因序列稳定,在细胞中传代未导致该基因发生变异,具有良好的毒种特异性。MCP是虹彩病毒粒子中丰度最高的蛋白,在虹彩病毒科中高度保守,因此MCP的同源性差异被用来开展虹彩病毒分子进化方面的研究[22]。本研究选取MCP基因作为ISKNV鉴定的特异性基因,所扩增出的F1、F5和F10代ISKNV毒种的MCP基因全长序列与GenBank中登录序列一致,同源性均为100%,表明10代以内ISKNV的MCP基因序列稳定,在细胞中传代未导致该基因发生变异,具有良好的毒种特异性。
病毒在细胞中传代可以造成DNA或RNA序列产生一定程度的变异,导致其毒力减弱以及毒力基因发生突变,传代次数越多,与亲代的变异就越大。Nakajima等[23]发现,真鲷虹彩病毒(red sea bream iridovirus,RSIV)感染BF-2细胞后,随着病毒的连续传代感染力迅速下降。Zhao等[24]对鸡传染性支气管炎病毒(infectious bronchitis virus,IBV)的研究发现,1株QX型IBV分离株在SPF鸡胚上连续传118代后,在鸡体内的复制能力和致病性均显著降低。本试验结果发现,在10代内ISKNV以病毒含量104TCID50/mL、SCRV以病毒含量106.5TCID50/mL,每尾0.1 mL经背部肌肉注射健康鳜鱼后,各代次毒种对鳜鱼的致死率均可达到90%以上,证明毒种的毒力非常稳定,可作为强毒株进行检验;对感染CPB细胞致病性试验表明,病毒增殖及复制周期稳定,F1~F10代SCRV病毒滴度在108.58~108.875TCID50/mL,ISKNV病毒滴度在107.38~107.625TCID50/mL,各代次间均无显著差异,由此可见,10代内的ISKNV和SCRV可作为种子批进行疫苗的生产。
疫苗的免疫原性决定着疫苗的免疫保护效果,本试验10代内的ISKNV和SCRV制备的灭活疫苗对鳜鱼的免疫保护率分别达92%和84%以上,与已报道的鳜鱼传染性脾肾坏死病灭活疫苗和鳜鱼弹状病毒G蛋白DNA疫苗保护率相似。本研究还发现,与F1和F5代毒种相比,F10代毒种所制备的疫苗免疫保护率稍有下降,ISKNV为91.6%,SCRV为84.4%。刘萍等[25]对猪繁殖与呼吸综合征病毒的研究也发现,随着体外传代次数的增多,疫苗候选株JXM在猪体上过渡致弱,导致其免疫保护力降低。推测,随着体外传代次数的增加,病毒适应细胞生长的突变会逐渐累积,如果这些突变数量控制在一定范围内,则对病毒在宿主上的免疫原性无显著影响,但是当这些突变增加到一定程度时则会影响病毒在宿主上的免疫原性。因此确定生产疫苗用毒种的工作代次至关重要。本试验结果显示,10代以内的ISKNV、SCRV对鳜鱼的免疫保护率分别可达92%和84%以上,可以起到良好的保护作用,说明10代以内的ISKNV和SCRV所制备的灭活疫苗免疫原性相对稳定,可以作为种子批用于疫苗生产,这与吕文利等[26]对不同代次乙脑病毒及王春华等[27]对狂犬病毒CTNCEC25株的研究结果相类似。
综上所述,10代以内的ISKNV和SCRV生物学特性稳定,无细菌、霉菌、支原体及外源病毒RANA、NNV污染,符合制苗及检验用毒种的质量要求,且-80 ℃条件下湿毒保存期可长达36个月。本研究为鳜鱼传染性脾肾坏死病和弹状病毒病二联灭活疫苗毒种库及种子批的建立提供了理论基础。

