2株林麝肺源铜绿假单胞菌毒力及致病性比较
邓 英,李 强,严立恒,张白玉,杨 胡,付 萍,孙珊珊,颜其贵
(四川农业大学 动物医学院,四川 成都 611130)
铜绿假单胞菌(Pseudomonasaeruginosa,PA)也称绿脓杆菌,是一种重要且常见的条件性人兽共患致病菌。该菌是医院内获得性感染的三大主要病原菌之一,如囊性纤维化肺(CF)[1]、艾滋病HIV[2]及烧伤[3]等患者都是感染的高危人群。感染一旦形成生物膜,更是难以根除[4]。该菌一般不会引起健康机体发病,而是在人体防御能力受损时乘虚而入。此外,铜绿假单胞菌是林麝化脓性肺炎的主要病原体之一[5]。
林麝是我国一级保护动物,主要分布在陕西省和四川省。由于过度狩猎、栖息地破坏以及缺乏科学管理等原因,导致林麝的种群数量呈下降趋势。从1950年前后开始人工繁殖林麝,由于化脓性疾病导致林麝的大规模繁育出现困难[6]。目前,该病的治疗仍采用传统抗生素。但是大量使用抗生素会促进铜绿假单胞菌的耐药性增强,导致其治疗难度增加。铜绿假单胞菌产生的毒力因子主要包括胞外蛋白酶(降解宿主分泌的介质,逃避宿主的防御机制[7-8])、胞外多糖(抵抗宿主细胞的吞噬作用和氧化应激,加强该菌对宿主细胞表面的黏附[9])、内毒素(脂质A结合TLR4-MD2,赋予对补体杀伤和阳离子抗微生物肽的抗性[10])、脓青素(促进铁的螯合作用[11])、外毒素A(导致宿主蛋白质生物合成失活[12])和绿脓菌素(pyocyanin,PYO)等。PYO是铜绿假单胞菌分泌的次级代谢物吩嗪之一,也是该菌特有的毒力因子。PYO不仅能促进生物膜的形成,也能诱导氧化应激引起宿主细胞损伤[13]。90%~95%的铜绿假单胞菌分离株都能分泌绿脓菌素[14]。本实验室从因化脓性肺炎死亡的林麝肺中分离出2株铜绿假单胞菌,其中1株不分泌绿脓菌素命名为ZP-1株;1株分泌绿脓菌素命名为BX-1株。为了更好地研究这2株表型差异的铜绿假单胞菌导致林麝化脓性肺炎的差异性,本研究比较其在体外的毒力因子表达,并且建立了接近于临床的小鼠急性、慢性肺部感染模型,旨在为林麝化脓性肺炎的治疗与防控提供依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 铜绿假单胞菌林麝源分离株BX-1株(分泌绿脓菌素)和ZP-1株(不分泌绿脓菌素),均由四川农业大学动物医学院微生物与免疫实验室分离鉴定并保存。
1.1.2 试验动物 120只CD-1小鼠,6周龄,雌性,体质量25 g/只,购于成都达硕实验动物有限公司。
1.1.3 主要试剂 弹性蛋白-刚果红(elastin-Congo red,ECR)、偶氮酪蛋白、矿物油,购于Sigma-Aldrich公司;小鼠白细胞介素6(IL-6)、白细胞介素1(IL-1β)酶联免疫分析试剂盒,购于江苏酶免实业有限公司;Mouse IFN-gamma ELISA Kit,购于杭州联科生物技术有限公司;红细胞裂解液,购于北京索莱宝科技有限公司;96孔板,购于康宁公司;高碘酸、柠檬酸、硝酸银,购于成都市科隆化学品有限公司;琼脂糖,购于生工生物工程股份有限公司;10%多聚甲醛固定液,购于武汉赛维尔生物科技有限公司。
1.1.4 仪器设备 旋转蒸发仪(RE52CS-1),购于上海亚荣生化仪器厂;磁力搅拌器(SH-3),购于北京市光明医疗器械有限公司;倒置显微镜(TS100),购于Nikon;低温组织研磨仪(KZ-Ⅲ-F),购于武汉赛维尔生物科技有限公司;自动细胞计数仪(RWD-C100),购于瑞沃德公司;多功能酶标仪(VARIOSKAN LUX),购于Thermo。
1.2 ZP-1和BX-1株的毒力表达测定
1.2.1 上清液制备 将ZP-1和BX-1单菌落接种于LB液体培养基,置于37 ℃恒温摇床中培养,测定24 h培养物的OD600,并用培养基将其OD600调成一致。将菌液在4 ℃、12 000 r/min离心20 min,取上清液并用0.22 μm无菌过滤器过滤,-20 ℃冻存备用。
1.2.2 毒力因子检测 胞外蛋白酶LasA和LasB:参考Das等[15]的方法,测定ZP-1株和BX-1株上清液中的LasA和LasB活性。
胞外多糖EPS:将1 mL上清液与2.2倍体积的冷冻无水乙醇混合,-20 ℃下孵育1 h后,于4 ℃下3 500 r/min离心20 min。将含有EPS的沉淀溶解在无菌水中,采用苯酚-硫酸法[16]测定胞外多糖EPS含量。
鼠李糖脂:参考Rasamiravaka等[17]的方法,测定ZP-1株和BX-1株上清液中的鼠李糖脂含量。
脓青素:参考Adonizio等[18]的方法,测定ZP-1株和BX-1株上清液中的脓青素含量。
脂多糖LPS:参考Hitchcock等[19]的方法,提取ZP-1株和BX-1株的脂多糖LPS,并采用Tsai[20]的方法对LPS提取物染色。
1.3 ZP-1和BX-1株对小鼠致病性比较
1.3.1 小鼠急性肺部感染模型的建立 (1)菌悬液的制备。采用LB液体培养基,将ZP-1株和BX-1株置于37 ℃恒温摇床中振荡培养过夜,再按照1∶100的体积比重新接种于新鲜LB液体培养基继续培养;菌液以3 000g离心10 min,收集菌体后用无菌的体积分数0.9% NaCl溶液洗涤3次;最后使用分光光度计调整菌液浓度为4×104CFU/μL。
(2)气管插管滴注。小鼠腹腔注射250 μL体积分数0.75%戊巴比妥钠溶液麻醉后,利用无创式气管插管的方法,将22 G留置针插入气管,向试验组(ZP-1组和BX-1组)小鼠滴入制备好的菌悬液,对照组小鼠滴入无菌PBS。滴注完成后,转动小鼠身体1 min左右,使菌液在肺部均匀分布。最后将小鼠置于温暖干净的鼠笼内,恢复清醒。试验组(ZP-1组、BX-1组)以及对照组各接种10只小鼠。该试验独立重复3次。
1.3.2 小鼠慢性肺部感染模型的建立 (1)慢性感染包埋株的制备。采用胰酪胨大豆肉汤培养基(TSB),将ZP-1株和BX-1株置于37 ℃恒温摇床中培养过夜,按照1∶10的体积比重新接种于新鲜的10 mL TSB中培养至OD600为0.8~1.2时,2 700 r/min离心15 min,收集细菌菌体;用1 mL PBS重悬菌体,并充分混匀后加入9 mL未凝固的胰酪胨大豆琼脂糖培养基振荡混匀,缓慢倒入含有150 mL矿物油的锥形瓶中,500 r/min旋转锥形瓶6 min;将锥形瓶置于冰水浴中继续转动35 min后静置20 min;将静置后的上层液体倒入50 mL离心管中,于4 ℃、2 700 r/min离心5 min;移去上油层,用无菌PBS清洗,于4 ℃、2 700 r/min离心5 min,反复清洗、离心直至管内的琼脂球呈肉眼可见的凭自重下落,最后加20~30 mL无菌PBS重悬。吸取少量重悬液于孔板内,通过倒置光学显微镜观察其形态与大小。取500 μL制备好的试验组(ZP-1和BX-1)包埋株进行无菌匀浆,用无菌PBS进行10倍梯度稀释后涂板,调整试验组包埋株浓度为4×104CFU/μL,对照组包埋株做无菌检验。
(2)模型建立。按1.3.1节(2)的方法,将琼脂糖包埋株递入小鼠肺中。试验组(ZP-1组、BX-1组)以及对照组各接种20只小鼠。该试验独立重复3次。
1.3.3 肺泡灌洗液(bronchoalveolar lavage fluid,BALF)的制备 腹腔注射过量的戊巴比妥钠溶液对小鼠实施安乐死。待小鼠死亡后,固定小鼠,用1 mL一次性注射器抽取0.8 mL预冷的生理盐水,通过连接留置针软管注入小鼠气管内,反复抽吸3次,抽出液体放入无菌离心管中,回收率应大于80%。将所得BALF均匀混合后,于4 ℃、1 000 r/min离心10 min,取上清液-80 ℃保存备用;沉淀用于后续的白细胞计数。
1.3.4 肺组织铜绿假单胞菌残留数评估 小鼠肺泡灌洗完成后,取100 μL BALF涂板。然后取小鼠肺脏放入组织研磨管,使用低温研磨机充分研磨,研磨液于4 ℃、1 500 r/min离心10 min,取上清进行10倍稀释涂板。小鼠肺脏的总细菌负荷量由BALF总细菌数和组织总细菌残留数组成。
1.3.5 白细胞计数 用500 μL体积分数0.9% NaCl溶液重悬BALF离心后的沉淀,并取10 μL充分混匀后的重悬液用细胞计数仪计数。若离心后有红色沉淀,采用红细胞裂解液将红细胞完全裂解后再进行白细胞计数。
1.3.6 细胞因子含量检测 采用酶联免疫吸附测定(ELISA)的方法[21],测定BALF中的细胞因子干扰素-γ(interferon-gamma,IFN-γ)、白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-6(interleukin-6,IL-6)含量。
1.3.7 病理组织学观察 取安乐死14 d后的试验组(ZP-1组和BX-1组)以及对照组小鼠肺组织,放入体积分数10%多聚甲醛固定液中固定。待组织固定完全后,经过脱水、石蜡包埋、漂片、摊片和烘片后进行苏木精-伊红H&E染色、镜检。
1.4 数据分析
采用SPSS 20.0软件以及GraphPad Prism 7.00软件处理试验数据并作图,采用单因素方差分析或t检验进行不同组间比较分析。检验水平α=0.05。
2 结果与分析
2.1 铜绿假单胞菌ZP-1和BX-1株的毒力因子检测
由表1可知,BX-1株的胞外蛋白酶LasA和LasB活性略高于ZP-1株,但二者差异不显著(P>0.05);ZP-1株的胞外多糖EPS含量显著高于BX-1株,而鼠李糖脂含量却显著低于BX-1株(P<0.05);ZP-1株的脓青素含量显著高于BX-1株(P<0.05)。

表1 铜绿假单胞菌ZP-1和BX-1株体外毒力因子表达量的比较Table 1 Comparison of in vitro virulence expression of ZP-1 and BX-1 of Pseudomonas aeruginosa
由图1可见,ZP-1和BX-1株的LPS均具有O-抗原,属于平滑性LPS,这与其在固体培养基上的菌落特征相符;但其在核心多糖处的结构具有明显差异。
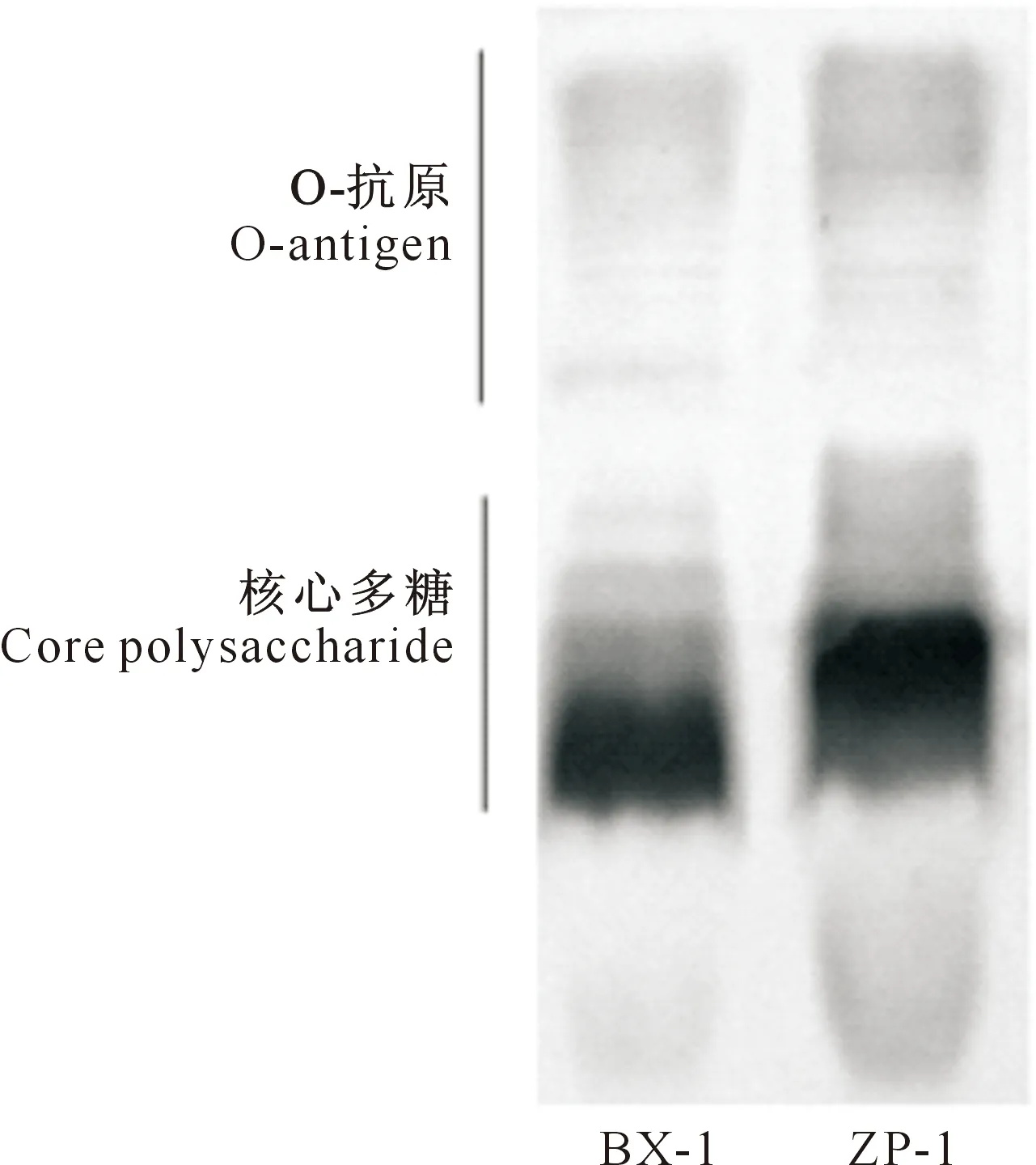
图1 铜绿假单胞菌ZP-1和BX-1株脂多糖结构对比Fig.1 Comparison of lipopolysaccharide structure of ZP-1 and BX-1 of Pseudomonas aeruginosa
2.2 急性和慢性感染ZP-1和BX-1株小鼠致病性的比较
2.2.1 小鼠肺组织铜绿假单胞菌残留数 急性肺部感染时,ZP-1组小鼠肺组织铜绿假单胞菌残留数略高于BX-1组,但二者差异不显著(P>0.05);随着感染时间延长,两组小鼠肺组织铜绿假单胞菌残留数均降低;对照组未检出铜绿假单胞菌(图2-A)。慢性肺部感染时,随着感染时间的延长,ZP-1和BX-1组小鼠肺组织铜绿假单胞菌残留数均呈先降低后升高的趋势;在感染的第3天,ZP-1和BX-1组的铜绿假单胞菌残留数差异显著(P<0.05);对照组未检测出铜绿假单胞菌(图2-B)。综上所述,随着感染时间的延长,无论是急性肺部感染还是慢性肺部感染,小鼠肺组织铜绿假单胞菌残留数均逐渐减少。
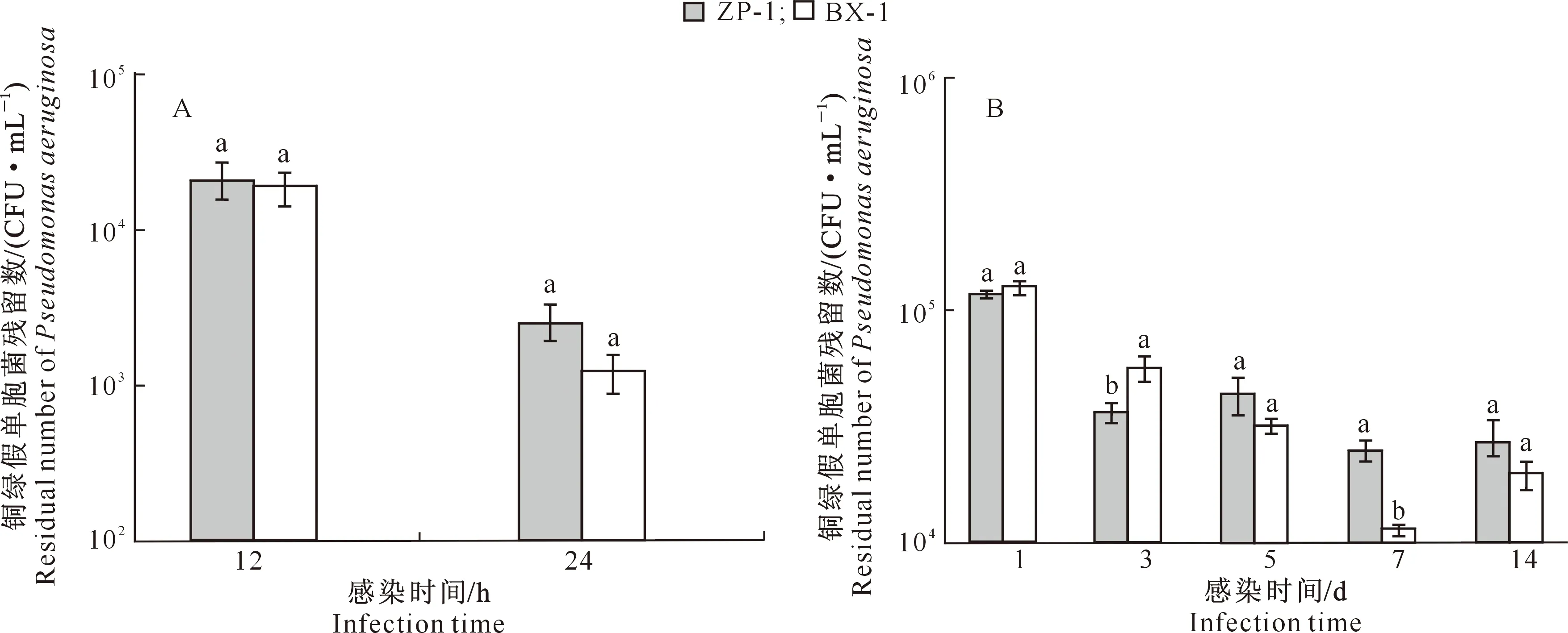
A.急性感染;B.慢性感染A.Acute infection;B.Chronic infection图柱上标不同小写字母表示同一时间不同组间差异显著(P<0.05)。下同Different lowercase letters indicate significant difference (P<0.05). The same below图2 小鼠急性和慢性肺脏感染模型中的铜绿假单胞菌残留数Fig.2 Residual number of Pseudomonas aeruginosa in acute and chronic lung infection models in mice
2.2.2 小鼠BALF中的白细胞总数 急性肺部感染时,ZP-1组小鼠肺泡灌洗液(BALF)中白细胞总数高于BX-1组,但二者差异不显著(P>0.05);随感染时间延长,ZP-1和BX-1组小鼠BALF中白细胞总数均有增加;与对照组相比,ZP-1和BX-1组小鼠BALF中白细胞总数均显著增高(图3-A)。慢性肺部感染时,BX-1和ZP-1组小鼠BALF中白细胞总数的变化趋势相似,均呈先降低再趋于稳定的变化趋势;除感染第3天外,其余感染时间段ZP-1组小鼠BALF中白细胞总数显著高于BX-1组和对照组;对照组小鼠BALF中白细胞总数除在接种的第1天略有升高外,其他感染阶段无明显异常;与对照组相比,ZP-1和BX-1组小鼠BALF中白细胞总数均显著增高(图3-B)。综上所述,随着感染时间的延长,小鼠急性感染时BALF中白细胞总数呈上升趋势,而慢性感染时则相反。白细胞的明显增高表明接种感染性包埋株后,引起了小鼠肺部持续性炎症的发生。
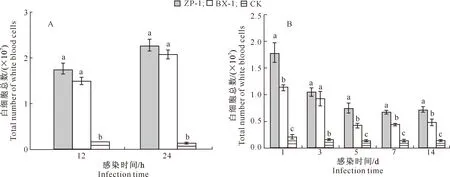
A.急性感染;B.慢性感染A.Acute infection;B.Chronic infection
2.2.3 小鼠BALF中的细胞因子含量 利用酶联免疫法检测试验组(ZP-1组和BX-1组)和对照组小鼠肺泡灌洗液(BALF)中免疫炎性因子IL-1β、IL-6和IFN-γ含量的变化,结果见图4~6。 由图4可知,急性感染阶段,随着感染时间的延长,试验组小鼠BALF中IL-1β含量呈下降趋势。感染12 h时,ZP-1组小鼠BALF中IL-1β含量高于BX-1组;感染24 h时,ZP-1组小鼠BALF中IL-1β含量略低于BX-1组,但二者差异均不显著(P>0.05);与对照组相比,试验组小鼠BALF中IL-1β含量显著升高。慢性感染阶段,随着感染时间的延长,试验组小鼠BALF中IL-1β含量呈逐渐升高的趋势,对照组小鼠BALF中IL-1β含量呈下降趋势。除感染后第14天外,其余感染时间ZP-1组小鼠BALF中IL-1β含量均高于BX-1组;试验组小鼠BALF中IL-1β含量显著高于对照组(除感染第3天外)。
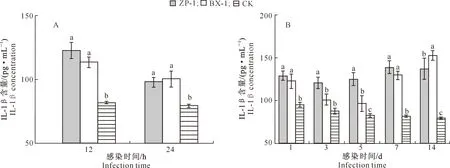
A.急性感染;B.慢性感染A.Acute infection;B.Chronic infection
由图5可知,急性感染阶段,随着感染时间的延长,试验组小鼠BALF中IL-6含量略有降低。感染12 h时,ZP-1组小鼠BALF中IL-6含量显著高于BX-1组;感染24 h时,ZP-1组小鼠BALF中IL-6含量显著低于BX-1组(P<0.05);与对照组相比,感染的各个时期试验组小鼠BALF中IL-6含量均显著升高(P<0.05)。慢性感染阶段,随着感染时间的延长,试验组小鼠BALF中IL-6含量逐渐升高,对照组小鼠BALF中IL-6含量逐渐降低;除感染第14天外,ZP-1组小鼠BALF中IL-6含量均高于BX-1组;与对照比相比,感染各个时期试验组小鼠BALF中IL-1β含量均显著升高。
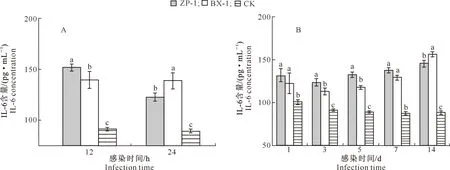
A.急性感染;B.慢性感染A.Acute infection;B.Chronic infection
由图6可知,急性感染阶段,随着感染时间的延长,小鼠BALF中IFN-γ含量逐渐降低;感染12和24 h,ZP-1组小鼠BALF中IFN-γ含量均高于BX-1组,其中感染12 h时二者差异不显著,感染24 h时二者差异显著(P<0.05);与对照组相比,试验组小鼠BALF中IFN-γ含量均显著升高。慢性感染阶段,随着感染时间的延长,试验组小鼠BALF中IFN-γ含量逐渐降低,对照组小鼠BALF中IFN-γ含量无明显异常;同一感染时期ZP-1组和BX-1组小鼠BALF中IFN-γ含量差异不显著(P>0.05),但二者均显著高于对照组(P<0.05)。
2.2.4 小鼠肺脏组织病理学观察 从小鼠急性感染后24 h的肺组织病理切片结果(图7)可以看出,ZP-1组和BX-1组均有明显的宿主损伤以及炎症浸润;大面积肺泡壁增厚,肺泡腔狭窄,可见大量粒细胞、红细胞散分布;支气管上皮细胞形态正常,少量支气管内可见粒细胞浸润;肺泡腔内及支气管内广泛可见粒细胞散在分布;对照组无明显异常。
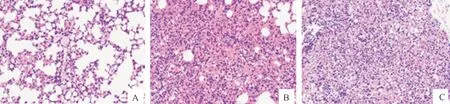
A.对照组;B.ZP-1组;C.BX-1组A.Control group;B.ZP-1 group;C.BX-1 group图7 小鼠急性肺部感染的组织切片(感染24 h)(HE×200)Fig.7 Tissue section of acute lung infection in mice(24 hours after infection)(HE×200)
从小鼠慢性感染第14天的肺组织病理切片结果(图8)可以看出,与对照组相比,ZP-1组和BX-1组小鼠的肺组织虽然仍有肺泡结构,但肺泡间隔明显增厚,且具有明显的炎性细胞浸润。
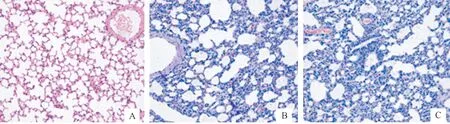
A.对照组;B.ZP-1组;C.BX-1组A.Control group;B.ZP-1 group;C.BX-1 group
3 讨 论
铜绿假单胞菌是一种革兰氏阴性机会病原体,具有强大的基因组和环境适应能力。绿脓菌素是铜绿假单胞菌的重要毒力因子,不仅能促进生物膜的形成,还具有诱导多药外排泵的表达等作用。研究显示,不同铜绿假单胞菌分离株的绿脓菌素分泌水平差异很大,可能是由于适应宿主导致毒力表达降低[22-23]。比较野生型和绿脓菌素缺陷的铜绿假单胞菌菌株发现,绿脓菌素缺陷型铜绿假单胞菌导致更高的死亡率,并且在大鼠的肺气道中诱导更广泛的肺泡壁增厚[24]。但目前针对绿脓菌素分泌缺陷的大部分研究都是选择性缺失掉phzM基因后得到的结果[25],只有较少文献研究绿脓菌素缺陷的野生型。选择性缺失导致的表型消失是人为介导的改变,而野生株的出现是在与宿主动态相互作用中逐渐形成的,所以对野生株的深入研究具有一定临床意义。
细菌的致病性与其毒力密切相关。本研究体外毒力检测发现,ZP-1株分泌LasA和LasB的能力略低于BX-1株,但二者差异不显著,表明在感染阶段ZP-1株和BX-1株对宿主分泌的细胞介质的降解能力差异不大。鼠李糖脂在铜绿假单胞菌侵袭宿主时具有抵抗先天性免疫的作用。本研究中ZP-1株的鼠李糖脂分泌量低于BX-1株,该结果与预期相符,这是由于绿脓菌素会间接促进鼠李糖脂的合成;ZP-1株可产生大量的脓青素,脓青素不仅是铜绿假单胞菌重要的铁载体,同时也能上调外毒素A表达的信号通路[26];ZP-1株和BX-1株的LPS在核心多糖处的结构有明显差异,致病性可能有所不同,需要进一步试验证实。
本研究中,选择小鼠为建模动物,采用无创式气管插管以及制备琼脂糖包埋株的方法,建立小鼠肺部感染模型。急性肺部感染通常会引起压倒性的宿主损伤;而在慢性肺部感染期间,铜绿假单胞菌会调整自身的侵袭力和毒力以达到适应宿主环境,与宿主长期共存。目前常见的慢性包埋株载体主要有琼脂糖和海藻酸盐等。本试验选择琼脂糖作为包裹载体,因其能够提供一种微厌氧环境,并具有从单细胞发展到微菌落的细菌繁殖所需的基本养分。在肺部感染阶段,宿主会启动炎症反应来抵抗入侵的病原体。由微生物感染引起的主要促炎性细胞因子包括IL-1β和IL-6等,其能协调白细胞募集至感染位点[27]。随着感染时间的延长,肺部炎症也会持续发生,其中BALF中的白细胞水平反应了肺部炎症的感染免疫应答水平[28]。本研究所建立的小鼠肺部急性、慢性感染模型中,ZP-1组小鼠引起宿主的炎症水平均高于BX-1组;在急性感染过程中,ZP-1和 BX-1株在感染12 h后虽然小鼠机体逐渐清除了细菌,但是炎症仍在发生;在慢性感染过程中,ZP-1和 BX-1组小鼠BALF中IL-1β和IL-6含量呈逐渐升高的趋势,而IFN-γ含量则是逐渐降低,说明所建立的小鼠感染模型是成立的。
综上所述,铜绿假单胞菌ZP-1株和BX-1株的毒力因子分泌侧重不一样,ZP-1株引起肺部感染小鼠的致病性较BX-1株更强。

