我国哈氏仿对虾资源分布、保护及开发利用现状
乔 毅,沈 辉,蒋 葛,成 婕,曹晓慧,窦雅斌,刘学实,万夕和,史文军,王李宝,黎 慧,贲成凯,孙瑞建
(1.江苏省海洋水产研究所,江苏南通 226007;2.上海海洋大学,上海 201306;3.南京师范大学,江苏南京 210023)
哈氏仿对虾Parapenaeopsis hardwickii 隶属节肢动物门,甲壳纲,十足目,对虾科,仿对虾属,又称金钩虾、滑皮虾、条虾、炝虾等,是一种热带、亚热带浅海区广温广盐的暖水性中型虾类,主要分布在我国黄海南部、东海和南海以西以及巴基斯坦、印度东西岸、孟加拉国、马来西亚、新加坡、加里曼丹岛、日本等近岸浅海海域[1-3]。哈氏仿对虾营养价值非常高,可鲜食也可加工成海米,深受消费者的喜爱[4]。哈氏仿对虾自然产卵繁殖周期长、繁殖力强、生长速度快,当年孵化的幼体可在秋冬季形成虾汛,是我国近海沿岸定置张网和桁杆拖虾网作业主要的捕捞对象之一,也是我国重要的出口创汇经济虾类品种[5]。
我国关于海水虾类资源的研究起步较晚,零星研究始于20 世纪30 年代,50 年代主要进行大规模调查研究,早期研究主要集中在虾类的发现和分类鉴定,随后开展资源系统调查和渔场调查等,目前主要在大规模调查的基础上对各品种的生物学和生态学调查分析[6]。20 世纪70 年代我国逐渐加强海水虾类资源的利用,随着捕捞船只的剧增和捕捞技术的进步,海洋虾类资源的捕捞量不断突破,但随着近些年捕捞强度增强和海洋环境的变化,海水虾类资源的捕捞量发生了巨大的变化,据中国渔业统计年鉴显示海水虾类捕捞量由2016 年的1 587 522 t 下滑至2020 年的1 206 347 t,捕捞产量下降24.01%,由此可见我国海洋捕捞虾类资源量正在快速萎缩。哈氏仿对虾作为我国沿岸海域重要的对虾资源之一,目前正面临着自然资源量锐减、产卵场破坏和生长环境恶化等问题,其资源保护和人工干预措施等相关研究滞后。本文对目前我国哈氏仿对虾的研究现状进行概述,以期对该资源的合理开发和有效保护以及实现人工增养殖提供参考。
1 哈氏仿对虾的生物学及栖息特点
1.1 生物学形态特征
哈氏仿对虾甲壳较薄,体表除深陷的沟处有较长的软毛外,其他处光滑,身体呈微紫红色,成体雌虾体长为70~140 mm,雄虾体长为50~80 mm。雄性额角异形,一种额角较长,为雌雄共有,前端约2/5 向上隆起,末端尖锐,明显超出第一触角柄末端,额角齿式7~8/0(不包括胃上刺),上缘末半部无齿,额角后脊具中央沟;另一种额角较短,微微下弯,末端尖,似匕首形,伸至第一触角柄第2 节中部,约为头胸甲长的4/5,上缘7~8 齿,分布于额角全长,下缘无齿,额角后脊几乎伸至头胸甲后缘,额角侧脊及侧沟伸至胃上刺下方消失。纵缝伸至头胸甲2/3 至4/5 处。眼睛较大,眼柄粗短,眼后沟和心鳃沟不明显,颈沟和肝沟较深。第4~6 腹节背面具纵脊,第6 腹节背脊末端和两侧后下方各有1 锐刺。第1、第2 对步足具基节刺和肢鳃,5对步足皆具外肢。雄性交接器:侧叶基部有1 耳状突,侧缘在侧突与耳状突之间较直,端侧突较小,朝向两侧,端中突近三角形,顶端圆,形呈花瓶状。雌性交接器:前板半椭圆形,前缘圆,腹面显著凹陷,形成纳精囊,后板宽大,前缘微突,前侧角前突末、胸节腹甲后脊之后中央不具1 丛长毛[4,7]。
1.2 摄食习性和繁殖习性
哈氏仿对虾可栖息于各种不同地质的海底[5],以泥沙质底为主,具有潜沙习性,为杂食性虾类,主要摄食浮游生物和游泳生物,也摄食底栖生物,主要包括虾类、桡足类、硅藻类、小型鱼类、双壳类、多毛类、沙壳纤毛虫类、有孔虫类、鞭毛虫类、放射虫类、腹足类、端足类、黄藻类、绿藻类及短尾类等类群[4]。哈氏仿对虾的生长速度较快,从夏季开始繁殖至翌年夏季为一个生长周期,经历夏秋和翌年春夏2 个快速生长期后性逐渐成熟,繁殖期结束后大个体群体消失,可能与繁殖后大规模死亡有关,其极限年龄为1.323 4 岁[2,8]。哈氏仿对虾雌雄个体规格差异明显,雌性体长和体重显著高于雄性,生长周期中其雌雄个体比例有较大变化,生长期11 月至翌年3 月,雌雄比较为接近,繁殖期的5 月至12 月雌性个体明显多于雄性个体,特别是在6—7 月繁殖旺季,雌雄性比高达4 左右,甚至雌性个体占到98.8%,推测繁殖季雄性虾交尾后体力衰竭死亡所致[4,9]。
哈氏仿对虾为雌雄异体,异体受精,生殖方式为具有闭锁式纳精囊的排卵型生殖,调查发现雄性个体最大体重和体长出现在5 月,雌性主要出现在5—7 月,可推测其交尾主要集中在5 月[8]。哈氏仿对虾的性腺发育可分为6 期,其发育特点和分布情况详见表1[8,10]。哈氏仿对虾的产卵时间在不同海区有所差异,其中南黄海和东海主要在5—8 月,南海主要在3—5 月[1,4,11-12],雄虾性成熟后与退壳期的雌性交尾,将精荚传递给雌虾,储存在纳精囊中,当雌虾性成熟后一边产卵,一边将纳精囊里的精子释放水中与卵结合完成受精,哈氏仿对虾性腺分批成熟产卵[7,13],产卵时间多为夜间,高峰期在22∶00 前后,其卵为沉性[3,14]。
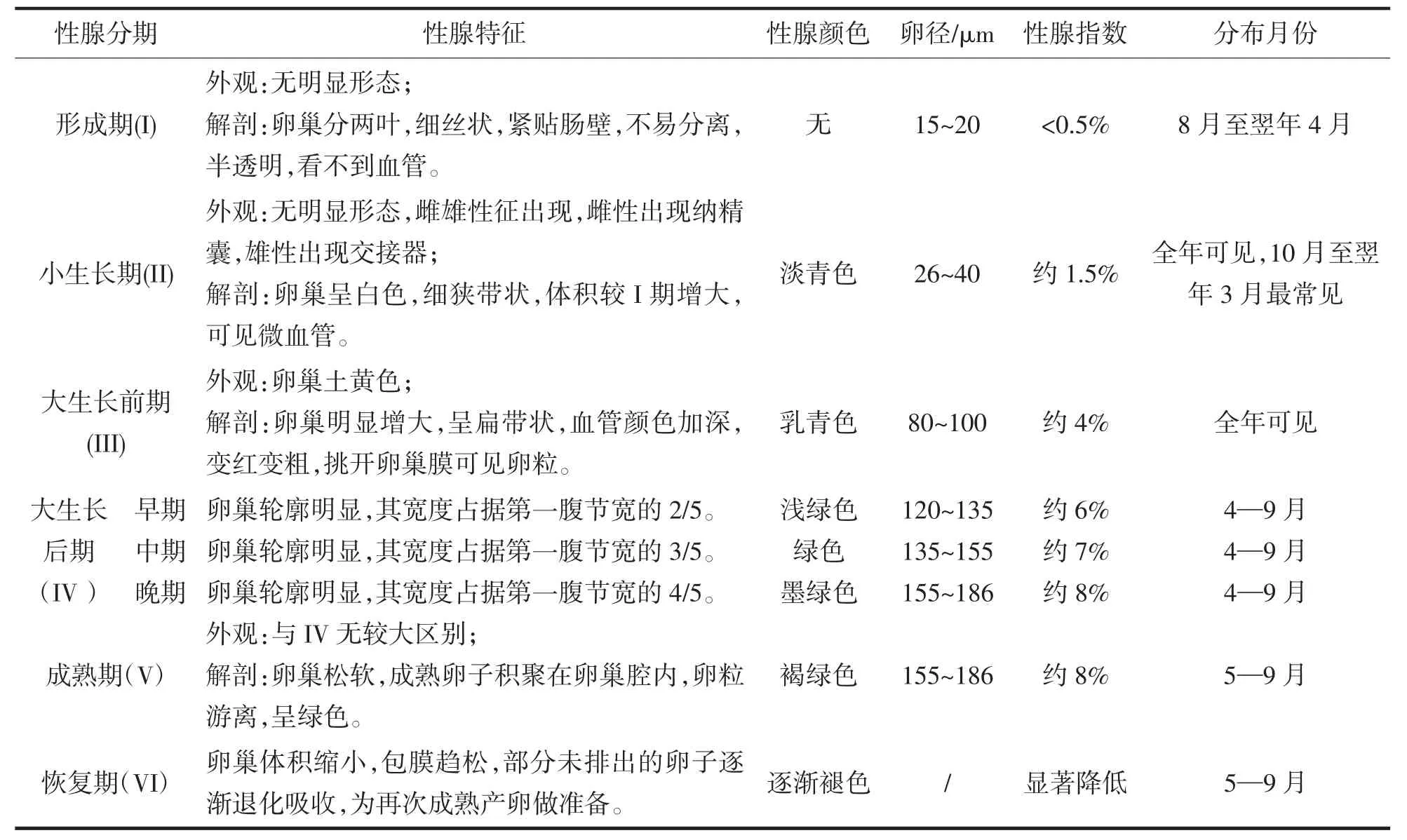
表1 哈氏仿对虾性腺发育特点Tab.1 Characteristics of gonad development of P.hardwickii
1.3 栖息习性及环境适应性
哈氏仿对虾为广温广盐的暖水种,在我国沿岸海域分布较广,主要分布水深5~70 m,其中30°00' N以北主要分布在60 m 水深沿岸海域,受长江入海冲淡向东扩展影响,其可分布到127°00' E 水深100 m的海域,30°00' N 以南,只分布在70 m 深以内浅海[8]。受水温、盐度和饵料的变化,哈氏仿对虾分布还有明显的季节变化,其一般分布在水温10~24 ℃,盐度30~34,饵料丰富的海域,随季节作东西和南北短距离移动。8—10 月,随着台湾暖流水向北推进,内外侧海区均有分布,此季节在近岸张网渔获物中占有一定比例,出现率为全年的最高;秋末(11 月),随着水温下降,哈氏仿对虾密集中心向东南部外侧海区移动,在外侧海区沙泥质海底越冬;3—5 月,随着水温上升,近岸海域饵料生物逐渐丰富,哈氏仿对虾逐渐由外海向近海移动,进行索饵和产卵洄游[8,11,15],是夏季张网和拖网的优势种。
2 哈氏仿对虾的分布及遗传多样性
2.1 资源分布情况
哈氏仿对虾在我国黄海南部、东海和南海沿岸海域均有分布,以东海的资源量最为丰富,目前的调查发现该资源北起苏北浅滩辐射沙脊群海域,向南的长江口外侧高盐度水域,浙江整个沿岸海域和外侧群岛附近,福建沿岸水域及台湾海峡,以及雷州半岛和琼州海峡等均有分布,受水温、盐度、饵料丰富程度和时空生态位竞争的影响,哈氏仿对虾在各海域的分布丰度和集中时间存在差异,如表2 所示。在胶州湾、山东半岛等黄海北部和渤海湾海域目前暂未见该资源分布的报道[16-18]。

表2 我国哈氏仿对虾资源分布调查情况Tab.2 Survey on the distribution of resources of P.hardwickii in China
2.2 遗传多样性
了解种群遗传结构是渔业资源有效、可持续长期管理的重要组成部分,对海洋生物群遗传结构的分析表明,具有高分散能力的生物在大地理层面上几乎没有遗传分化。国内关于哈氏仿对虾遗传多样性研究较晚,早期关于S 形额角与匕首形额角的仿对虾是否为哈氏仿对虾与刀额仿对虾Parapenaeopsis cultriostris同物异名存在争议[5],徐琰等[52]利用仿对虾属线粒体DNA 的16S rRNA 基因片段和细胞色素氧化酶亚基I基因片段(COI)序列差异,分析了哈氏仿对虾与其他种的系统演化关系,结果发现16S rRNA 基因的变异率为0,COI 基因的变异率仅0.058%,认为哈氏仿对虾与刀额仿对虾为同一个种。毛智超等[53]通过COI 基因分析,发现哈氏仿对虾是仿对虾属独立的分支,与细巧仿对虾P.tenlla 和亨氏仿对虾P.hungerfordi 种类亲缘关系较近,并非其姊妹种。根据遗传距离推测出仿对虾属的大致分化时间发生在中新世末期至上新世早期,这与李晓玲等[54]的研究结果吻合。
随后对我国东海、台湾东北部宜兰、台湾中西部台中和台湾西南部车埕海区收集的4 个哈氏仿对虾地理种群进行线粒体控制区序列扩增,分析种群遗传结构,结果发现线粒体的AT 碱基含量非常丰富(85.9%),共观察到296 个可变位点,包括203 个单基因位点和93 个简约信息位点,所有样本的单倍型多样性均较高(99.6%),核苷酸多样性都很低(0.77%),共定义153 个单倍型,虽然95%的简约网络没有地理结构,但所有样本的FST 值均存在显著的遗传变异(FST=0.014 6,P<0.01)。其中宜兰与其他样本之间的两两FST值存在显著的遗传差异,但其他3 个样本之间的遗传变异不显著。所有两两比较之间的Nm值范围从8.413 5(宜兰-车埕)到111.003 5(东海-车埕)。4 个样本的UPGMA 树分为2 个不同的组,宜兰构成一组,其他3 个样本组成一组。分子方差(AMOVA)分析也显示宜兰地区与其他样本之间存在显著的遗传差异。(2~1.5)万年前最后一个冰川期,台湾海峡海平面下降导致东海、车定和台中地区水位下降成一条槽,栖息地缩小,导致种群混合,降低种群间的遗传差异,与宜兰地区的种群发生地理阻断。随着海平面的上升,大约在11 400 年前哈氏仿对虾发生过大规模扩张,其分布范围扩大,这与该地区高单倍型多样性和低核苷酸多样性的哈氏仿对虾遗传特性相吻合[55]。另外,通过对东海北部和台湾淡水镇、台中、普台和车埕的哈氏仿对虾延伸因子-1α 基因内含子进行序列分析,207 份样品中共鉴定出102 个等位基因,78 个可变位点,包括46 个单基因位点和32 个简约信息位点,除东海北部样本均有常见的等位基因,尽管等位基因没有系统地理结构,但两两的FST值和分子方差分析(AMOVA)显示,东海北部的样本与其他样本之间存在显著的遗传差异。5 个样本的UPGMA 树显示2 个不同的聚类,东海北部的样本聚为一支,台湾海峡4 个地区的样本聚为一支。102 个等位基因的中位连接网络呈星状,没有明显的等位基因聚类,这表明哈氏仿对虾最近可能经历了种群扩张[56]。但是黄海和东海区域的哈氏仿对虾样本的核苷酸多样性分别为0.001 87 和0.021 5,单倍型多样性分别为0.818 和0.822,从COI 基因多样性值来看,黄海和东海的哈氏仿对虾样本没有明显的地理结构差异,AMOVA 和成对FST显示该群体无明显的遗传分化[57]。
目前普遍认为海洋生物种群之间存在着高水平的基因流动,具有比预期更稳定的基因结构,通常表现出低水平的遗传分化。我国哈氏仿对虾随季节变化在沿岸做东西和南北的短距离迁移,其卵以及幼虾、成虾游泳力较弱,受到洋流影响较大,在海洋环流的驱动下促进了哈氏仿对虾的基因流动,但是在冰川期引起的海平面高度的变化,地理阻隔改变了哈氏仿对虾的栖息环境,其种群经历过不同程度的收缩和扩张,导致其种群一定程度上发生遗传多样性分化。
3 哈氏仿对虾资源量变化及保护现状
3.1 资源变化情况
哈氏仿对虾是我国海水对虾资源的重要捕捞对象之一,其在浙江沿岸海域资源量最为丰富,20 世纪90 年代浙江北部海域哈氏仿对虾年平均资源量可达14 430.4 t,其中2 月高达43 056.7 t,浙南年平均资源量为2 034.6 t,10、11 月可达16 498.9 t,浙江全年平均资源量为16 465 t,可捕捞量为13 172 t,其捕捞量占渔获量比重较高,部分地区高达70%~90%[1,7,11-12,24]。1998 年宋海棠等[8]再次对浙江海域的哈氏仿对虾资源量进行取样评估,其资源量仅4 000 t,相比90 年代初缩减75.8%,2013 年其资源量为5 260.6 t,虽有所回升,但相比90 年代初还是下降了68%[48]。2000 年,李明云等[2]对东海北部哈氏仿对虾的利用率进行评估,发现其利用率为67.06%,根据格雷厄姆(Graham)提出的S 形曲线理论,即种群的最适利用率为50%,表明目前哈氏仿对虾群体已属于过度利用状态。哈氏仿对虾是舟山渔场重要的虾类资源,有研究表明官山附近以及浙江沿岸哈氏仿对虾逐渐失去优势地位[58-59],大量拖网和桁杆拖网对体长30~50 mm 的幼龄哈氏仿对虾进行捕捞是主要原因之一[9]。在中街山列岛哈氏仿对虾由2010—2018 年,哈氏仿对虾由常见种上升为优势种,可能与近年海区水温上升导致冬季捕捞量增加相关,综合时间与空间生态位的分布,哈氏仿对虾的生态位宽度整体偏低,说明其在该海域的生存状况较差[27-28]。由此可见,我国哈氏仿对虾资源正受到过度开发利用,其资源量在不断锐减。
3.2 资源保护现状
关于我国哈氏仿对虾的资源保护措施早在20 世纪90 年代就开始提出:(1)建议控制渔船数量过快增加,限制网目的大小和渔船的马力,严禁使用惊虾仪等诱捕工具[60],合理安排渔场,向更深的海域拓展,开发利用高盐度虾类资源,降低对哈氏仿对虾的捕捞强度[12],有研究发现增加捕捞强度已不能提高哈氏仿对虾的产量,反而会降低产值,所以适度开发有利于对该资源的可持续利用;(2)保护哈氏仿对虾的产卵场,例如在禁渔线以西的浙北海区设置虾类禁渔区,并在其他海区设定7 月15 日至9 月30 日的禁渔期[2],保障哈氏仿对虾的繁殖量,从而增加补充群体数量,也有建议春夏季为哈氏仿对虾的索饵和产卵时间,应对该资源进行合理保护,冬季进行捕捞为宜;(3)控制哈氏仿对虾的开捕体长在70 mm 以上,避免对规格偏小的补充群体资源的破坏,有研究表明开捕体长70 mm 时,单位补充量产量达到最大,开捕体长达到80 mm时,单位补充量的产值达到最大[2];(4)开展哈氏仿对虾人工繁育技术攻关,通过人工增殖放流的形式补充自然繁殖量不足的问题,另外可以建设人工鱼礁,人为改善海底生态环境,为哈氏仿对虾的索饵、生长发育和产卵提供庇护,达到保护增殖和提高渔获的目的,促进哈氏仿对虾资源的可持续发展。
4 哈氏仿对虾的人工繁育现状
4.1 哈氏仿对虾的营养价值
哈氏仿对虾含肉率高达55.27%,粗蛋白、粗脂肪和粗灰分含量分别为18.91%、1.12%和1.80%,相较于其他虾均处于较高水平,肌肉中富含18 种常见氨基酸,包括人体所需的8 种必需氨基酸,尤以谷氨酸、天冬氨酸、精氨酸和赖氨酸含量最高。哈氏仿对虾的鲜味氨基酸含量也非常高(32.54%),显著高于南美蓝对虾Penaeus stylirostris、凡纳滨对虾Litopenaeus vannamei、安氏白虾Exopalaemon annandalei 和日本沼虾Macrobrachium nipponense,尤其以第一鲜味谷氨酸含量极高。哈氏仿对虾肌肉中除了富含氨基酸外,脂肪酸含量也相当丰富,共检测到21 种脂肪酸,包括9 种饱和脂肪酸,单不饱和脂肪酸和多不饱和脂肪酸各6种,其中不饱和脂肪酸含量高达55.99%,多不饱和脂肪酸31.58%,DHA+EPA 含量达到23.58%。另外哈氏仿对虾肌肉中还含有丰富的钾、钠、钙、镁、磷、铁、锌等13 种常量及微量元素[61-62]。由此可见哈氏仿对虾肌肉中粗蛋白、氨基酸、脂肪酸和矿物元素含量丰富,是一种营养价值丰富、味道鲜美的食品。
4.2 人工繁育现状
哈氏仿对虾具有诸多优点,是一种非常具有人工养殖前景的海水虾类,金忠文等[3]2002 年率先开展其人工繁殖技术研究,于7 月底从象山港口收集一定数量性腺发育良好的哈氏仿对虾,参照中国对虾Fenneropenaeus chinensis 人工育苗的技术方法开展哈氏仿对虾育苗工作,亲虾运回基地后存活率达到67.6%,当天夜里虾就开始产卵,其孵化率达到65%,幼体发育经历无节幼体、蚤状幼体、糠虾幼体后变态发育成幼虾,期间获得了幼体发育的形态特征相关资料,共培育出体长0.6 cm 的虾苗20 余万尾,育苗期间发现蚤状幼体1 期和糠虾幼体阶段出现2 个高死亡峰,认为与幼体染菌和未找到适口饵料有关。张曹进等[63]2010 年在吕四近海收集性腺发育良好的哈氏仿对虾,参照中国对虾人工育苗方法并加以改进,孵化率提高到75.5%,共培育出体长0.5~0.75 cm 幼苗300 余万尾,发现以湛江叉鞭金藻Dicrateria zhanjiangensis作为开口饵料,进而投喂扁藻Platymonas sp.、青蛤Cyclina sinensis 受精卵和文蛤Meretrix meretrix 担轮幼虫等生物活饵,育苗工作取得了较好成效。并发现哈氏仿对虾幼苗对盐度的适应能力较强,无节幼体期布苗密度不超过20 万尾·m-3为宜,最终因为饵料和管理问题,虾苗大批死亡,未能开展人工养殖研究。2012年刘建忠等[14]在台州和舟山海域收集到大量哈氏仿对虾,通过海水晶配制人工海水进行育苗,整个过程中亲虾存活率高达85%以上,孵化率73.9%,经过25 d 培育出体长约1.5 cm 的虾苗20 余万尾,苗种存活率66.56%,取得了幼体发育各个阶段的显微照片,哈氏仿对虾变成仔虾后残杀性严重,后期存活率较低。由此可见,目前我国哈氏仿对虾的人工育苗工作取得了一定成果,为其后续的进一步研究留下了宝贵的资料,但均未能延续其人工养殖工作。
5 总结与展望
哈氏仿对虾作为我国重要的海洋虾类资源之一,在我国南黄海以南近岸海域均有分布,是优质的海水虾类产品,也是我国海捕经济虾类及出口创汇的重要组成部分。目前我国关于哈氏仿对虾研究主要集中在资源的调查方面,通过近年的调查发现我国哈氏仿对虾资源量在不断减少,虽然通过近些年的海洋资源保护和管理其资源量有所回升,但目前的形势依然不容乐观,关于开展该资源的保护迫在眉睫。对其资源的保护个人有两方面建议,一方面,加强海洋渔业资源的系统调查,准确掌握该虾的繁殖、洄游和生长习性,从而有针对性地设置产卵场、索饵场保护区和保护期,制定合理的捕捞政策,加强渔业保护的宣传力度和执法力度,提高渔民素质,树立起海洋渔业资源保护意识,让哈氏仿对虾自然资源量得以恢复和可持续利用;另一方面,加大科研力量和技术的投入,早日突破哈氏仿对虾的规模化人工繁育技术,通过开展人工育苗进行增殖放流,补充海洋资源量,同时推进该虾的人工养殖技术攻关,实现哈氏仿对虾的全人工养殖,减少消费者对野生资源的依赖。近些年,水产研究工作者在哈氏仿对虾的人工育苗方面进行了大量的研究,积累了丰富的经验和技术,但仍未实现该资源的规模化人工繁育,主要的障碍在于优质亲虾获取难度较大,暂养和驯化存活率较低,幼体开口饵料和病害防控问题未解决等。后续研究中可在现有基础上借鉴南美白对虾的繁育技术,提高硬件设施和设备投入,降低环境条件对繁育工作的影响;幼体投喂成熟的商品开口饵料(如虾奶粉),保证饵料的适口性、安全性和营养均衡,提高虾苗质量和存活率;另外,在前期开展的哈氏仿对虾病原的调查过程中发现野生群体白斑综合征病毒的携带率非常高,利用无特定病原(SPF)技术繁育健康种苗等显得尤为重要,为今后突破哈氏仿对虾的规模化育苗提供新的思路。目前我国关于哈氏仿对虾资源的保护、人工繁育和实现人工养殖还面临着巨大挑战,但相关工作的开展对该资源的保护和合理开发利用具有重要前景和意义。

