中介素通过激活AMPK信号通路对脂多糖诱导巨噬细胞极化的影响
王艳红,田继华,杨 佳,薛 媛,张婷婷,于培霞
(1.山西医科大学微生物学与免疫学教研室,山西 晋中 030600;2.山西白求恩医院检验科,山西医学科学院,同济山西医院,山西医科大学第三医院,山西 太原 030032;3.华中科技大学同济医学院附属同济医院,湖北 武汉 430030)
巨噬细胞是人体重要的固有免疫细胞之一,有高度异质性和可塑性,在不同微环境刺激下可极化为M1和M2型[1]。巨噬细胞极化对多种疾病的病理有重要影响。M1/M2型巨噬细胞比例失衡是许多炎症性疾病的病理标志,如肥胖、动脉粥样硬化等,并与肿瘤预测、转移、预后有重要关系。因此,巨噬细胞M1/M2的动态平衡在维持内环境稳态中具有重要作用[1]。研究发现,巨噬细胞TLR2、TLR4活化后,M1型巨噬细胞占主导作用,其介导的炎症反应在类风湿关节炎(rheumatiod arthritis,RA)等自身免疫病的发病过程中起决定性促进作用[2],而抑制M1型巨噬细胞的促炎效应则会恢复组织稳态,促进炎症转归[3]。因此深入探索巨噬细胞极化所涉及的分子信号机制可能为临床治疗相关疾病提供新的治疗靶点[3]。
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一种酶复合体,是重要的细胞代谢感受器,调节能量代谢,在炎症反应中也起到调节作用[4],研究报道AMPK可促进抗炎性的M2巨噬细胞极化[5]。Wang等[6]用二甲双胍治疗癌症时,激活AMPK途径可以诱导巨噬细胞表型的转化。中介素(intermedin,IMD)属于降钙素基因相关肽家族成员,是一种具有潜在器官保护作用的内源性多肽[7],大量研究表明IMD具有抗氧化、抑制炎症、心脏保护,减轻急性肾损伤等作用。本研究组前期研究证实IMD能显著减轻炎性反应,下调肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、基质金属蛋白酶(matrix metalloproteinase-9,MMP-9)等致炎因子的表达[8]。Chiang等[9]研究发现,IMD1-53通过激活AMPK途径,增强血管生成并减轻心肌梗塞后的不良重塑;抑制内质网应激,从而防止心脏肥大;逆转同型半胱氨酸血症诱导的巨噬细胞M1/M2比例的失调,促进巨噬细胞由M1型向M2型转化[10]。但其对巨噬细胞极化进程中涉及的具体分子机制鲜有报道。本研究通过采用脂多糖(lipopolysaccharide,LPS)刺激体外培养小鼠巨噬细胞系RAW 264.7,研究IMD对其炎症分子的表达及极化表型的影响,以探讨IMD调节巨噬细胞极化的机制。
1 材料与方法
1.1 材料小鼠巨噬细胞系RAW 264.7(上海细胞库),IMD1-53(美国phoenix公司),LPS、Compound C(美国Sigma公司),兔抗TNF-α(ab183218)、IL-6(ab214429)和IL-10(ab189392)(美国Abcam公司),兔抗p-AMPK(2537)和AMPK(2532)(美国CST公司)。TNF-α、IL-6 ELISA试剂盒(美国Cusabio公司),APC-anti CD86(105011,美国Biolegend公司)。
1.2 细胞分组取传代 3~4代的 RAW264.7细胞接种于6孔板,细胞随机分为正常对照组、LPS处理组(1 mg·L-1LPS处理4 h),IMD+LPS处理组(预先用20 μg·L-1IMD处理巨噬细胞2 h,再加入1 mg·L-1LPS处理4 h),AMPK抑制剂Compound C组(LPS+IMD+CC):预先用AMPK抑制剂Compound C 1 μmol·L-1处理1 h,余同IMD+LPS组。
1.3 实验方法
1.3.1Real time PCR检测相关基因mRNA表达 TRIzol法提取总RNA,取1 μg反转录成cDNA,引物由上海生工生物工程有限公司合成,序列见Tab 1,按照SYBR Green PCR matter mix说明书进行realtime PCR检测,反应条件为95 ℃,30 s预变性;5 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s 40个循环,数据按2-ΔΔCt的方法分析相对浓度。

Tab 1 Primer sequences
1.3.2Western blot检测相关蛋白表达 裂解细胞提取胞质蛋白,采用BCA法检测蛋白浓度,SDS-PAGE进行电泳分离,转膜,封闭(5%脱脂奶粉)1 h。分别加入一抗TNF-α(1 ∶1 000)、IL-6(1 ∶2 000)、IL-10(1 ∶1 000)、p-AMPK(1 ∶1 000)和AMPK(1 ∶1 000)于4 ℃孵育过夜,TBST洗膜3次后加入羊抗兔抗体(1 ∶5 000)37 ℃孵育1 h,TBST洗膜后ECL化学发光法显色,应用Quantity One分析蛋白的相对表达量。
1.3.3流式细胞术检测巨噬细胞极化特征性分子 收集细胞,用4 ℃预冷的PBS清洗,4 ℃ 1 000 r·min-1离心 5 min,弃上清;加入100 μL染色缓冲液(1% BSA-PBS)中重悬,加入流式抗体APC-anti CD86,4 ℃避光孵育1 h,缓冲液洗涤3次,离心,500 μL染色缓冲液重悬细胞,上流式细胞仪检测,实验重复3次。
1.3.4ELISA 法测定IL-6、TNF-α浓度 收集细胞悬液,4 ℃ 2 000 r·min-1离心10 min,收集上清-20 ℃保存,IL-6、TNF-α按照试剂盒说明书测定。

2 结果
2.1 IMD对AMPK信号通路的影响采用Western blot法检测了p-AMPK及AMPK蛋白表达,结果如Fig 1所示。与对照组及LPS组比较,IMD处理组可见p-AMPK表达水平上调(P<0.01),且p-AMPK/AMPK比值也上调,提示IMD对AMPK通路有激活作用。
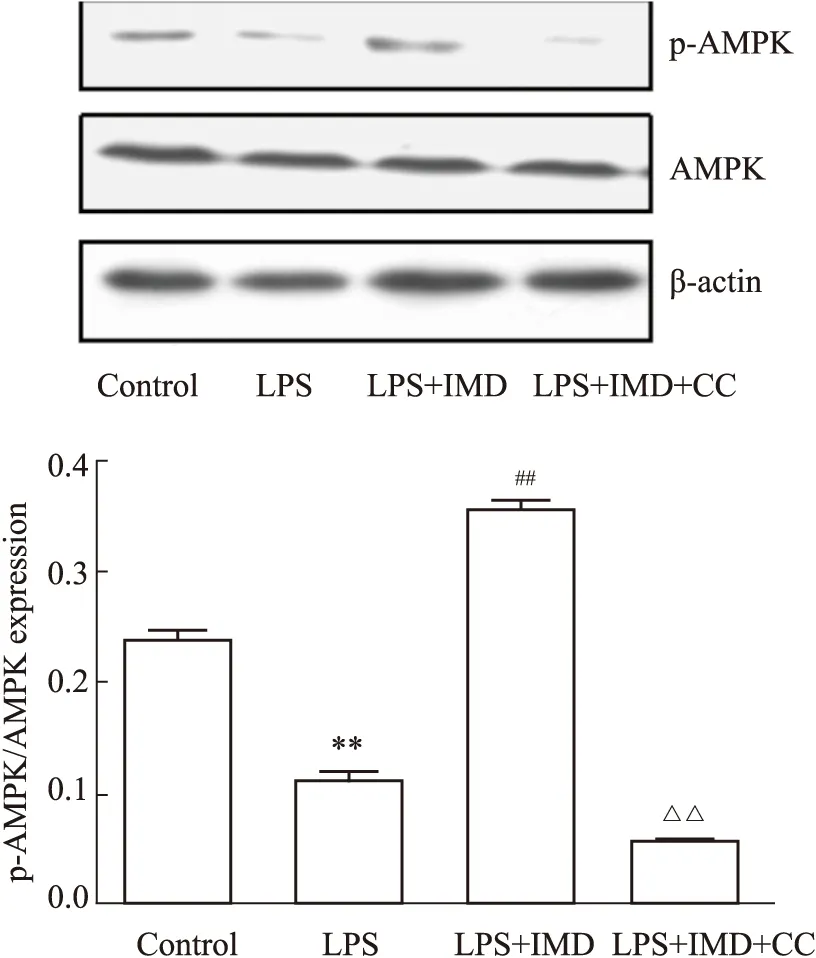
Fig 1 The protein levels of p-AMPK and AMPK in different groups determined by Western blot n=3)**P<0.01 vs control,##P<0.01 vs LPS,△△P<0.01 vs LPS+IMD
2.2 IMD对巨噬细胞M1/M2型标志因子mRNA表达的影响由Fig 2可见,LPS刺激RAW264.7细胞导致M1型标志分子CD86、TNF-α、iNOS mRNA表达升高,M2型标志分子CD206、Arg-1 mRNA表达降低,与对照组比较差异有统计学意义(P<0.05,P<0.01),结果表示LPS可诱导其向M1型极化;与LPS组比较,IMD处理可降低CD86、TNF-α、iNOS mRNA的表达,增加CD206、Arg-1 mRNA表达(P<0.05,P<0.01);而AMPK抑制剂Compound C处理可在一定程度上拮抗这一作用(P<0.05,P<0.01)。

Fig 2 The mRNA levels of M1/M2 in different groups determined by Real time PCR n=3)*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs LPS;△P<0.05,△△P<0.01 vs LPS+IMD
2.3 IMD对巨噬细胞M1/M2型标志因子蛋白表达的影响Western blot结果可见,LPS组促炎因子TNF-α、IL-6蛋白表达升高,而抗炎因子IL-10蛋白表达降低,与对照组比较差异有统计学意义(P<0.01);与LPS组比较,IMD处理可降低TNF-α、IL-6的表达,增加IL-10表达;而AMPK抑制剂Compound C处理可在一定程度上拮抗这一作用(P<0.01)。
2.4 IMD对M1型巨噬细胞比例的影响Fig 4的流式细胞术检测结果显示,与对照组相比,LPS组M1型细胞比例增加,差异有统计学意义(P<0.01);与LPS组相比,IMD处理组M1型细胞减少(P<0.01);与LPS+IMD组比较,AMPK抑制剂Compound C处理组M1型细胞增加(P<0.05),提示AMPK信号通路在IMD抑制LPS诱导的巨噬细胞M1极化过程中发挥一定作用。
2.5 巨噬细胞培养上清细胞因子的改变由Fig 5可见,ELISA法检测巨噬细胞培养上清TNF-α、IL-6分泌情况,结果显示,与对照组相比,LPS处理可导致TNF-α、IL-6分泌增加(P<0.01),经IMD处理后,细胞因子的分泌明显减少(P<0.01),与IMD组相比,AMPK抑制剂Compound C处理组细胞上清液中TNF-α和IL-6的分泌量增加(P<0.05)。

Fig 3 The protein levels of TNF-α,IL-6 and IL-10 in different groups determined by Western blot n=3)**P<0.01 vs control;##P<0.01 vs LPS;△△P<0.01 vs LPS+IMD

Fig 4 Proportion of M1 in RAW264.7 detected by flow cytometry n=3)**P<0.01 vs control;##P<0.01 vs LPS;△P<0.05 vs LPS+IMD

Fig 5 Secretion of TNF-α and IL-6 in different groups detected by ELISA n=3)**P<0.01 vs control;##P<0.01 vs LPS;△P<0.05 vs LPS+IMD
3 讨论
大量的研究表明,单核细胞/巨噬细胞参与了炎症性疾病如自身免疫病、超敏反应的发生和发展。巨噬细胞不仅能吞噬和杀灭病原微生物,还能生产多种促炎性细胞因子和趋化因子参与过敏性哮喘、RA、急性呼吸窘迫综合征等炎症性疾病的致病过程[1]。巨噬细胞极具异质性和可塑性,可因微环境不同而转换为多种亚型。在LPS或干扰素(interferon,IFN-γ)等刺激下分化为M1型巨噬细胞,释放白介素-1(interleukin-1,IL-1)、IL-6、TNF-α等促炎因子,诱导型一氧化氮合酶(induced nitric oxide synthase,iNOS)高表达,促进炎症的发展;在IL-4、IL-13等信号刺激下可活化为M2型巨噬细胞,高表达精氨酸酶-1(arginase-1,Arg-1)、CD206、YM-1,分泌IL-10等抗炎因子,具有抗炎、促组织修复的作用[10-12]。RA患者的滑膜巨噬细胞呈M1促炎性极化表型,滑液巨噬细胞M1/M2比例显著升高,以M1型巨噬细胞占优势[13]。活化的M1巨噬细胞表现出促炎活性,并导致多种炎症性疾病,如微生物感染、败血症、自身免疫性疾病和心脏代谢疾病[14],巨噬细胞 M1/M2极化在多种疾病如肿瘤、炎症、脑卒中、心血管疾病等的发病及进展中都至关重要,通过调节M1/M2型巨噬细胞极化可有效控制相关疾病发生发展,改善其预后[1]。
IMD是重要的心、肾、神经、内分泌调节肽,参与多种器官生理、病理过程[6-7],Pang等[10]研究发现,IMD可逆转同型半胱氨酸血症(Hcy)诱导的巨噬细胞M1/M2比例的失调,促进巨噬细胞由M1型向M2型转化。本研究采用体外培养小鼠RAW264.7巨噬细胞,通过LPS诱导模拟巨噬细胞受到的炎性刺激,结果显示,LPS可诱导RAW264.7细胞朝M1型分化,上调细胞因子TNF-α,IL-6的表达,增加M1型巨噬细胞数量;而IMD处理可减少细胞上清液中炎症因子TNF-α和IL-6的分泌,下调M1型巨噬细胞标志分子CD86、TNF-α、iNOS的表达,使M2型巨噬细胞标志分子CD206、Arg-1、IL-10表达上调,同时减少M1型巨噬细胞比例,进一步证实了IMD可以抑制LPS诱导的RAW264.7细胞M1型极化,调控巨噬细胞极化进程。
AMPK是参与细胞能量代谢调节的关键激酶,AMPK激活后通过抑制糖酵解、促进氧化磷酸化,改变炎症细胞抗炎表型,对炎症发挥抑制作用。AMPK激活抑制LPS刺激的巨噬细胞,脂肪细胞和系膜细胞促炎细胞因子表达[15-16],近年来研究显示,在LPS诱导的急性肺损伤小鼠模型中AMPK通路参与了M2型巨噬细胞的活性,并减轻了LPS 诱导的炎症反应和肺损伤,而AMPK-/-巨噬细胞不能被诱导活化为M2型巨噬细胞[17]。在造血干细胞中抑制AMPK信号通路可促进M1型巨噬细胞活化,抑制M2型巨噬细胞活化[18]。本实验研究结果也证实,LPS作用巨噬细胞RAW264.7后,p-AMPK蛋白水平下降,而IMD处理后可增加p-AMPK蛋白水平。我们采用Compound C阻断AMPK活性,抑制AMPK信号通路会导致RAW264.7细胞炎症因子TNF-α和IL-6表达量升高并增强了LPS的作用。结果提示IMD可以上调p-AMPK表达,激活AMPK信号通路,减少LPS导致的RAW264.7细胞M1型极化。IMD通过与降钙素受体样受体/受体活化修饰蛋白复合物共同受体(calcitonin receptor-like receptor/receptor activity modifying protein receptor complexes,CRLR/RAMPs)结合增加细胞内cAMP产生,进而激活AMPK信号通路[10],但其具体调控机制需要进一步深入研究。
综上所述,本研究证实IMD可能通过激活AMPK信号通路,抑制LPS诱导的RAW264.7细胞的M1型极化及炎症因子TNF-α和IL-6的表达,以上研究为IMD通过调节巨噬细胞极化,参与巨噬细胞极化失衡导致的相关免疫炎症性疾病的诊断和治疗提供了新的思路。