尼妥珠单抗联合调强放疗治疗局部晚期鼻咽癌的疗效及对血清Nedfatin-1、超氧化物歧化酶的影响
杨喜科,姜平,张蕊,时赛
(南阳市中心医院,河南 南阳 473009)
鼻咽癌发病率为耳鼻喉科恶性肿瘤之首[1]。研究显示表皮生长因子 (Epidermal growth factor,EGFR)的表达与肿瘤细胞的恶性程度高度相关[2-3]。尼妥珠单抗作为人源化单克隆抗体,可特异性封闭EGFR受体,能提高肿瘤细胞对放疗敏感性[4-9]。血清超氧化物酶(Serum superoxidase,SOD)是体内重要的抗氧化物,可有效清除机体氧自由基且能减少细胞损伤[10-11]。Nedfatin-1是由82个氨基酸(aa)组成的神经肽类物质,已有研究显示该蛋白与细胞凋亡有密切联系[12-14]。本研究评估尼妥珠单抗联合调强放疗在局部晚期鼻咽癌的临床疗效,并观察患者血清SOD及Nesfatin-1表达变化。
1 资料与方法
1.1 临床资料 选择2016年1月至2017年4月我院治疗的120例初治鼻咽癌住院患者为研究对象,男84例,女36例,年龄37~75岁,平均(47.9±7.5)岁,病理分期:Ⅲ期74例,Ⅳ期46例。
1.2 纳入及排除标准 纳入标准:(1)年龄≥18且≤75岁;(2)诊断为发性鼻咽癌,分期为III至IVA期;(3)KPS评分≥70分;(4)无放化疗史,肝肾功能及骨髓储备功能正常;(5)本研究经医院伦理委员会批准,患者及家属知情并签订知情同意书。排除标准:(1)怀孕期或泌乳期患者;(2)合并高血压、心血管疾病、肺部疾病及其他肿瘤;(3)合并活动性消化道溃疡或出血者;(4)肿瘤转移者;(5)不能遵从试验要求者。
1.3 研究方法 采用横断面研究方法。120例入选患者均接受2个周期(共计42 d)的诱导化疗,观察组患者休息2周后给予尼妥珠单抗联合同期放疗治疗,对照组患者在休息2周后仅进行放疗治疗。
1.4 治疗方案 诱导化疗:于治疗开始第1天静脉滴注多西紫杉醇注射液60 mg/m2、每日1次;治疗前3 d静脉滴注注射用5-氟尿嘧啶500 mg/m2,每日1次;奈达铂注射液80 mg/m2,每周期1次。
靶向治疗:分别于放疗同期的第1、8、15、22、29、36及43天,放疗前4 h给予尼妥珠单抗注射液200 mg稀释于250 mL 0.9%氯化钠溶液中静脉滴注30~60 min,1周1次。
调强放疗:患者取仰卧位,头颈肩热塑面模固定,CT增强扫描定位,范围从头顶至气管隆突分叉处。鼻咽部原发灶放射剂量为70~72 Gy,颈部转移淋巴结为60~68 Gy,高危区为60~64 Gy,预防区为54~60 Gy,脑干、视神经及视交叉部≤54 Gy,脊髓(脊神经干)≤45 Gy,颞叶≤60 Gy,颌颞关节≤60 Gy,腮腺给予50%体积剂量≤35 Gy。1次/天,5天/周,共计31~33次,进行6~7周。放疗期间两组同时进行同期化疗,应用奈达铂,用量为每周40 mg/m2。
1.5 实验室检查 于鼻咽癌患者治疗前及治疗3 d时晨起空腹抽肘静脉血2 mL,分离血清送检。血清SOD活性检测采用比色法;检测试剂盒购自北京九强生物技术股份有限公司l。人源Nesfatin-1采用酶联吸附法检测,试剂盒购自上海润裕生物科技有限公司。所有实验室检查操作均按照对应试剂盒要求。
1.6 临床疗效评估 全部治疗结束后采用MRI或CT对病灶进行评价。主要临床疗效评估指标按照2009年实体肿瘤疗效RECIST标准进行:CR(完全缓解)、PR(部分缓解)、SD(稳定)、PD(进展);有效率(RR)计算:CR+PR。
治疗结束后每3个月到院进行影像学检查及肿瘤评估,1年后每3个月进行一次电话生存随访,半年1次到院随访,末次随访时间2020年4月。
1.7 不良反应评价 研究期间化疗不良反应评价按照美国国立癌症中心通用毒性标准进行等级评定;放疗不良反应参考RTOG放射损伤评估标准;同时记录患者临床新发症状和体征任何不良事件。
1.8 质量控制 数据收集、整理及录入由具有医学统计学背景人员进行,以保证数据准确性。
1.9 数据处理 应用SPSS 20.0软件进行数据处理,研究对象基线、治疗后SOD活性进行Kolmogorov-Smirnova正态检验后符合正态分布,以均数±标准差(±s)描述平均水平;计量资料采用独立样本t检验,计数资料采用χ2检验进行差异性检验,检验标准P<0.05;使用Kaplan-Meier进行生存分析并绘制生存分析曲线。
2 结果
2.1 研究对象基本信息 两组患者临床前基本资料差异无统计学意义(P>0.05),见表1。

表1 研究对象基本信息及基线实验室情况(n=60)
2.2 研究对象治疗后SOD与Nesfatin-1含量变化结果 治疗后,观察组患者SOD活性均值较基线回升为102.8±14.7 U/mL(P<0.05),对照组患者回升为94.4±12.1 U/mL(P<0.05);观察组治疗后Nesfatin-1含量平均值较基线减少为1 007.7±1111.8 pg/mL,较对照组低(P<0.05)。见表2。

表2 研究对象完成治疗后SOD与Ne s fatin-1含量变化(n=60)
2.3 研究对象治疗效果 观察组总治疗有效率优于对照组(P<0.05),见表3。

表3 研究对象治疗效果(n=60)
2.4 治疗期间不良反应情况 两组患者出现不良反应的差异无统计学意义(P>0.05)。上述不良反应均在给予对症处理后明显缓解,未见严重不良反应事件发生,见表4。
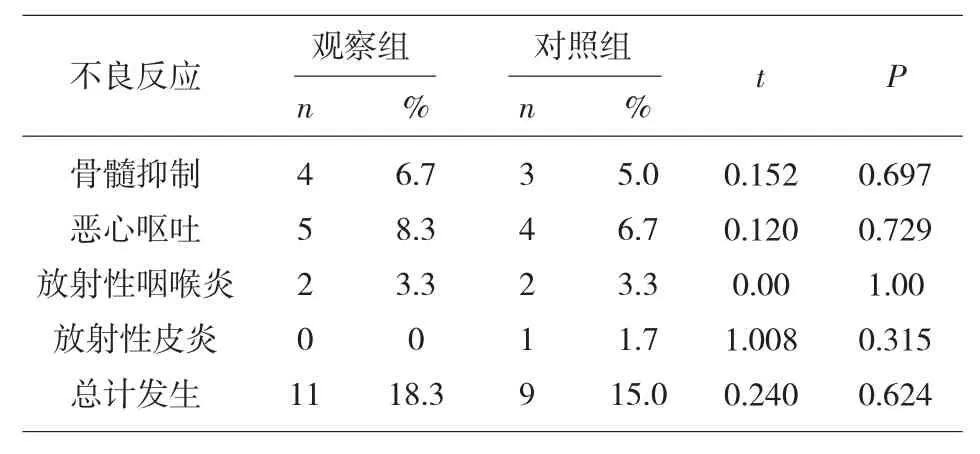
表4 研究对象治疗不良反应情况(n=60)
2.5 生存随访结果 观察组患者的三年生存率和三年无进展生存率高于对照组,且两者之间差异具有统计学意义(P<0.05)。见表5、图1。
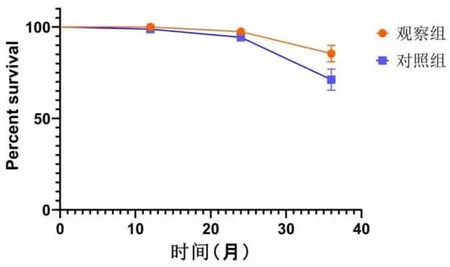
图1 生存曲线图

表5 研究对象生存随访结果(n=60)
3 讨论
针对局部晚期鼻咽癌推荐的治疗方法是以放疗为基础的放疗联合化疗综合治疗。尼妥珠单抗具有选择性高、生物利用度高及半衰期长,提高肿瘤细胞对电离辐射敏感性,从而提高对放疗敏感性的特点,被临床用作放疗增敏靶向制剂。全国多中心临床研究显示[7,14]:与单纯放疗对比,采用尼妥珠单抗联合放疗可以显著提高局部晚期鼻咽癌患者的3年OS(83.3%VS 75.0%,P<0.05),据此2009年4月NCCN头颈部肿瘤指南(中国版)将该药纳入。本文研究显示,60例临床III期及IVa期患者采用尼妥珠单抗联合调强放疗治疗局部鼻咽癌患者中临床总有效率达90.0%,不良反应率18.3%,3年OS为83.3%,较对照组临床疗效更优,且不良反应没有显著加强。
SOD是体内重要的抗氧化酶之一,其强大的抗氧化能力能保护细胞免受外界、机体自身各种原因所致的氧自由基损伤。患者在进行放疗、化疗过程中,机体会不断的产生大量氧自由基,在一定事件内超过机体自身清除能力便会对细胞DNA产生损伤,引起细胞凋亡[15]。本研究中鼻咽癌患者基线SOD活性均值为(83.8±15.3)U/mL,经治疗后SOD活性回升102.8±14.7 U/mL,经检验治疗后SOD活性与基线差异具有统计学意义(t=8.03,P=0.011),而且其效果优于对照组(P<0.05)。治疗后SOD活性的回升考虑由于放疗与化疗使实体肿瘤体积或癌细胞数量减少以及放化疗后机体为修复受损细胞代偿性释放SOD有关。
已有研究证实Nesfatin-1与多种肿瘤发生有密切关系,如促进结肠癌细胞的侵袭、转移乳腺癌的转移及预后的评价分子标记物,还与卵巢癌、前列腺癌等有关[16];本次研究中基线Nesfatin-1平均含量(2 013.5±1 206.2)pg/mL,其中临床分期IVa期的Nesfatin-1平均含量明显高于分期为III期,这很好的证实了上述结论。经治疗后Nesfatin-1含量下降1 005.8 pg/mL,治疗前后Nesfatin-1含量差异具有统计学意义(t=13.5,P<0.001),且其治疗效果明显优于对照组(P<0.05)。究其原因考虑尼妥珠单抗是EGFR拮抗剂,国外学者Tagaya Y[17]研究发现NUCB2可能与机体生长因子受体信号的传导通路有关,NUCB2可以下调PK2A(蛋白激酶2A)酶的活性,作用于表皮生长因子介导的MEK-Erk信号通路,调节机体细胞的生长分化;相关研究指出NUCB2与细胞有丝分裂后生长抑制蛋白(分化型神经原胚胎癌蛋白)相互作用,可以通过对机体细胞内钙离子的内环境控制从而调节细胞有丝分裂后的存亡[18]。
综上所述,对于诱导化疗后接受放疗的局部晚期鼻咽癌患者,采用尼妥珠单抗联合调强放疗治疗有更好的临床缓解率,不良反应轻微;根据尼妥珠单抗作用机制对血清SOD活性及Nesfatin-1含量的影响,临床用药治疗期间可以动态检测血清SOD活性及Nesfatin-1含量用以评估治疗效果。但本研究为单中心研究,且样本量较小,可能对结果造成偏倚,需要今后开展多中心、大样本研究进行印证和补充。

