IL-17基因多态性与原发性胆汁性胆管炎易感相关性研究
谭为民,李佳,黄清水,王睿,周子闻,李彩娇
(1.南昌大学第一附属医院检验科;2.南昌大学在校本科生科研训练项目小组,江西 南昌 330006)
原发性胆汁性胆管炎(Primary biliary cholangitis,PBC)原称为原发性胆汁肝硬化(Primary biliary cirrhosis,PBC),是一种以中小胆管持续性非化脓性炎症浸润及胆汁淤积为主要特征的自身免疫病[1]。当前临床对PBC尚无特效的治疗方法,早期诊断及熊脱氧胆酸治疗方案的应用可以明显改善胆汁淤积症状及预后,但却不能阻断疾病进程,晚期唯一治疗选择是进行肝移植,严重危害患者的生命健康[2]。血清抗线粒体抗体(anti-mitochondrial antibodies,AMAs)阳性是PBC特异性血清诊断指标,AMAs主要靶抗原是线粒体自身抗原丙酮酸脱氢酶复合体E2亚基(pyruvate dehydrogenase E2 subunit,PDC-E2)[1,3]。该病患者以30岁以上中老年女性为主(男∶女约为1∶9)[4-5],确切发病机制不清,可能与环境因素、遗传因素、病毒和细菌感染、自身抗体、雌激素、免疫调控、趋化因子、抗原呈递细胞、自噬、衰老、凋亡等有关,遗传因素和炎症因素是其重要发病因素[6-7]。
IL-17作为一类重要的炎症因子家族,主要由Th17细胞分泌产生,在各类自身免疫病炎症细胞聚集及浸润中起关键作用。IL-17家族包括六个家族成员,分别为IL-17A、IL-17B、IL-17C、IL-17D、IL-17E和IL-17F[8]。IL-17A和IL-17F作为其中重要的炎症因子,起着主要的炎症作用[9]。研究表明,PBC组较健康对照组IL-17A表达显著升高,与疾病严重程度成正相关[10]。IL-17多个SNPs突变位点与自身免疫病易感性相关,IL-17A G-197A(rs2275913)位点多态性被证明与类风湿关节炎易感性相关[11],中东地区结直肠研究中,IL-17A rs2275913位点多态性与结直肠癌发病风险存在相关性,IL-17A rs2275913基因表达丰度能作为结直肠癌早期监测的基因信号[12]。一项关于亚洲人群胃癌风险与IL-17位点多态性研究显示,IL-17A rs2275913和IL-17F rs763780两个基因位点多态性与胃癌风险高度相关[13]。而关于IL-17相关SNPs位点基因突变和基因型是否与PBC易感性相关,尚未有学者进行相关研究。
IL-17A rs10484879、rs2275913、rs3819025和IL-17F rs763780四个相关SNP位点是IL-17基因重要功能区位点。该研究拟在南昌大学第一附属医院PBC患者中分析IL-17 SNPs基因位点突变和基因型分布,在基因水平探讨IL-17 SNPs位点多态性与PBC疾病易感相关性。明确PBC患者血清中IL-6、IL-12、IL-17细胞因子表达水平,分析其与健康对照组的表达差异。分析相关SNPs位点基因型与细胞因子表达间的关系,为PBC易感危险因素的诊断提供科学依据。
1 材料与方法
1.1 研究对象 研究纳入2018年1月至2020年6月南昌大学第一附属医院门诊及住院就诊的PBC患者,同时收集该医院同时间段体检科健康对照组全血和血清标本。本研究共纳入56位PBC患者,60位健康人。由于PBC患者是零星出现的,主要采取“LIS系统查找-符合标准PBC患者全血和血清标本收集-患者信息录入Excel表格-全血及血清标本冻存待用”的策略。匹配收集的PBC患者年龄和性别,收集相对应健康组全血及血清标本,两周内完成收集。纳入研究的PBC研究病例对象均经过临床专业医师的诊断,并且为初次诊断的患者。
依据2017年欧洲肝脏研究协会(European Association for the Study of the Liver,ESAL)中PBC的诊断标准[14]。PBC患者纳入标准需符合以下三条标准中至少两条:(1)抗线粒体抗体(AMAs)滴度大于1∶40[15];(2)碱性磷酸酶(Alkaline phosphatase,ALP)或谷氨酰基转移酶(Gamma-glutamyltransferase,GGT)浓度大于正常浓度上限的1.5倍,且持续时间大于24周;(3)典型的病理切片结果(如典型的中小胆管上皮细胞破坏或中小胆管炎症浸润情况)。
排除标准:(1)病毒性肝炎、酒精性肝炎、肝癌;(2)近期患有严重传染病和心血管疾病的;(3)接受免疫抑制药物、增强药物治疗;(4)自身免疫性肝炎(Autoimmune hepatitis,AIH)、原发性硬化性胆管炎(Primary sclerosing cholangitis,PSC)与自身免疫性肝病重叠综合征。
所有符合标准的PBC患者和健康组均按照规范采血要求进行操作。抗凝紫管全血标本分装后做好标记,血清标本离心分离后分装,均保存于-80℃的低温科研冰箱中,避免对血液标本进行反复冻融。
1.2 DNA提取 严格按照北京天根生物技术有限公司的全血DNA提取试剂盒操作说明,提取PBC组和健康对照组抗凝全血中的DNA。提取的DNA的浓度和纯度使用Quwell Q3000进行测定,OD 260/OD 280比值介于1.6~1.8符合标准,DNA标本保存于-20℃冰箱。
1.3 目的位点基因分型 相应的IL-17A rs10484879、rs2275913、rs3819025 和 IL -17F rs763780位点SNPs由Sanger测序进行确定。为扩增出对应位点的目的DNA片段,Primer软件设计四对引物,见表1,由上海生工进行合成。25μL PCR反应体系由5μL DNA模板,2μL上游引物,2μL下游引物,12.5μL GoTaq Green PCR mix混合液和3.5μL去核酸水组成。扩增条件:95℃变性5 min,每次95℃变性30 s进行35次循环,退火1 min,对应引物退火温度见表1,72℃延伸90 s每循环,最后72℃延伸5 min,4℃冷藏。所有PCR扩增目的片段送到上海生工进行Sanger测序。

表1 对应位点引物及T m温度
1.4 细胞因子和临床指标测定 -80℃低温冰箱保存的PBC组和健康对照组血清置于37℃温箱进行解冻,融化混匀,离心去除杂质沉淀。流式细胞术测定两组血清IL-6、IL-12、IL-17表达水平,严格按照细胞因子检测试剂盒操作步骤进行。并同时收集两组对应的血液和生化临床指标,进行分析研究。
1.5 统计学处理 采用SPSS 20软件进行统计学分析,计量数据均以(±s)表示。F检验方差齐性,P>0.05时,组间比较采用独立样本t检验,否则采用U检验。Haploview 4.2软件用来分析哈温平衡。线性相关分析采用Pearson相关性分析。分类数据采用Pearson卡方检验,单因素logistic回归分析IL-17 SNPs与PBC易感相关性,以OR值和95%CI。P<0.05为差异有统计学意义。
2 结果
2.1 PBC组和健康对照组临床基本特征 56例PBC患者平均发病年龄为(56.25±14.59)岁,以中老年女性为主,男性患者14例,女性患者42例。匹配PBC患者年龄和性别收集健康人基本临床信息,比较发现,PBC组的红细胞(Red blood cell,RBC)、血 红 蛋 白 (Hemoglobin,HGB)、血 小 板(Platelets,PLT)及血细胞比容(Hematocrit,HCT)数值显著低于健康对照组,差异具有统计学意义。生化指标方面,总蛋白(Total protein,TP)、白蛋白(Albumin,ALB)、A/G指标PBC组显著低于健康对照组,而丙氨酸氨基转移酶(Alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(Aspartate aminotransferase,AST)、A/G指标PBC组显著高于健康对照组,尤其是生化指标中反应胆汁淤积情况的指标谷氨酰基转移酶(Gamma-glutamyltransferase,GGT)、碱性磷酸酶(Alkaline phosphatase,ALP)、总胆红素(Total bilirubin,TBIL)、直接胆红素(Direct bilirubin,DBIL),PBC显著高于健康对照组。ALP指标PBC组是健康组的3.2倍,GGT指标PBC组是健康组的5.5倍,TBIL指标PBC组是健康组的3.3倍,DBIL指标PBC组是健康组的12.9倍,PBC组均远高于健康对照组,见表2。
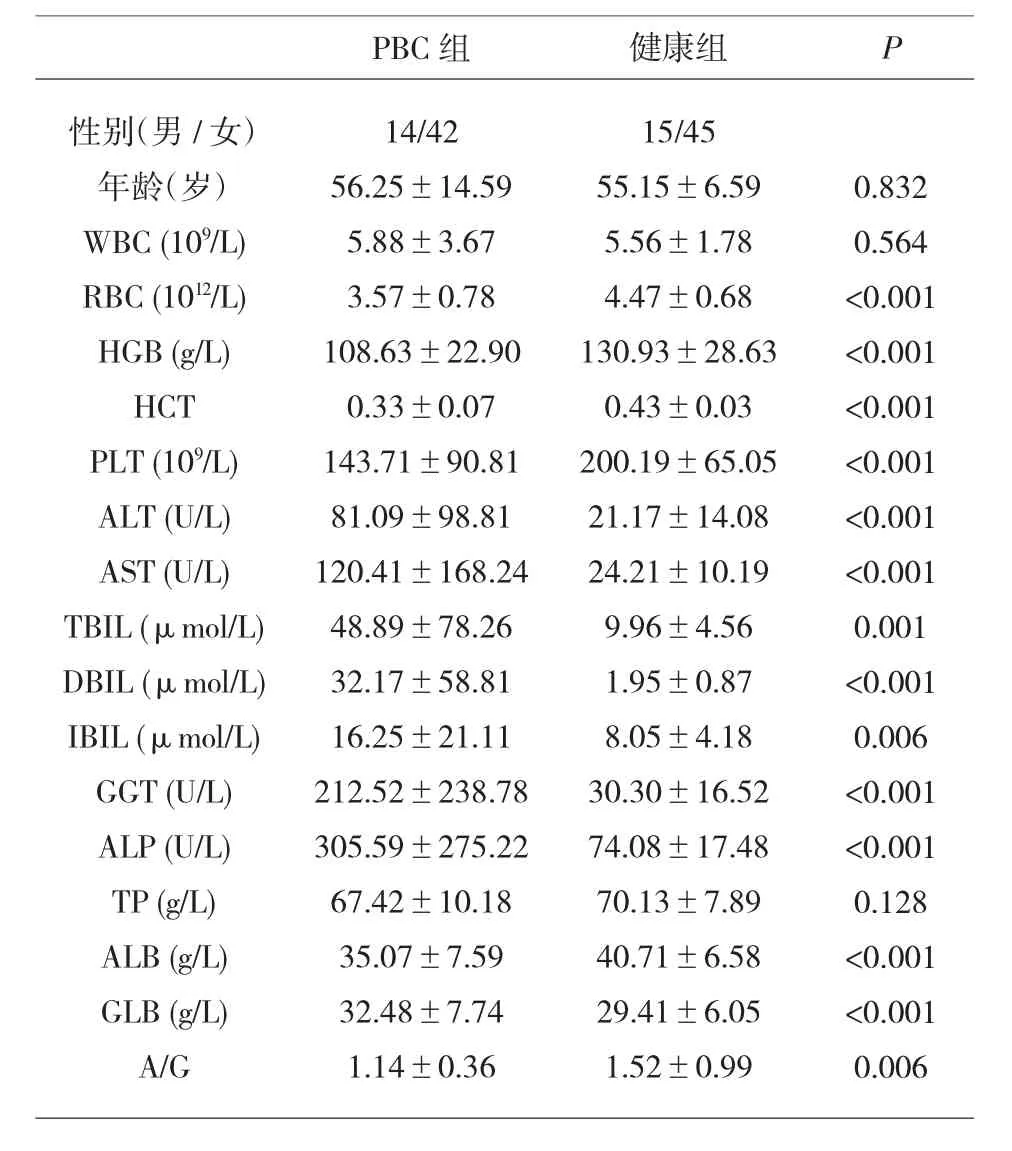
表2 PBC组与健康对照组基本临床特征
2.2 PBC组和健康对照组IL-17 SNPs位点突变和基因型分析 PBC组和健康对照组IL-17A rs10484879、rs2275913、rs3819025 和 IL -17F rs763780四个SNPs位点基因型进行哈迪-温伯格(Hardy-Weinberg)基因平衡分析,两组四个SNPs基因型P>0.05时,分布符合哈-温平衡,具有研究意义,见表3。

表3 PBC组和健康对照组哈迪-温伯格平衡检验结果
对两组四个SNPs位点基因型和基因频率进行显性模型、隐性模型、共显性模型分析。IL-17A rs10484879和IL-17F rs763780基因位点三种基因型模型中,PBC组和健康对照组表达差异均无统计学意义。IL-17A rs2275913位点隐性模型和共显性模型中,PBC组基因型AA表达少于健康人群中AA表达,差异有统计学意义。隐性模型中,AA基因型OR值和95%CI分别为0.383,(0.157~0.935);共显性模型中,AA基因型OR值和95%CI分别为0.330,(0.109~0.998)。IL-17A rs3819025位点显性模型和共显性模型中,PBC患者GA和AA基因型远多于健康人这两种基因型表达,GG基因型表达少于健康人表达,差异具有统计学意义。显性模型中,GA+AA基因型组合OR值和95%CI分别为11.600,(2.527~53.259);共显性模型中,GA基因型OR值和95%CI分别为10.150,(2.186~47.127)。PBC组和健康组突变位点基因型和等位基因表达和频率,见表4。

表4 PBC组和健康对照组基因型和基因频率分析结果
2.3 PBC组和健康对照组细胞因子表达水平 分析两组血清中IL-6、IL-12、IL-17A表达水平,PBC组均显著高于健康对照组,见表5。通过Pearson相关性分析发现,PBC组中IL-17A表达与IL-6表达成正相关(r=0.4818,P=0.0003),图1,也与IL-12表达成正相关(r=0.3714,P=0.0048),图2。IL-6表达水平未发现与IL-12表达水平存在相关性(P>0.05)。

图1 PBC组IL-17A与IL-6表达相关性

图2 PBC组IL-17A与IL-12表达相关性

表5 PBC组和健康组细胞因子表达水平
2.4 PBC组IL-17A rs3819025位点不同基因型细胞因子及生化指标表达 分析IL-17A rs3819025位点不同基因型细胞因子及生化指标表达差异,见表6。反应胆汁淤积指标TBIL、DBIL、ALP、GGT,AA+GA基因型人群均高于GG型人群。IL-17A表达水平AA+GA基因型人群也高于GG型人群。IL-6、IL-12表达水平AA+GA基因型人群低于GG型人群,但所有差异不存在统计学意义。

表6 PBC组细胞因子及生化指标不同基因型表达
3 讨论
收集2018年1月至2020年6月南昌大学第一附属医院确诊PBC患者56例纳入研究,并匹配其年龄和性别收集60例健康对照组。分析可知,江西PBC患者以中年女性为主,平均患者年龄(56.25±14.59)岁,男女比例为1∶3。近几年流行病学调查显示,随着医疗水平提高PBC确诊率的提高,PBC患者男女比例有所增加,甚至有调查PBC患者男女比例为1∶2.1[16],这与该研究分析结果较为符合。比较两组肝生化指标,PBC较健康对照组ALT、AST指标显著升高,ALT约为对照组4倍,AST约为对照组5倍。慢性肝炎尤其是肝纤维化时,AST升高程度高于ALT升高程度[17]。PBC患者肝损伤为慢性肝炎,且可能进展为肝纤维化。PBC患者易出现黄疸、瘙痒、疲惫等并发症。比较两组DBIL、IBIL和TBIL指标,PBC组三项指标均显著升高,以DBIL升高尤甚,约为健康对照组的16倍,IBIL约为健康组2倍,PBC患者以胆汁淤积梗阻性黄疸为主。PBC组ALP指标约为健康对照组4倍,PBC组GGT指标约为健康对照组7倍。ALP高于正常值上限1.5倍,是确诊PBC的条件之一[14]。ALP升高不仅仅出现在胆汁淤积性肝病中,还有诸多生理性或病理性原因可引起ALP升高[18](如骨骼性疾病,青少年生长期,妇女妊娠期等)。临床上通常结合GGT指标和DBIL判断患者胆汁淤积情况,并结合AMAs阳性用于确诊PBC[19]。综上所述,PBC患者中小胆管的损伤,造成患者出现以DBIL升高为主,IBIL轻微升高为特征的胆汁淤积性黄疸,引起ALP、GGT指标升高,导致肝脏的慢性炎症损伤,肝脏蛋白合成能力受损,白蛋白合成下降,持续存在的肝脏炎症可能引起肝脏纤维化。患者体内免疫系统激活,相应IgG和IgM抗体合成增加,GLB升高明显。
PBC作为一种复杂的自身免疫病,尽管其发病机制尚未阐明,但我们已经认识到遗传因素、免疫因素和炎症因素在PBC发病中起重要作用[20]。作为关键的促炎因子之一,IL-17A相关SNPs在多种自身免疫病研究中已被证明与疾病易感性存在相关性,但结果各异[21-22]。IL-17A位于人染色体6q21,由3个外显子和2个内含子构成[23],有关IL-17A基因位点多态性与PBC易感相关性分析鲜有研究。本研究分析IL-17A rs10484879、rs2275913、rs3819025和IL-17F rs763780四个SNPs位点与PBC易感相关性。首先对两组四个SNPs位点基因型分布进行哈-温平衡检测,其分布频率均符合哈-温平衡,说明两组基因均无群体偏差,具有人群代表性。PBC组和健康组中,rs10484879和rs763780 SNPs位点基因突变和基因型分布差异无统计学差异,这两个SNPs位点基因突变与PBC易感性不存在相关性。
IL-17A rs2275913 SNPs位点中野生型等位基因为G,A为其突变型等位基因。在隐性模型和共显性模型中,PBC组AA基因型携带者均少于健康对照组AA携带者。隐性模型中,GA和GG基因型携带者PBC易感性是AA基因型携带者的2.61倍;共显性模型中,GG基因型携带者PBC易感性是AA基因型携带者的3.03倍。提示AA基因型携带者PBC易感性降低,AA基因型可能是PBC保护基因型。IL-17A rs2275913位点突变型A等位基因可能为PBC保护因素。
IL-17A rs3819025 SNPs位点,PBC患者突变型基因位点A显著多于健康对照组。显性模型中,PBC组GA+AA基因型频率显著高于健康对照组中出现频率,GA+AA基因型携带者PBC易感性是GG基因型携带者的11.60倍;共显性模型中,GA基因型携带者PBC易感性是GG基因型携带者的10.15倍。提示rs3819025 SNPs位点A等位基因突变,会增加PBC疾病易感性,GA和AA基因携带者具有更高的PBC患病风险。IL-17A rs3819025 SNPs位点突变型A等位基因会显著增加PBC易感性,是PBC危险因素。
分析rs3819025 SNPs位点不同基因型生化指标,AA+GA基因型ALP、GGT、TBIL、DBIL指标较GG基因型表达水平升高,提示A突变有可能与PBC中胆汁淤积有关。分析rs3819025 SNPs位点不同基因型细胞因子表达,GA+GA基因型较GG基因型IL-17表达水平升高,提示IL-17A rs3819025位点突变有可能会增强IL-17相关基因转录活性,进而促进IL-17表达,并进一步引起其他多种细胞因子表达差异。而相关作用机制需要后续研究进一步探索。总而言之,IL-17A rs2275913和rs3819025 SNPs位点多态性与PBC易感性相关。rs2275913位点AA基因型携带者PBC易感性较低,rs3819025位点GA和AA基因型携带者易发生PBC。IL-17 SNPs多态性可能作为预防诊断PBC的候选基因,从而为PBC早期诊断和预防提供相应依据。
比较两组炎症细胞因子IL-6、IL-12和IL-17A表达水平,PBC组三者表达均高于健康对照组。分析可知,PBC中IL-17A的表达与IL-6和IL-12的表达成正相关,炎症因子在PBC病情进展相互影响,影响各自的分泌产生。分析PBC组rs3819025 SNPs位点不同基因型对细胞因子和生化指标的影响,GA+AA突变型基因型较GG野生型基因型IL-17表达水平升高,相关胆汁淤积和肝损伤指标表达也有所升高。但由于可能纳入研究标本量较少,所有差异均不存在统计学意义,需后续研究扩大样本量验证。
该研究提示,IL-17A rs2275913和rs3819025 SNPs位点多态性可能与PBC易感性相关。rs2275913位点AA基因型携带者PBC易感性较低,是PBC发病保护因素;rs3819025位点GA和AA基因型携带者易发生PBC,是PBC发病危险因素。IL-17 SNPs多态性研究可为PBC早期诊断和预防提供预测依据。

