血管肉瘤的分子靶向及免疫治疗研究进展
孙璐,石宏伟,皮国良
0 引言
血管肉瘤(angiosarcoma,AS)是一种起源于血管或者淋巴管内皮细胞的恶性软组织肉瘤,发生率不到肉瘤的1%[1-2]。恶性程度及侵袭性较高,预后不佳,中位总生存时间(OS)为30~50月,5年生存率为10%~50%[3]。
AS的病因尚未完全明确,慢性淋巴水肿、化学物质及放射线暴露均会增加血管肉瘤发生的风险[4-5]。由于AS的发生部位以及起病原因千差万别,故而其临床表现及病理特征存在较大的差异。因此除了从肿瘤的形态学特征及分化程度诊断血管肉瘤外,还需免疫组织化学检测PCK、Vimentin、ERG、Ⅷ因子、CD31、CD34和VEGF等血管及内皮相关抗原[6],但在部分分化极差的AS中,发现这些分子标志物的表达并未升高,且因血管肉瘤可以发生于全身各个部位,对其鉴别较为困难。
由于AS较为罕见,故而AS相关大型临床随机对照试验设计困难,文献多为个案报道或者小型临床试验。目前针对AS医学界仍然没有统一的临床治疗规范及指南。AS可以根据病变范围分为:局限期及广泛期。通常局部可切除的血管肉瘤选用根治性手术并于术后辅助放化疗;而失去手术机会或不能手术的患者则选择阿霉素/紫杉醇为主的化疗或其他全身治疗手段[7-9]。本文旨在阐述血管肉瘤免疫治疗及分子靶向治疗的目前进展情况。
1 血管肉瘤的传统治疗
未发生转移的AS首选根治性手术。但由于AS常呈浸润性或者多灶性生长,且生长部位特殊,常发生于心脏、头颈部等部位,导致肿瘤难以完全切除,AS的单纯术后局部复发率高达75%以上[10]。因此,术后辅助放疗是有必要的,通常术后辅助50~70 Gy的放疗[11],但继发于放射治疗后的AS,通常不推荐再程放疗。目前缺乏大型前瞻性随机对照试验探讨放疗的模式与剂量,但回顾性研究表明增加放疗剂量可以提高局控率,改善患者预后,高剂量的辐射可将局控率提升至50%以上,尤其是局部晚期的患者。但无论原发灶的大小,约一半以上接受过放疗的患者会出现远处转移,因此化疗是必不可少的[12]。有个案报道在对原发肿瘤进行姑息性切除,然后进行同步放化疗和靶向治疗后,原发性血管肉瘤(PAS)和继发性血管肉瘤(SAS)患者的5年生存率分别为73.7%和63.5%,突出了综合治疗治疗策略的作用[13]。
部分AS患者在初诊时已为晚期,或因其他原因不能进行手术或者放疗。有证据显示紫杉类、蒽环类、异环磷酰胺、吉西他滨等化疗药物均对AS有效。通过对11个前瞻性随机和非随机的欧洲癌症研究与治疗组(EORTC)的临床试验数据进行分析,该研究提示了以蒽环类为基础的一线化疗使25%的患者肿瘤缩小,中位无进展生存时间(PFS)为4.9月,OS为9.9月[14],该项试验奠定了蒽环类作为首选一线药物的基础。脂质体阿霉素与传统阿霉素相比较,具有低毒高效的特点,因此其在AS中的作用引起了专家们的兴趣。但6例皮肤AS的患者使用脂质体阿霉素联合放疗治疗后,PFS为8月,有效时间较短[15]。然而,对于老年患者,脂质体阿霉素较之于传统阿霉素安全性相对有所提高,是一种新的治疗选择[16]。2021年亚洲肉瘤联盟(The Asian Sarcoma Consortium)通过对8个肉瘤学术中心276例晚期AS患者进行回顾性分析,47.6%的患者一线使用紫杉醇化疗,19.6%的患者使用脂质体阿霉素化疗,中位OS为7.8月,脂质体阿霉素与紫杉醇单药化疗的PFS相似,差异没有统计学意义[17]。另一项Ⅲ期随机对照试验(EORTC 62012)则分析了联合化疗的疗效,研究认为虽然阿霉素联合异环磷酰胺组总有效率高于阿霉素组(26%vs.14%,P<0.0006),但是OS差异并无统计学意义,这可能与联合用药组毒性增加有关[18]。对比阿霉素与吉西他滨联合多西他赛组,两者的中位PFS无显著差别,该项研究提示虽未发现吉西他滨联合多西他赛作为一线治疗方案的优势[19],但为心功能不全的患者提供了新的治疗选择。在一线治疗进展后,白蛋白紫杉醇或吉西他滨在二线治疗的疗效也得到证实[20]。
2 血管肉瘤的分子靶向治疗
传统治疗方式为患者带来的生存获益有限,随着分子生物学技术的进展,针对AS特异性靶点的分子靶向治疗逐渐走入人们的视野[21]。在AS组织中血管生长因子VEGF及其受体VEGFR的表达升高,且这些蛋白的表达与Ki-67指数显著正相关,其中VEGFR-3的相关性最高[22]。VEGF/VEGFR的激活促进肿瘤的增殖、生长甚至恶性转化,是AS预后不良的预测指标。此外,几个VEGF/VEGFR通路关键蛋白,包括酪氨酸激酶、表皮生长因子样结构域1(TIE1)和TIE2在AS中表达均升高。这些发现提示VEGF/VEGFR通路的上调可能与AS的发生、血管生成相关。因此,VEGF/VEGFR及其下游通路可能是AS重要的治疗靶点[23]。
2.1 贝伐珠单抗
贝伐珠单抗是一种重组人源化单克隆抗体,可阻断VEGF-α的活性。一项单臂Ⅱ期临床试验纳入32例可手术切除的AS患者,接受单药贝伐珠单抗治疗后,17%的患者疗效评价为PR。15例患者病情稳定,平均进展时间为26周,耐受性良好[24]。贝伐珠单抗联合吉西他滨和多西他赛一线使用,客观有效率约为49%。紫杉醇联用贝伐珠单抗的临床试验因观察到不可耐受的不良反应而被终止[25-26]。
2.2 舒尼替尼
舒尼替尼是一种小分子多靶点受体酪氨酸激酶抑制剂,2009年即有个案报道称舒尼替尼可延缓一线治疗失败后AS患者的进展。随后陆续有将其用于治疗AS的个案报道[27-28]。但目前仍没有大型临床研究证实舒尼替尼的疗效。有证据证实PLCG1-R707Q突变可能与舒尼替尼耐药相关[29]。
2.3 索拉非尼
索拉非尼既能通过阻断RAF/MEK/ERK通路抑制肿瘤增殖,还可通过抑制VEGFR和血小板衍生生长因子(PDGF)受体而阻断肿瘤新生血管的形成,间接抑制肿瘤细胞的生长。一项Ⅱ期临床试验募集了37例接受过1~3线治疗的AS患者,行索拉非尼单药治疗,有5例患者疗效评价达到PR或CR,缓解率为14%[30]。虽然患者可从中获益,但索拉非尼控制AS的时间有限,晚期内脏AS和表皮AS接受索拉非尼之后的中位PFS仅为3.8月和1.8月[31]。基线低水平的VEGF-α分泌量可能是索拉非尼的预后预测因子[32]。
2.4 帕唑帕尼
帕唑帕尼(Pazopanib,GW786034)是一种新型多靶点的VEGFR1、VEGFR2、VEGFR3、PDGFR、FGFR、c-Kit和c-Fms/CSF1R抑制剂。帕佐帕尼被批准用于AS的治疗,但获益不大[33-34]。研究表明,帕唑帕尼可用于AS二线治疗,紫杉醇治疗进展后的患者,在二线使用帕唑帕尼后的中位PFS为94天[35]。患者使用索拉非尼治疗失败后,再选用帕唑帕尼治疗依然有效,可使患者疾病稳定6月左右[36]。
2.5 血管内皮抑素Endoglin
Endoglin是一种不同于VEGFR的表达于肿瘤血管上的重要血管生成靶点,在VEGFR被抑制后,Endoglin在AS肿瘤细胞的表达上调。因此在抗VEGFR药物的基础上加用抗Endoglin的药物TRC105可能会使患者获益[21]。在临床前研究中已证实TRC105具有补充VEGFR-TKIs的潜力,Ⅰ/Ⅱ期试验证实了AS患者联合使用TRC105和帕唑帕尼较之于单用帕唑帕尼具有更高的CR率,PFS延长至7月余[37]。
2.6 表皮生长因子样结构域抑制剂Trebananib
Trebananib可通过使Tie2受体与其配体、血管生成素-1及血管生成素-2之间的相互作用失效而抑制肿瘤血管生成,从而起到阻断肿瘤血流来阻止肿瘤细胞生长的作用。目前关于Trebananib治疗晚期AS的Ⅱ期临床试验已招募完成,该项目共16例AS患者,4例PFS延长,持续3.4~5.5月[38]。
2.7 其他
也有研究证实其他VEGFR通路抑制剂在AS中的有效性,但多为个例报告。如VEGFR多靶点抑制剂安罗替尼、小分子VEGFR-2抑制剂阿帕替尼等[39-40],值得临床个体化选择。
此外,一种广泛用于治疗高血压和慢性心力衰竭的非选择性β-肾上腺素能受体阻滞剂普萘洛尔被发现可以抑制几种癌症的转移。目前普萘洛尔与长春花碱和环磷酰胺等其他化疗药物的联合试验正在研究中。
3 血管肉瘤的免疫治疗
随着对PD-1/PD-L1免疫检查点抑制剂的探索,在部分肿瘤中已取得了重大进展,并已逐步取代传统化疗,甚至在部分肿瘤中提出了去化疗的概念。但针对血管肉瘤免疫治疗的临床试验远远落后于其他肿瘤。24例AS患者肿瘤细胞及免疫细胞PD-L1的表达检测证实约66%的患者PD-L1表达阳性,免疫治疗可能取得一定的疗效[41]。有多个病例报道称,血管肉瘤经过传统手术及放化疗后出现进展后使用Pembrolizumab单药有效,且不良反应可控[42-43]。而另一项单中心回顾性研究分析了7例皮肤及乳腺AS患者使用免疫抑制剂后的疗效,其中包括帕博利珠单抗联合阿西替尼(1例)、CTLA-4抑制剂(2例)、帕博利珠单抗(4例)。3月后复查,5例患者疗效评价为PR,2例进展。截至统计分析时,1例使用CTLA-4抑制剂的患者疗效评价为CR,安全性可控[44]。此外,还有一项前瞻性开放性的多中心Ⅱ期临床试验(NCT02834013)分析了Ipilimumab联合Nivolumab 治疗转移性不可切除血管肉瘤的临床疗效,总共纳入16例患者,ORR达到25%,目前患者OS及PFS仍在随访中[45]。迄今为止,免疫治疗在血管肉瘤中的作用仅有小样本及个案报告证实,部分患者获得了部分缓解,缓解期达数月[46]。目前有部分免疫治疗在AS中的研究进入了临床试验阶段,其结果值得期待,见表1。
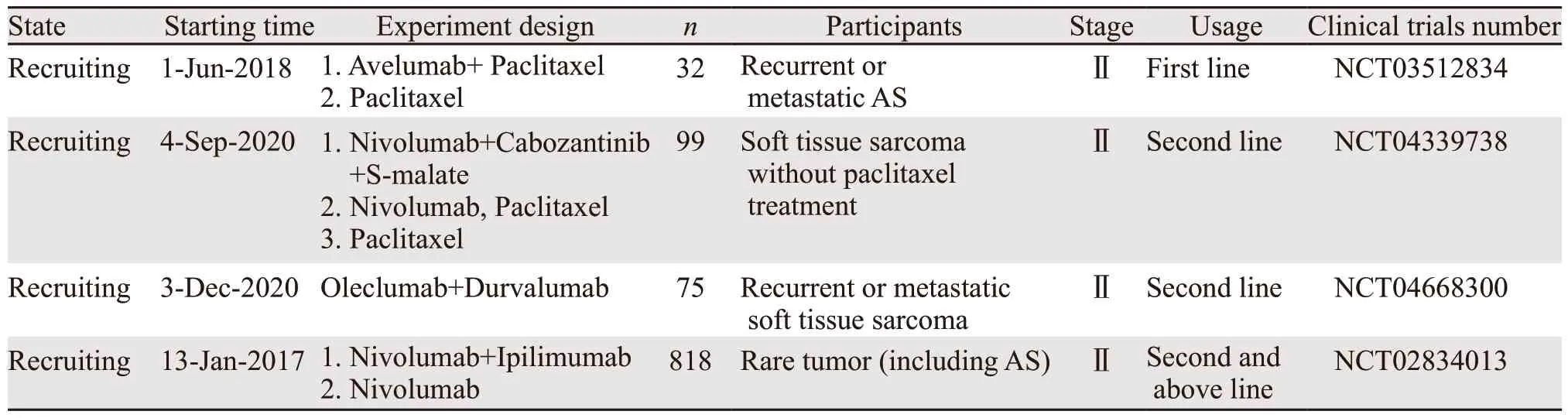
表1 目前正在进行中的纳入血管肉瘤患者的免疫治疗临床试验Table 1 Ongoing clinical trials of immunotherapy on AS patients
4 总结与展望
作为一种罕见的软组织肉瘤亚型,AS的发病率低,但预后极差。由于病例数少,导致临床试验设计困难,目前仍缺乏大型随机对照的临床试验,因此,也没有统一的治疗方案。目前靶向治疗及免疫治疗在其他恶性肿瘤中已成为研究热点,但在AS中的研究很少。在软组织肉瘤中,免疫治疗患者获益率不甚理想,但部分报道证明有一定的疗效。另外,还有一些其他的治疗方式被证明在软组织肉瘤中有效,虽然不能完全等同于血管肉瘤的治疗,但也为我们治疗AS提供了新的选择和思路。
由于组织来源不同,AS有其特殊性。除了针对VEGFR及其下游通路的研究,Behjati等还发现AS中存在酪氨酸磷酸酶、B型受体(PTPRB)和磷脂酶Cγ1(PLCG1)的突变。其中PTPRB和PLCG1的突变频率达到了26%和9%[47]。另外,Shimozono等通过小鼠成瘤实验证实了NUP160增加血管瘤的生长优势[48]。Rajmohan等检测了AS中有丝分裂原激活蛋白(MAP)激酶途径突变的富集,发现KRAS、HRAS、NRAS、BRAF、MAPK1和NF1的突变,每个突变的频率为5%~35%[49]。Huang等通过对120例血管肉瘤的基因分析,得出PLCG1、KDR、MYC和FLT4的基因状态与AS的不同亚型有关,与预后也密切相关[50]。另外,有研究证实survivin在AS中过度表达,可能是AS的潜在标志物和治疗靶点。叉头框蛋白M1(FOXM1)是皮肤AS的预后标志物,亦是候选的药物靶点[51]。近年来microRNA(miRNA)调控异常是研究的热点。在5例AS患者中观察到miR-497-5p下调,miR-497-5p调节AS细胞系的增殖、迁移和侵袭[52]。
总之,由于血管肉瘤发病极为罕见,最新中英文文献报道均较少,多为年代较远的个案报道。本文总结相关国内外文献,结合本单位相关多学科联合诊疗(MDT)专家小组临床经验,认为由于临床表现不典型和常规病理的罕见性,血管肉瘤极易误诊,准确全面的病理诊断和免疫组织化学及完善分子病理学检测极为重要,建议所有初诊病理切片至少送两家以上的三甲医院病理科会诊,以减少误诊。治疗上,血管肉瘤作为一种罕见且特殊的间叶源性恶性肿瘤,个体化治疗尤为重要,对于早期或局限期的血管肉瘤,完整外科手术切除和术后放疗仍然是主要的治疗手段,一旦扩散转移预后极差,姑息放化疗疗效通常较差,目前靶向治疗和免疫治疗逐渐显示出一定疗效,这些治疗靶点均可能是血管肉瘤未来药物研发、精准治疗的研究方向。

