饲料脂肪水平对血鹦鹉鱼吸收虾青素效果、生长性能和血清生化指标的影响
邬国强,汪学杰,牟希东,刘 超,刘 奕,杨叶欣,胡隐昌,宋红梅
(1.中国水产科学研究院珠江水产研究所,农业农村部休闲渔业重点实验室,广东省现代休闲渔业工程技术研究中心,广州 510380;2.上海海洋大学水产与生命学院,上海 201306)
血鹦鹉鱼(Viejasynspila♀×Amphilophus citrinellus♂),俗称发财鱼,属鲈形目(Perciformes),慈鲷科(Cichlidae),是由慈鲷科的父本红魔鬼鱼(Amphilophuscitrinellus)和母本紫红火口鱼(Viejasynspila)杂交获得,仔鱼期体呈黑色,成鱼期体通红,呈椭圆状。因其体色鲜艳,体态喜人,深受消费者喜爱,是观赏鱼市场中主要的销售品种之一。传统的观赏鱼饲料多以鲜活的饵料为主,如丰年虫(Eubranchipusvernalis)、黄粉虫(Tenebriomolitor)、羽摇蚊幼虫(Chironomusplumosus)等,但相比于配合饲料,天然饵料有不易保存、容易变质、滋生细菌、造成水体环境污染等问题。给观赏鱼投喂营养全面、存储方便且安全性高的配合饲料是观赏鱼产业发展的必然趋势[1]。由于观赏鱼的品种繁多,国内研究观赏鱼的饲料针对性不强,目前针对特定观赏鱼种类营养需要的研究也不够深入。观赏鱼的培养更加重视体色和形态,因此围绕特定观赏鱼品种的营养配比研究要兼顾观赏鱼的体色要求和生长需要。
脂肪作为鱼类必需的营养物质之一,对鱼类的生长繁殖起着至关重要的作用[2]。据报道,饲料脂肪水平的不同可影响虹鳟(Sparusaurata)对类胡萝卜素的吸收利用,从而影响其体色[3-4]。付旭等[5]研究发现,饲料脂肪水平对淡黑镊丽鱼(Labidochromiscaeruleus)的色素蓄积有显著影响。然而饲料脂肪的添加水平并非越高越好,过度的添加可导致脂肪肝的发生和免疫力的下降[6]。类胡萝卜素是决定鱼类体色的主要物质[7],但鱼类自身并不能合成类胡萝卜素,必须通过投喂含类胡萝卜素的着色饲料达到增色效果,而类胡萝卜素是通过脂质代谢的途径被鱼体代谢和沉淀[8]。目前,观赏鱼增色饲料中最常用的增红剂是虾青素(astaxanthin,AST),然而虾青素价格昂贵,在着色饲料投入中占比大,鱼类对虾青素的消化利用率却较低,探索观赏鱼着色饲料中类胡萝卜素与脂肪的适宜添加配比,在节约虾青素用量的情况下达到理想着色效果是解决这一问题的关键。目前,有关血鹦鹉鱼营养相关研究主要集中在着色添加剂投喂量[9]、抗氧化能力[10]、非特异性免疫[11]等方面,但不同脂肪水平与虾青素的适宜配比研究鲜见报道,本研究通过添加不同水平的脂肪和定量的虾青素饲喂血鹦鹉鱼,以确定在不影响血鹦鹉鱼正常的生长条件下,着色饲料中脂肪的最适添加量,为观赏鱼着色饲料研究提供科学依据以节约成本。
1 材料与方法
1.1 实验用鱼及饲养管理
实验对象为540尾平均体质量为(28.84±4.84)g的血鹦鹉鱼,取自中国水产科学研究院珠江水产研究所观赏鱼基地。将试验鱼适应性驯养7 d后随机分为6组,每组3个重复,每个重复30尾鱼,放于规格为120 cm×60 cm×50 cm的玻璃鱼缸中。实验期间每日投喂2次(09∶00和16∶00),投饲率3%,饲养水温(27±1)℃,每周换曝气水3次,每次换水量为总体水量的1/3。养殖实验周期60 d。
1.2 实验饲料
实验饲料为自制配合饲料,以豆油为脂肪源,为排除饲料蛋白和能量的影响,饲料中添加了等量的鱼粉、豆粕、面粉、菜籽粕和棉籽粕,用纤维素调节脂肪的梯度。6个组分别为:饲喂含4‰虾青素的基础饲料作为对照组(L1组),饲喂4‰虾青素基础饲料并添加3%、6%、9%、12%、15%豆油的试验组(分别为L2、L3、L4、L5、L6组)。6个脂肪梯度组(L1、L2、L3、L4、L5、L6)饲料中脂肪的实测含量依次为2.93%、5.90%、8.89%、11.91%、14.94%、17.92%。添加剂的虾青素购于德国巴斯夫,纯度为10%。各组饲料原料粉碎机粉碎,并经过80目标准分样筛,混合均匀后,用小型颗粒机加工成直径为2 mm的沉性颗粒饲料,晾干后密封,-20℃保存备用。饲料配方组成见表1。

表1 实验饲料组成与饲料营养水平(风干基础)Tab.1 Composition and nutrient level of the experimental daily diet(air-dry basis)
1.3 样品采集
实验开始前和结束后,鱼禁食24 h,每个重复组取10尾鱼共计180尾进行体质量、体长测定,用于测定增重率和特定生长率指标。用1 mL注射器尾静脉采血,静止1 h后,用恒温离心机(4℃,6 000 r·min-1)离心15 min,分离血清,将血清样品-80℃保存,用于血清生化指标的测定。解剖鱼体,称取肝脏用于测定肝体比。采血后的试验鱼,其中每个重复组随机取5尾共计90尾血鹦鹉鱼,分别取约0.05 g鳞片、皮肤和尾鳍提取类胡萝卜素,鳞片和皮肤取自鱼体中部侧线部分。
1.4 指标测定
1.4.1 生长性能的测定

式(1)、式(2)中,W0为试验鱼的初始体质量;W1为试验鱼的终末体质量;t为实验天数。
1.4.2 血鹦鹉鱼背部色度值的测定
采用国际发光照明委员会CIE规定的L*(luminance,亮度)、a*(redness,-a*表示偏绿色,+a*表示偏红色)、b*(yellowness,-b*表示偏蓝色,+b*表示偏黄色)值来代表鱼体颜色的状态[12]。使用CR-400型色彩色差计(柯尼卡-美能达,日本)测定各组鱼体背鳍下方及侧线上方之间区域体色的L*、a*、b*值,并进行统计分析,检验饲料脂肪水平对虾青素吸收的影响,使用前用白板校准,并将鱼体表面的水分擦干。实验结束后,每缸随机选取6尾鱼,每组共18尾鱼进行测定,测定位置为鱼身体背鳍下方及侧线鳞上方之间的区域。
1.4.3 类胡萝卜素含量的测定
类胡萝卜素的提取和测定方法参考BOONYARATPALIN等[13]的方法,类胡萝卜素含量的计算公式如下:

式(4)中,S为类胡萝卜素含量(mg·kg-1);A为吸光度值;K为常数(10 000);V为提取液体积(mL),E为吸光系数(2 500);G为样品质量(g)。
1.4.4 血清指标分析
近代以来,霍布斯在将计算与心智结合的过程中扮演了重要的角色,而莱布尼茨为霍布斯的“革命性”尝试搭建了机械化平台。霍布斯是第一个清晰地把思维的句法表述为“计算”的人,他认为,思维就是以计算的形式,处理那些具有普遍性的词,由此开始了通过数字的形式把握人类认知的研究。莱布尼茨设计了一种推理机器,即“机器推理者”,用它模拟人类思维的过程。根据莱布尼茨的解释,这种推理机器能够独立执行认知任务,推理没有必要假借他人之力。尽管这样的认知系统完全是机械的,跟现代电子计算机没有可比性,但是它诞生的意义是非凡的,因为它被看作是体现经典计算主义思想萌芽的最早成果。
血清生化指标采用购自南京建成生物工程研究所的总胆固醇(T-CHO)测试盒、游离脂肪酸(NEFA)测试盒、总胆汁酸(TBA)测试盒、总蛋白(TP)定量测试盒进行测定。
1.5 数据统计与分析
实验数据用Excel 2019处理,均以“means±SD”表示,结果用Statistica 6.0进行相关性检验,采用单因素方差分析(one-way ANOVA)做显著性检验,用最小显著差异法(least significant difference,LSD)进行组间多重比较,显著差异水平设为P<0.05,并利用Origin 9.1作图。
2 结果与分析
2.1 饲料脂肪水平对血鹦鹉鱼生长性能的影响
由表2可知,随着饲料脂肪添加水平的升高,血鹦鹉鱼的末体质量、SGR、WGR均呈先升高后下降、在L6组再上升的趋势。当饲料脂肪水平为11.91%(L4组)时,血鹦鹉鱼的末体质量、SGR和WGR达到最大,分别为40.86 g、0.63%·d-1和5.22%,均显著高于其他组(P<0.05)。HSI除L2组外,其他组均随着饲料脂肪添加水平升高而升高,各组间均有显著性差异(P<0.05)。
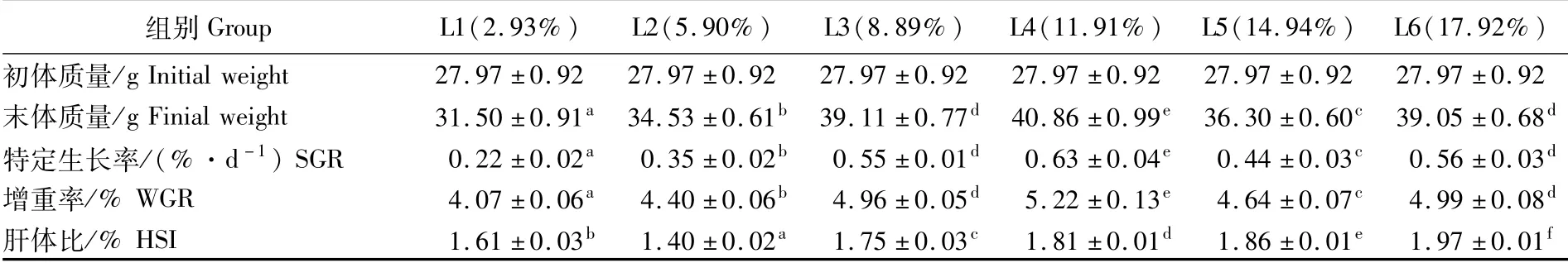
表2 饲料脂肪水平对生长性能的影响Tab.2 Influence of dietary lipid level on growth performance
2.2 饲料脂肪水平对血鹦鹉鱼体表色度值L*、a*、b*的影响
由表3可知,饲料中脂肪水平对血鹦鹉鱼中表示亮度值的L*值无显著性影响(P>0.05),但对表示红色值的a*值和表示黄色值的b*值有影响。随着饲料脂肪水平升高,表示体表红色值的a*值呈现先增大后减小的趋势,L4组a*值最大,且显著高于L1、L2、L3、L5和L6(P<0.05)。饲料脂肪添加水平对b*值的影响与a*值类似,整体呈先增大后减小的趋势,L3组b*值最大,显著高于L1、L2、L5和L6组(P<0.05),与L4组无显著性差异(P>0.05)。

表3 饲料脂肪水平对体表L*、a*、b*值的影响Tab.3 Influence of dietary lipid levels on value of L*,a*,and b*in body surface
2.3 饲料脂肪水平对血鹦鹉鱼组织中类胡萝卜素含量的影响
从图1可知,饲料脂肪水平对血鹦鹉鱼鳞片、皮肤和尾鳍中的类胡萝卜素含量都有显著性影响(P<0.05),随着饲料脂肪水平的升高,鳞片、皮肤和尾鳍中的类胡萝卜素含量均呈现先升高后降低的趋势。其中,L5组鳞片中的类胡萝卜素含量显著高于L1、L2、L3、L4组(P<0.05),但和L6组无显著性差异(P>0.05);皮肤组织中,L4组的类胡萝卜素含量最高,且显著高于L1、L2、L5和L6组(P<0.05),但与L3组无显著性差异(P>0.05)。尾鳍中,L4组的类胡萝卜素含量也最高,且显著高于其他组(P<0.05)。
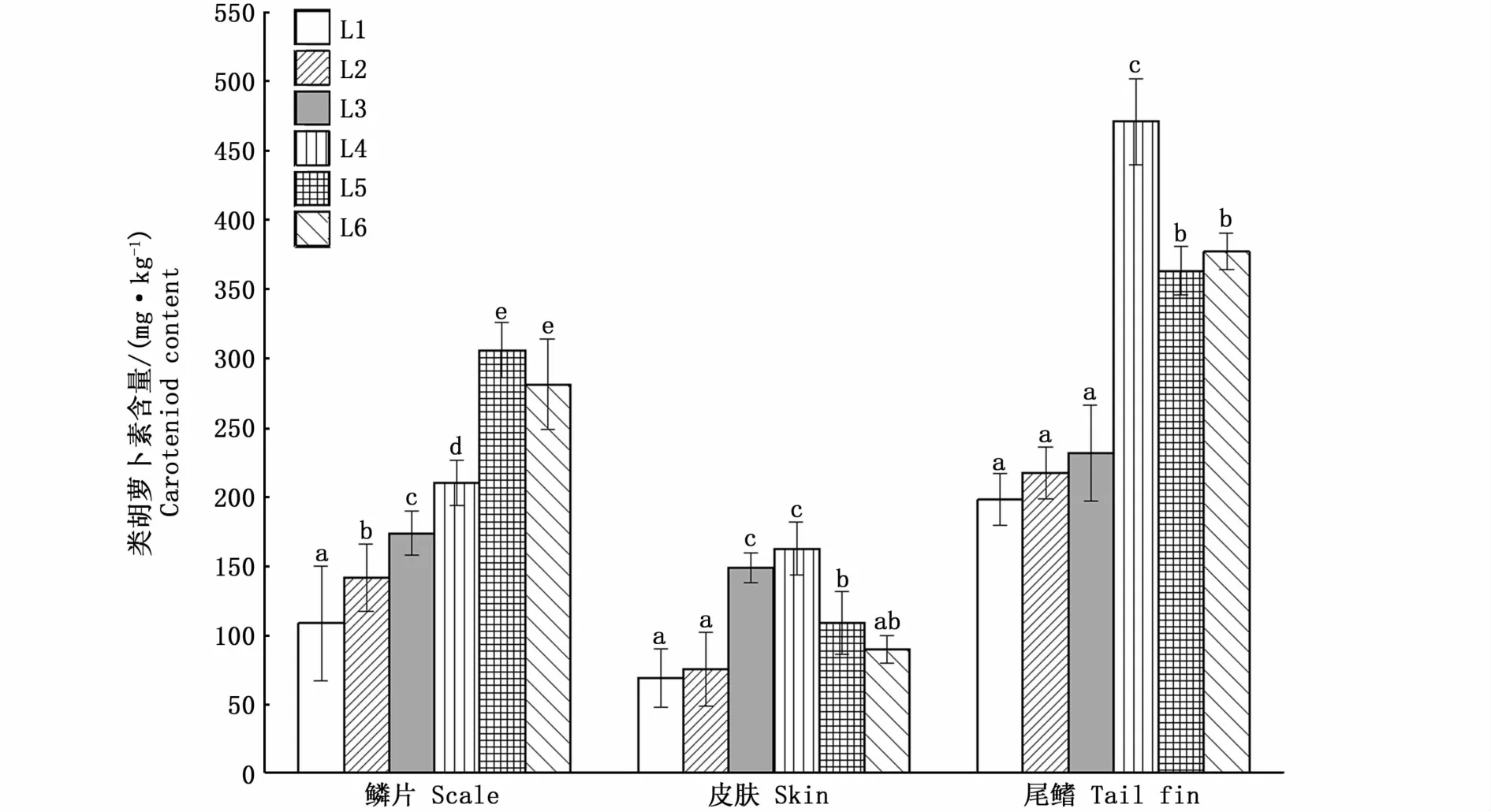
图1 饲料脂肪水平对血鹦鹉鱼鳞片、皮肤和尾鳍类胡萝卜素含量的影响Fig.1 Influence of dietary lipid levels on cartenoid content in scale,skin and tail fin of Vieja synspila♀×Amphilophus citrinellus♂
2.4 饲料脂肪水平对血鹦鹉鱼血清生化指标的影响
由表4可知,总胆固醇(TCHO)和总蛋白(TP)含量随着饲料脂肪添加量的增加呈先上升后下降的趋势,L5组的TCHO含量最高,显著高于其他各组(P<0.05),TCHO和TP含量均为试验组(L2~L6)显著高于对照组(L1)(P<0.05)。总胆汁酸(TBA)从L3组开始随脂肪水平的增加呈现先升高后降低的趋势,L4组TBA含量达到最高值,且显著高于其他组(P<0.05)。低密度蛋白胆固醇(LDL-C)的含量与饲料脂肪水平呈正相关,L5组的LDL-C含量最高,且显著高于L1至L4各组(P<0.05),但与L6无显著差异(P>0.05)。不同组的游离脂肪酸(NEFA)的含量无明显变化规律,但各试验组(L2至L6)均显著低于对照组(L1组)(P<0.05)。
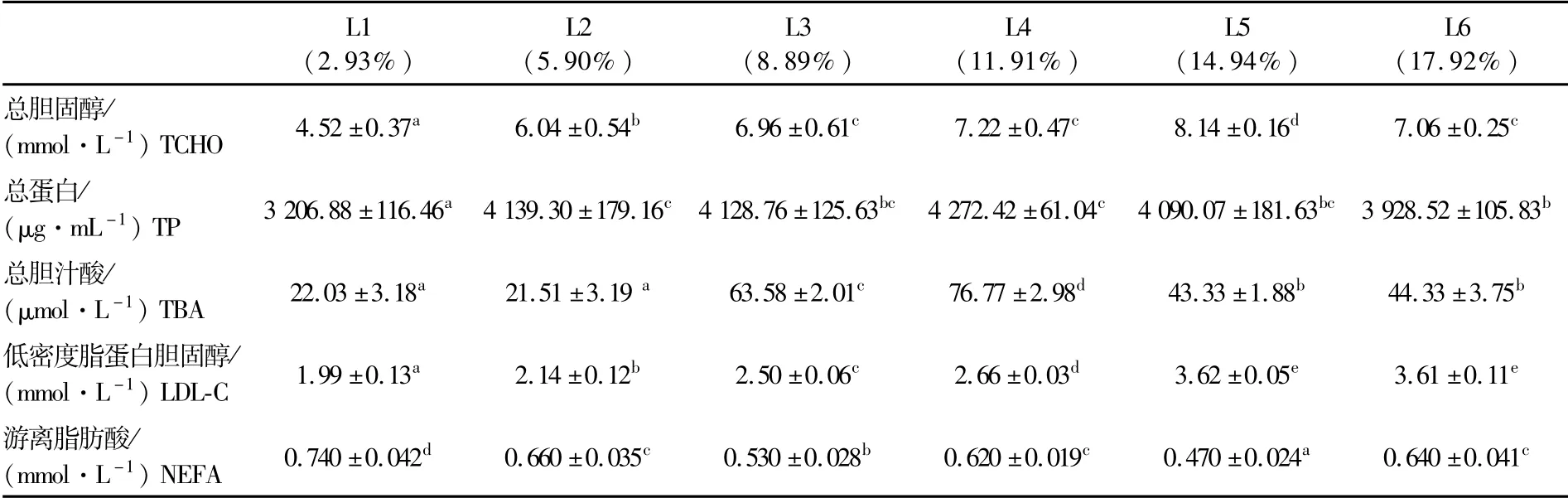
表4 饲料脂肪水平对血鹦鹉鱼各项血清生化指标的影响Tab.4 Influences of dietary lipid levels on biochemical indices of serum of Vieja synspila♀×Amphilophus citrinellus
3 讨论
3.1 饲料脂肪水平对血鹦鹉鱼生长性能的影响
脂肪是维持鱼体正常生长和发育的重要营养素之一,也是重要的能量来源。在饲料中提高脂肪的含量,可以有效的节约蛋白质,促进鱼体生长,还能降低饲料系数[14]。本实验中,饲料脂肪水平为11.91%时(L4组),血鹦鹉鱼的特定生长率和增重率均为最高,表明血鹦鹉鱼生长性能最佳。研究发现,饲料脂肪水平为6.88%时,胭脂鱼(Myxocyprinusasiaticus)的SGR和WGR最高,推荐的最适脂肪水平为6.62%~7.02%;饲料脂肪水平为9.4%时,淡水黑鲷(Hephaestus fuliginosus)[15]的SGR最高,生长性能最好;饲料脂肪水平为10.68%时,点篮子鱼(Siganus guttatus)幼鱼[16]的SGR和WGR最高;参照SGR为指标,40 g左右规格的军曹鱼(Rachycentron canadum)的脂肪需求量为13.97%~14.16%,500 g左右规格的军曹鱼为13.18%~13.47%[17]。说明鱼的不同种类、生长阶段对脂肪的需求量也大为不同。本实验中,在2.93%~11.91%的脂肪添加水平内,血鹦鹉鱼的SGR和WGR随着饲料脂肪水平的升高逐渐升高,且存在显著差异,说明在一定饲料脂肪水平范围内,血鹦鹉鱼的生长性能随饲料脂肪水平的升高而升高,这与 胭 脂鱼[6]、瓦氏黄颡鱼(Pelteobagrus vachelli)[18]和 异 育 银 鲫(Carassiusauratus gibelio)[19]等的研究结果趋势基本一致。肝脏是鱼类脂肪代谢的主要场所和重要的营养储存器官,肝体比可以反映养殖过程中鱼类肝脏的生理状态。但本实验中,随着饲料脂肪水平的升高,血鹦鹉鱼HSI呈上升趋势,推测过高的脂肪水平促使肝脏中的脂肪细胞数目增多、体积变大[20-21],使得肝脏中出现过量脂肪沉积,从而导致肝体比增加,肝组织受损,这与奥尼罗非鱼(Oreochromis aureus×O.niloticus)幼鱼[22]、白甲鱼(Onychostoma sima)幼鱼[14]和红鳍东方鲀(Takifugurubripes)幼鱼[23]的研究结果相似。
3.2 饲料脂肪水平对血鹦鹉鱼体表色度值L*、a*、b*的影响
虾青素是水产动物主要的呈色物质[7],a*和b*值的高低反映了鱼体表红色和黄色的量化程度。本实验中,随着饲料脂肪水平的升高,a*值、b*值和类胡萝卜素含量呈现相一致的变化趋势,这说明红色和黄色值与血鹦鹉类胡萝卜素含量呈正相关关系,适当提高饲料脂肪水平,在一定范围内对血鹦鹉鱼的体色增红有明显促进作用。本实验还发现,皮肤的a*值和b*值的最高值分别出现在L4和L3组,之后出现下降,说明过高的脂肪含量无益于类胡萝卜素的吸收,这与付旭等[5]对淡黑镊丽鱼(Labidochromiscaeruleus)和崔培等[24]对锦鲤(Cyprinuscarpio)的研究结果一致。
3.3 饲料脂肪水平对血鹦鹉鱼组织中类胡萝卜素含量的影响
本实验中,在等量虾青素添加下,适当增高饲料脂肪水平可明显促进血鹦鹉鱼鳞片、皮肤和尾鳍的虾青素沉积。孙向军等[25]研究表明,不同饲料脂肪水平对锦鲤体色影响也有相似结果。BARBOSA等[26]报道在加入等量虾青素的饲料中,脂肪水平较高的虹鳟血清中的虾青素含量相应较高,有更多的虾青素沉积。崔培等[24]报道当饲料脂肪的添加水平在5.60%~14.20%时,锦鲤皮肤中类胡萝卜素也呈先升高后降低的趋势。TORRISSEN和CHRISTIANSEN[27]研究表明,随着虹鳟饲料中脂肪水平的升高,虾青素的表观消化率增加,也证明脂肪可以影响鱼类对虾青素的吸收和利用,从而影响鱼类的体色。本实验中,脂肪水平超过11.91%时,皮肤中的类胡萝卜素含量显著降低(P<0.05),说明当饲料脂肪添加超过一定量,反而会影响类胡萝卜素沉积。当虾青素含量为400 mg·kg-1,添加的饲料脂肪为11.91%时,血鹦鹉鱼所能沉积的色素量达到峰值,超过吸收饱和量的类胡萝卜素不能沉积于体内。实验结果可见,相比鳞片和皮肤部位,类胡萝卜素在尾鳍中沉积量最大。张晓红等[28]在对血鹦鹉体色的研究中发现,当虾青素添加量在30~900 mg·kg-1时,尾鳍中类胡萝卜素均高于皮肤,本实验结果与其相似。
3.4 饲料脂肪水平对血清生化水平的影响
血液中的TP含量是反映鱼体吸收和代谢蛋白质的重要指标,TP具有维持血管内渗透压平衡、运输多种代谢物等多种功能,能够反映鱼体的健康状 况[29]。吉 富 罗 非 鱼(O.niloticus)[30]、鳡(Elopichthysbambusa)幼鱼[31]等的研究结果表明,随着饲料脂肪水平的升高,血清中的TP的含量呈下降趋势,而本研究中血鹦鹉鱼的TP含量呈先上升后下降的趋势,但各试验组鱼的TP均高于低脂肪含量的L1对照组,当饲料脂肪添加水平大于11.91%(L4组)时,血鹦鹉鱼血液中的TP含量出现下降趋势,这可能与蛋白质利用率相关,匙吻鲟(Polyodonspathula)的TP含量也表现为高脂组(11.64%)显著高于低脂组(3.01%)[32],刘阳洋等[32]也认为,在一定范围内提高脂肪添加水平可以促进匙吻鲟对蛋白质的吸收,但饲料脂肪水平过高则无益于提高饲料蛋白的利用率。
血清TCHO与鱼类营养状况密切关联,常用于反映生物对脂肪的代谢状况[33],TCHO含量升高表明内生脂肪转运状态活跃,是脂肪运转系统对高脂肪饲料的应答[34]。本实验结果显示,血清TCHO与TP相似,呈现先升高后下降的变化趋势,低脂对照组(L1组)的TCHO含量显著低于其他各高脂肪试验组,这与褐菖鲉(Sebastiscus marmoratus)、额尔齐斯河银鲫(Carassiusauratus gibelio)[35]、白甲鱼幼鱼[14]、大口黑鲈(Micropterus salmoides)[36]的研究结果基本一致,它们的最适脂肪添加量均在8%~11%。本实验中,饲料脂肪添加水平小于14.94%(L5组)时,血鹦鹉鱼血清中TCHO持续升高,推测可能是血鹦鹉鱼吸收的脂肪经肝脏合成并转运至血液中的胆固醇,致使其不断升高,而当饲料脂肪添加水平超过14.94%,TCHO含量开始下降,此结果可能是脂肪肝发生后肝细胞破损,肝功能受损,进而合成并转运到血液中的胆固醇含量减少造成的[37]。但在奥尼罗非鱼幼鱼和鱤[31]幼鱼中,其脂肪建议最适添加浓度是相对较低的6%和8%左右,TCHO含量随饲料脂肪水平的升高呈下降趋势。可能饲料脂肪水平对TCHO的影响在不同鱼类、不同生长阶段也不同。
低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)是反映脂类在动物体内分解转运的重要反馈指标[14,33],LDL-C将肝脏合成的内源性CHL从肝细胞转运到机体组织细胞,临床认为血清LDL-C的升高可能预示肝功能异常或其他代谢问题[39],本研究中,随着饲料脂肪添加水平的升高,各试验组血清LDL-C为上升趋势,这与军曹鱼[17]、褐菖鲉[38]、额尔齐斯河银鲫[35]、匙吻鲟[32]等的研究结果基本一致。推测血鹦鹉鱼将肝脏转运到血液中的CHL降低,饲料脂肪水平对血鹦鹉鱼的肝功能产生了一定影响。
胆汁酸(TBA)是肝脏细胞内胆固醇的一种代谢产物,对脂肪的代谢有重要作用,其生成与代谢和肝脏关系密切,TBA水平是反映肝实质损伤的一项重要指标[40-41]。一般情况下血清中胆汁酸含量极低,当肝细胞受到损害时,肝细胞对胆汁的摄取功能降低,直接影响胆汁酸及胆固醇的代谢,导致血清中胆汁酸含量升高[40]。随着饲料脂肪含量的增加,血鹦鹉鱼血清总胆汁酸从L3组开始显著升高,到L5时又出现降低趋势,L4组TBA含量达到最高值,但高脂肪试验组的TBA含量均显著高于低脂肪对照组(P<0.05),在鳡[31]、白甲鱼[14]、额尔齐斯河银鲫[35]等上也有类似的先升后降或持续上升但试验组TBA值均高于对照组的结果,这说明饲料中过高的脂肪水平使血鹦鹉鱼肝脏细胞组织发生了一定的生理病变。与此相应的是,肝体比(HIS)也呈现持续升高的趋势。
4 小结
适量的饲料脂肪添加可提高血鹦鹉鱼对虾青素的吸收效率,增强其免疫力,并促进其生长,过高的脂肪水平却可引起肝损伤。在本实验条件下,结合对虾青素的利用率、血清生化指标和生长性能,血鹦鹉鱼着色饲料(4‰虾青素)中适宜的脂肪水平为11.91%~14.94%。本研究可为血鹦鹉鱼着色饲料配置提供参考。

