中华绒螯蟹病原豚鼠气单胞菌的鉴定及其致病性分析
周丽颖,姜姿妍,钱且奇,陈 圳,顾舒文,李 杰,纪 鹏,高晓建,姜 群,张晓君
(扬州大学动物科学与技术学院,江苏扬州 225009)
中华绒螯蟹()隶属于甲壳纲(Crustacea)十足目(Decapoda)弓蟹科(Archaeidae),是我国重要的特种水产养殖品种之一。随着养殖密度的加大及养殖生态环境的恶化,由细菌感染引起的疾病给中华绒螯蟹养殖生产带来了严重损失,如弗氏柠檬酸杆菌()感染可引起中华绒螯蟹“黑鳃病”,拟态弧菌()感染可导致中华绒螯蟹“腹水病”,点状产气单胞菌()感染可引起中华绒螯蟹肠炎等疾病。
豚鼠气单胞菌()是一种革兰氏阴性、氧化酶阳性的兼性厌氧杆菌,隶属于气单胞菌科气单胞属。该菌是一种人兽共患病原体,可导致免疫功能正常或低下的人患各种感染并发症,如泌尿系统感染、呼吸道感染、胆道感染,严重感染者发生休克甚至死亡。同时豚鼠气单胞菌也是鱼类和其他冷血动物的重要病原,有报道豚鼠气单胞菌可感染草鱼()、南方鲇()、鲈()、罗氏沼虾()、南美白对虾()等多种水生生物并造成大量死亡。2021年江苏苏州某养殖场的中华绒螯蟹出现大规模死亡现象,病蟹主要表现为活力减弱,摄食减少。从濒死中华绒螯蟹肝胰腺组织中分离到优势生长细菌,经理化特性和分子鉴定确定其为豚鼠气单胞菌,本实验对其进行了致病性、毒力基因检测及耐药性分析,旨在为中华绒螯蟹细菌性疾病的有效防控提供理论参考。
1 材料与方法
1.1 实验材料
2020年10月于苏州地区某养殖场取发病蟹,体重为150~200 g,采样时水温22 ℃,pH 8.0,溶氧为3 mg/L;该养殖场为精养模式,放苗密度为1 000~1 200只/667 m;自7月份开始发病,累积死亡率达30%以上。
1.2 细菌分离
患病蟹经生理盐水冲洗多次后,用75%酒精进行蟹体表面消毒,无菌操作取肝胰腺组织,在LB培养基进行接种划线,28 ℃培养24 h,选择形态一致的优势菌落进一步划线纯化,于30%甘油管中-40 ℃冰箱保存备用。
1.3 组织病理切片观察
用波恩氏液固定患病蟹鳃和肝胰腺组织24 h,用70%酒精保存。将组织脱水、透明、打蜡、石蜡包埋后,用切片机切片(3~6 μm),然后HE染色,中性树脂胶密封,用于显微镜的观察。健康蟹鳃和肝胰腺组织为对照。
1.4 人工感染试验
选取平均体质量为(6.00±1.93) g健康蟹360只暂养1周后进行人工感染实验。将分离菌SHZ1接种于普通营养肉汤,28 ℃培养过夜后用无菌生理盐水将供试菌液稀释到1.8×10、1.8×10、1.8×10、1.8×10和1.8×10CFU/mL。实验组于健康中华绒螯蟹第三步足基部注射0.1 mL菌液,对照组注射等量生理盐水,每组设三个平行。定时对中华绒螯蟹的死亡情况进行观察记录,以引起中华绒螯蟹发病死亡并能重新分离回收到原感染菌作为分离菌致病性的判定标准,并计算分离菌对中华绒螯蟹的半数致死量(LD)。
1.5 分离菌形态观察和理化特性测定
取分离菌SHZ1进行革兰氏染色,同时将分离菌SHZ1滴于经聚醋酸甲基乙烯脂膜包被的铜网上并静置1 min,用0.5%磷钨酸水溶液负染1 min,最后自然干燥后利用Tecnai 12透射电子显微镜(Philips,荷兰) 进行拍照观察。另外将分离菌SHZ1接种于微量生化管(杭州天和微生物试剂有限公司)测定氧化酶、接触酶、乳糖、甘露糖、蔗糖等理化指标,参照文献[16]进行。
1.6 gyrB基因系统发育学分析
通过DNA抽提试剂盒提取分离菌的DNA作为模板,对菌株基因进行扩增。PCR反应条件参照张晓君等方法进行,扩增产物交由上海生工测序。对分离菌的基因序列通过NCBI的Blast检索系统进行序列比对以及同源性分析,运用MEGA 7.0邻接法构建系统发育树。
1.7 病原菌胞外酶活性检测
分离菌的胞外蛋白酶活性、卵磷脂酶活性、脂酶活性、DNA酶活性、明胶酶活性采用平板检验方法。将处于对数生长期的分离菌株点种于含有脱脂牛奶(10%)、蛋黄液(10%)、吐温80(1%)、DNA(0.5%)、明胶(10%)的平板中,于28 ℃恒温培养24 h后观察。含脱脂牛奶、蛋黄液及吐温80的平板可以直接观察水解圈;含DNA的平板则在观察之前加入1 mol/L的HCl覆盖平板。透明的水解圈区域显示有酶活。含明胶的平板于28 ℃恒温培养24 h后,置于4 ℃冰箱中过夜后观察。所有实验均重复3次。
1.8 病原菌毒力相关基因检测
选取热敏蛋白酶()、溶血素()、弹性蛋白酶()、外膜蛋白()、胆固醇酰基转移酶()以及鞭毛蛋白(、、、)共9个毒力相关基因。根据豚鼠气单胞菌全基因组序列(GenBank CP016762),采用Primer Premier 5.0软件设计特异性引物(见表1),由上海生物工程有限公司合成,进行PCR扩增。PCR反应体系共20 μL:2×Power Taq PCR MasterMix 10 μL,正反引物各0.5 μL(10 μmol/L),模板DNA 1 μL,无菌双蒸水8 μL,并以ddHO替代DNA模板作为空白对照;扩增条件为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1 min,循环35次;最后72 ℃延伸7 min。用1%琼脂糖凝胶电泳进行检测,以扩增片段的有无及大小判断相应毒力基因的存在情况。

表1 毒力基因PCR引物Tab.1 Primers of virulence genes for PCR
1.9 耐药性检测
采用纸片扩散法(K-B)对分离菌SHZ1进行耐药性测定,将分离菌SHZ1的浓度调整至1.8×10CFU/mL,吸取100 μL菌液涂布于营养琼脂平板,将药敏纸片(购自杭州天和微生物试剂有限公司产品)贴于平板上,28 ℃中培养24 h后测量抑菌圈直径(mm)。根据杭州天和微生物试剂有限公司产品说明书:抑菌圈直径大于等于17 mm为敏感,抑菌圈直径大于等于14 mm小于17 mm为中介,抑菌圈直径小于14 mm为耐药,根据抑菌圈直径判定分离菌SHZ1的耐药性。
2 结果
2.1 组织病理切片观察
组织病理切片观察显示患病蟹鳃丝腔中的上皮细胞形成的腔隔膜结构在感染后被破坏。鳃丝柱状细胞发生崩解,导致上皮层解体,鳃腔裸露。鳃小片局部区域扭曲变形,末端异常膨胀(图1-a)。

图1 患病蟹组织病理变化Fig.1 Change of hepatopancreas and gills microstructure in the diseased E.sinensis
观察中华绒螯蟹肝胰脏组织切片的结构发现,对照组肝小管结构清晰,基底膜完整,细胞核整齐地排列在基底膜侧(图1-B)。患病蟹肝小管的细胞结构模糊并随意排列,血细胞数量增加,出现空泡状结构,基底膜明显增厚(图1-b)。
2.2 分离菌的致病性
分离菌SHZ1感染中华绒螯蟹一周内死亡情况见表2,菌株SHZ1对中华绒螯蟹半数致死量为1.6×10CFU/mL。感染后中华绒螯蟹出现活动缓慢,反应迟钝等症状。取人工感染中华绒螯蟹肝胰腺组织进行细菌分离,将分离菌进行分子鉴定及理化特性检测,结果均与菌株SHZ1一致,表明豚鼠气单胞菌是引起此次苏州某养殖场中华绒螯蟹大规模死亡的病原菌,且对其有很强的致病性。
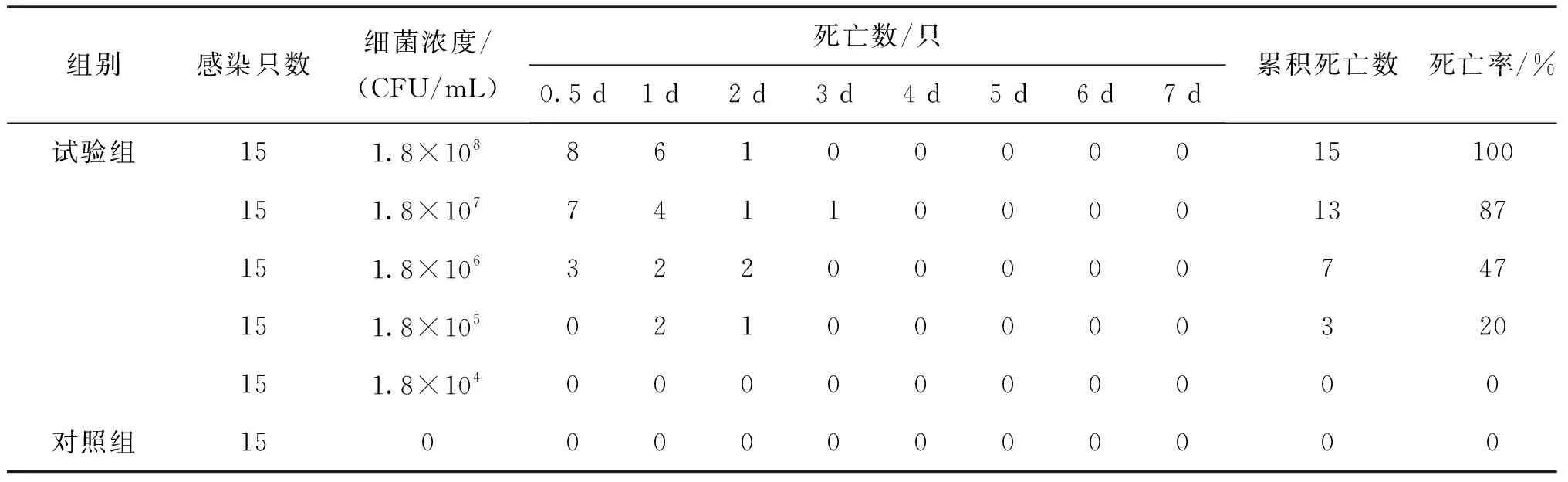
表2 分离菌SHZ1对中华绒螯蟹致病性分析Tab.2 Pathogenicity of strain SHZ1 to E.sinensis
2.3 分离菌形态特征及理化特性
透射电镜观察分离菌两端钝圆、呈杆状、单生鞭毛,大小为1.2~1.6 μm×0.6~1.0 μm(图2)。分离株SHZ1理化性质见表3。β-半乳糖苷酶、七叶苷、接触酶、氧化酶呈阳性,能利用纤维二糖、木糖、蔗糖、鼠李糖等。不能利用乳糖、阿拉伯糖、棉子糖、枸橼酸盐等,这与豚鼠气单胞菌的理化性质相一致。

图2 透射电镜下分离菌株SHZ1的形态Fig.2 Electron micrograph of strain SHZ1
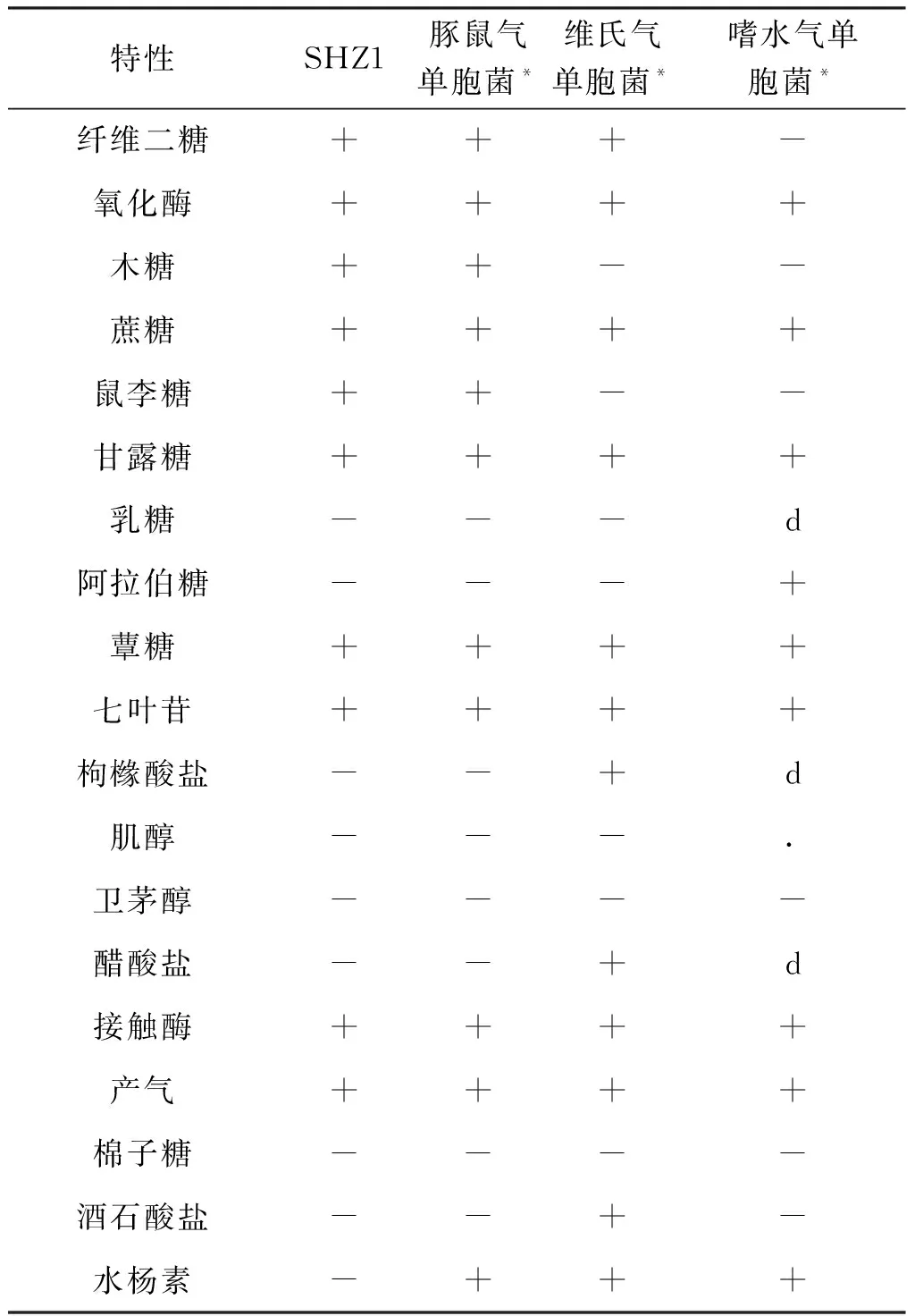
表3 分离菌株理化特性结果Tab.3 Results of physical and chemical properties of isolated strains

续表3
2.4 gyrB基因序列分析及系统发育学分析
分离菌SHZ1所扩增的基因序列长度为1 164 bp(GenBank登录号:MK990283)。对SHZ1进行基因序列同源性分析,结果与气单胞菌属细菌的相似性达99%,其系统发育树如图3,菌株SHZ1与豚鼠气单胞菌聚为一支。结合该菌的形态特征、理化特性、基因序列系统发育学分析结果,鉴定分离菌为豚鼠气单胞菌。

图3 基于gyrB 基因序列所构建的菌株SHZ1的系统发育树Fig.3 Phylogenetics tree based on gyrB gene sequence of strain SHZ1
2.5 分离菌毒力基因检测
通过PCR检测发现菌株SHZ1可检测出、、、、、、、及共9种毒力基因(图4),这些毒力基因可作为检测病原性豚鼠气单胞菌的生物学标记。

图4 SHZ1菌株毒力基因PCR扩增结果Fig.4 Detection of virulence genes by PCR in strain SHZ1
2.6 胞外酶检测结果
病原菌SHZ1胞外酶检测结果表明,分离菌具有卵磷脂酶、酪蛋白酶、脂肪酶以及明胶酶活性,但不具有DNA酶活性。
2.7 耐药性检测
纸片扩散法测定豚鼠气单胞菌对供试34种抗菌类药物耐药性结果见表4。试验结果表明:菌株SHZ1对青霉素类、呋喃类、头孢菌素类的头孢唑啉、氨基糖苷类的万古霉素、以及大环内酯类的克拉霉素、克林霉素等9种药物耐药。对头孢菌素类的头孢噻吩、氨基糖苷类如卡那霉素等5种药物中介。对头孢菌素类如头孢呋辛、氨基糖苷类如阿米卡星等20种药物敏感。

表4 分离菌SHZ1药敏试验结果Tab.4 The drug sensitivity test of strain SHZ1

续表4
3 讨论
近年来,陆续有报道豚鼠气单胞菌可引起金鱼()、长丝鲈()、克氏原螯虾()、匙吻鲟()等水生生物患病死亡。本次从发病中华绒螯蟹肝胰脏组织中分离到优势生长菌,人工感染试验能引起健康蟹的发病死亡,对分离菌进行了理化特性方面的检验及系统发育学分析,表明豚鼠气单胞菌SHZ1对中华绒螯蟹具有致病性,是引起苏州养殖场大规模发病死亡的病原菌。
豚鼠气单胞菌属于气单胞菌属的嗜温性气单胞菌,普遍存在陆地和水环境中,能感染水生动物引起其发病甚至死亡,具有较强的致病性。而气单胞菌的致病性与其分泌大量毒力因子有关,诱导肠上皮细胞分泌活性氯,对肠组织造成严重损伤。克服了宿主的防御机制,导致组织损伤。鞭毛与细菌的毒力强弱息息相关,并且每个亚单位对于组成鞭毛都至关重要,基因参与鞭毛基体的环形成,基因则与基因一起构成操纵子,调控鞭毛的形成。基因的突变,会导致端生鞭毛的丧失以及生物膜形成的减少。对细胞膜中磷脂的作用可能破坏细胞膜的完整性,导致细胞裂解。在增强细菌粘附、维持外膜结构、逃避宿主杀伤等方面起到重要作用。李婉萍等曾对豹源豚鼠气单胞菌进行上述部分毒力基因的扩增,检测出、和三种毒力基因。而本实验对上述9种毒力基因进行扩增,结果显示,分离菌SHZ1携带、、、、、、、和共9个毒力基因,说明豚鼠气单胞菌和其他气单胞菌一样,毒力基因具有多样性。
鳃组织是中华绒螯蟹的重要呼吸器官,是防止水生疾病侵蚀的主要障碍。它在渗透压的调节和离子平衡的调节中也起重要作用。中华绒螯蟹的肝脏和胰腺是重要的免疫器官,其组织结构的变化也可在某种程度上反映了机体对环境的适应性改变。本研究发现,病蟹活动性明显减弱,鳃组织上皮细胞出现破坏和崩解,鳃腔隔破裂并瓦解,鳃腔中的血细胞数量减少。病蟹肝胰腺组织基膜破裂,上皮细胞排列紊乱、大量空泡化、管腔膜破裂、破碎的细胞组织进入管腔等现象。该现象与周慧华等研究结果类似,说明细菌性肝胰腺坏死不引起肝胰腺明显水肿与萎缩。以上结果表明,豚鼠气单胞菌的感染对中华绒螯蟹有明显的毒性作用,并对其鳃组织和肝胰腺组织造成一定的损害。
本研究细菌耐药性分析表明,分离菌对头孢呋辛、头孢噻肟、大观霉素、四环素等20种抗菌药敏感,而对头孢唑啉、万古霉素、苯唑西林、青霉素G等9种药物耐药。从长丝鲈中分离到的豚鼠气单胞菌对青霉素、新生霉素、链霉素、复方新诺明等8种药物耐药。从中华绒螯蟹中分离到的豚鼠气单胞菌对氨苄西林、麦迪霉素、万古霉素等3种抗生素耐药。以上研究表明不同宿主内分离到的豚鼠气单胞菌对药物的耐药性有所不同。因此,根据药敏试验结果选择合适的水产药物治疗细菌导致的疾病显得尤为重要。同时还需考虑用药剂量,给药方式等问题,达到高效防治病害发生的目的。

