近平滑假丝酵母ATCC 7330羰基还原酶CpCR突变体酶的稳定性研究
龚大春,王德林,万里,刘润,吕育财,罗华军,宋婷*
1(中国轻工业功能酵母重点实验室(三峡大学),湖北 宜昌,443002)2(三峡大学 生物与制药学院,湖北 宜昌,443002)
羰基还原酶在功能有机酸[1-3]和手性羟基化合物[4-6]合成中具有巨大的应用前景,但是该酶在耐热、耐溶剂、耐剪切等方面的稳定性有待进一步提高[7-9]。曹块[10]发现羰基还原酶存在热稳定性差、半衰期(t1/2)短,机械搅拌会加速酶失活等不足,GROSCH等[11]研究发现近平滑假丝酵母的羰基还原酶CPCR2界面稳定性差异较大,在单一的有机相如乙醇中很稳定,但在溶液-有机溶剂构成的双相体系中不稳定。宋婷等[12]也研究发现近平滑假丝酵母ATCC 7330羰基还原酶wtCpCR的界面稳定性和耐热性较差。因此为了提高该羰基还原酶在食品工业和生物化工应用价值,亟待改善其稳定性。
蛋白质工程及定点突变技术的快速发展[11,13-20],为提高酶的热稳定性、耐溶剂能力、耐酸能力等提供了高效的方法[17-25]。刘晓慧等[26]采用定点突变对氨基甲酸乙酯水解酶进行Q328C和Q328V分子改造后,将该酶40 ℃下的t1/2分别提高了7.46、1.99倍。郭超等[27]通过分子改造牛肠激酶得到R87P突变体酶的t1/2和T50较野生型分别提高了3.1 min和11.8 ℃。JAKOBLINNERT等[28]对羰基还原酶的A275和L276进行单突变和双突变,在环己烷-缓冲水溶液体系中酶活力提高1.5倍,热稳定性也提高2.7 ℃。沈瑞华等[29]构建的腈水合酶突变体M150C、T173Y和S189E在50 ℃下t1/2分别增加了32%、7%和107%,熔融温度(melting temperature,Tm)提高1~3 ℃。但利用定点突变技术对近平滑假丝酵母ATCC 7330羰基还原酶wtCpCR开展分子改造和稳定性研究还未见报道。
因此本文拟通过蛋白质理性设计和定点突变技术,筛选羰基还原wtCpCR与辅酶结合的柔性区域氨基酸残基突变位点,构建系列羰基还原酶突变体,研究其在界面稳定性、耐氧能力、耐剪切力和耐热等方面的特点,为拓展其在手性化合物和食品添加剂中的应用奠定科学基础。
1 材料与方法
1.1 材料与仪器
菌株CandidaparapsilosisATCC 7330、EscherichiacoilBL21(DE3),本实验室保存;T4连接酶、质粒抽提试剂盒、产物纯化试剂盒,Vazyme生物技术有限公司;DL 10 000 bp Marker、蛋白质电泳Marker、6×loading Buffer、5×蛋白上样缓冲液,TAKARA有限公司;质粒载体pACYCDuet-1,北纳创联生物科技有限公司;异丙基-β-D-硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG),纯度>99.9%,Calbiochem公司;PCR引物合成及测序,生工(上海)生物技术有限公司;Ni-Agarose His标签蛋白纯化试剂盒,北京康为世纪生物科技有限公司;其他试剂为国产或进口分析纯。
NanoDrop One超微量紫外可见分光光度计,Thermo Fisher Scientific;C1000 TouchPCR仪、Doc XR+Gel凝胶成像仪,伯乐生命医学产品有限公司(Bio-Rad);SX-700蒸汽灭菌器、MX-307落地高速冷冻离心机,Tomy Digital Biology;SW-CJ-2FD超净工作台,苏州净化设备有限公司;UV1800紫外可见分光光度计,岛津企业管理有限公司;Discovery Studio 2017版软件,北京创腾科技有限公司。
1.2 实验方法
1.2.1 羰基还原酶的突变点筛选
将近平滑假丝酵母ATCC 7330羰基还原酶蛋白(PDB数据库代号为4OAQ)分别与4-氯苯基甲酮和4-氯-3-酮基丁酸乙酯等不同底物采用Discovery studio 2017软件进行CDOCKER对接,通过模拟及文献[11]报道的羰基还原酶双相催化体系的钝化机理和稳定性推测,得到控制羰基还原酶wtCpCR耐溶剂、耐剪切、耐氧等稳定性的主要氨基酸有Ala98、Ser307、Gly262、Ser216和Ser258,除了Ser307外,其他均位于该酶的柔性区域。对这5个氨基酸采用饱和突变,计算突变能。得到5个突变体自由能,分别是ALA98Asn(-13.56 kJ/mol) 、Ser307Asn(-12.60 kJ/mol) 、Gly262Asn(-5.53 kJ/mol)、Ser216Asn(-5.15 kJ/mol)、Ser258Asn(-5.40 kJ/mol)。根据突变自由能比较[ΔΔGmut=ΔΔGfold(mutant)-ΔΔGfold(wild type)],这些突变体的突变能均为-4.186 kJ/mol以下,因此预测这些突变体酶的稳定性会有所提高。
1.2.2 定点突变引物设计、构建突变体文库、制备突变体酶
根据羰基还原酶wtCpCR的基因序列,利用SnapGene软件开展引物设计,如表1所示,用Mut Express Ⅱ Fast Mutagenesis Kit V2方法进行定点突变,得到突变质粒,转化到E.coliBL21(DE3)感受态细胞,构建突变文库,经测序验证后,再进行菌种培养、分离纯化得到相应突变体酶A98N、S307N、G262N、S216N、258N。

表1 定点突变引物设计表Table 1 Primer design table for site-directed mutagenesis
1.2.3 wtCpCR及其突变体酶的酶活力测定
突变体酶与wtCpCR的酶活力的测定参照文献[12],采用分光光度计法。酶活力测定的一般方法:总反应体积为1 mL,包含750 μL 100 mmol/L磷酸缓冲液(phosphate buffer,PB)(pH 7.5),100 μL 20~40 mmol/L带酮基或醛基底物,100 μL 2 mmol/L NADPH,30 ℃温育3 min,最后加入50 μL酶液,在340 nm条件下测定吸光度值的变化。本实验选用苯甲醛作为底物。
酶活力定义:在30 ℃、pH 7.5条件下,1 min催化氧化1 μmol NADPH所需要的酶量定义为1 U。酶活力计算如公式(1)所示:
(1)
式中:ΔA为初速度范围内每分钟吸光度值差值,min-1;V总为总反应体积,mL;n为酶液稀释倍数;6.22 为NADPH的消光系数,mmol/ (L·cm);d为比色皿直径,1 cm;V为酶液添加体积,mL。
1.2.4 突变体酶的稳定性研究
1.2.4.1 不同双相体系对羰基还原酶突变体的界面稳定性影响
建立PB-正己烷、PB-甲基叔丁基醚两种双相体系,检测wtCpCR及其突变酶在PB水相和双相体系条件下的酶活力变化,研究wtCpCR突变酶的界面稳定性变化规律。双相体系由1 mL的正己烷(或甲基叔丁基醚)和1 mL的酶溶液(0.1 mol/L PB,pH 7.5)组成。水相体系由1 mL PB和1 mL酶溶液组成。将单相或双相体系放入50 r/min、30 ℃的水浴锅中进行温育。定时取样,按照1.2.3酶活力测定方法测定剩余酶活力,确定各种酶在不同体系中的半衰期(t1/2)。所有实验重复3次,数据用Origin 8.0软件处理(下同)。
1.2.4.2 不同温度对羰基还原酶突变体的热稳定性影响
取适量酶液,置于4~50 ℃条件下保温2 h,移取部分酶液,按照1.2.3酶活力测定方法测定不同温度条件下剩余酶活力,计算该酶的T50值,考察该酶温度稳定性变化特点。T50的定义:酶活力降低至初始酶活力的50%时所对应的温度。
1.2.4.3 氧气对羰基还原酶突变体稳定性的影响
将经过无氧处理(在厌氧箱中进行氮气置换,以保证无氧条件)和未处理的酶溶液(0.1 mol/L PB,pH 7.5)放置在30 ℃条件下温育,每隔4 h取样 1次,按照1.2.3酶活力测定方法测定剩余酶活力,确定酶在无氧和有氧条件下的t1/2,研究酶在厌氧和有氧条件下的变化规律。
1.2.4.4 剪切力对羰基还原酶突变体稳定性的影响
在适当稀释的酶溶液(0.1 mol/L PB,pH 7.5)中加入5 mm聚四氟乙烯磁力搅拌子,并放置在30 ℃条件下温育,分别设置100、200、300 r/min 3种不同的转速条件。每隔2 h取样1次,按照1.2.3酶活力测定方法测定剩余酶活力,确定酶在不同剪切力强度下的t1/2,研究酶的耐剪切能力。
1.2.4.5 辅酶NADPH对羰基还原酶突变体的稳定性的影响
添加不同浓度的辅酶NADPH,通过测定酶活力的变化,研究辅酶对wtCpCR及其突变酶酶活力稳定性的影响。在酶溶液(0.1 mol/L PB,pH 7.5)中加入辅酶NADPH至终浓度分别为0.002、0.02、0.2、0.4 mmol/L,并放置在30 ℃条件下温育。每隔4 h取样,按照1.2.3酶活力测定方法测定剩余酶活力,确定酶在不同辅酶浓度条件下的t1/2。
2 结果与分析
2.1 突变体酶的比酶活变化
以wtCpCR为参照,不同突变体酶的相对比酶活力结果如图1所示。实验表明,A98N的比酶活力为14.52 U/mg,比野生酶提高了10%,说明第98位丙氨酸突变为天冬酰胺后得到的突变体酶可以增加其在PB中的催化能力。其余的突变体酶的比活力均有不同程度的减小。G262N、S258N的比酶活力下降为原始酶的66%和83%,S216N的比酶活力降低至原来的18%,而S307N未检测到酶活力,说明307位的丝氨酸是关键活性位点。因此选择G262N、S216N、S258N、A98N 4个突变体酶进行后续相关研究。
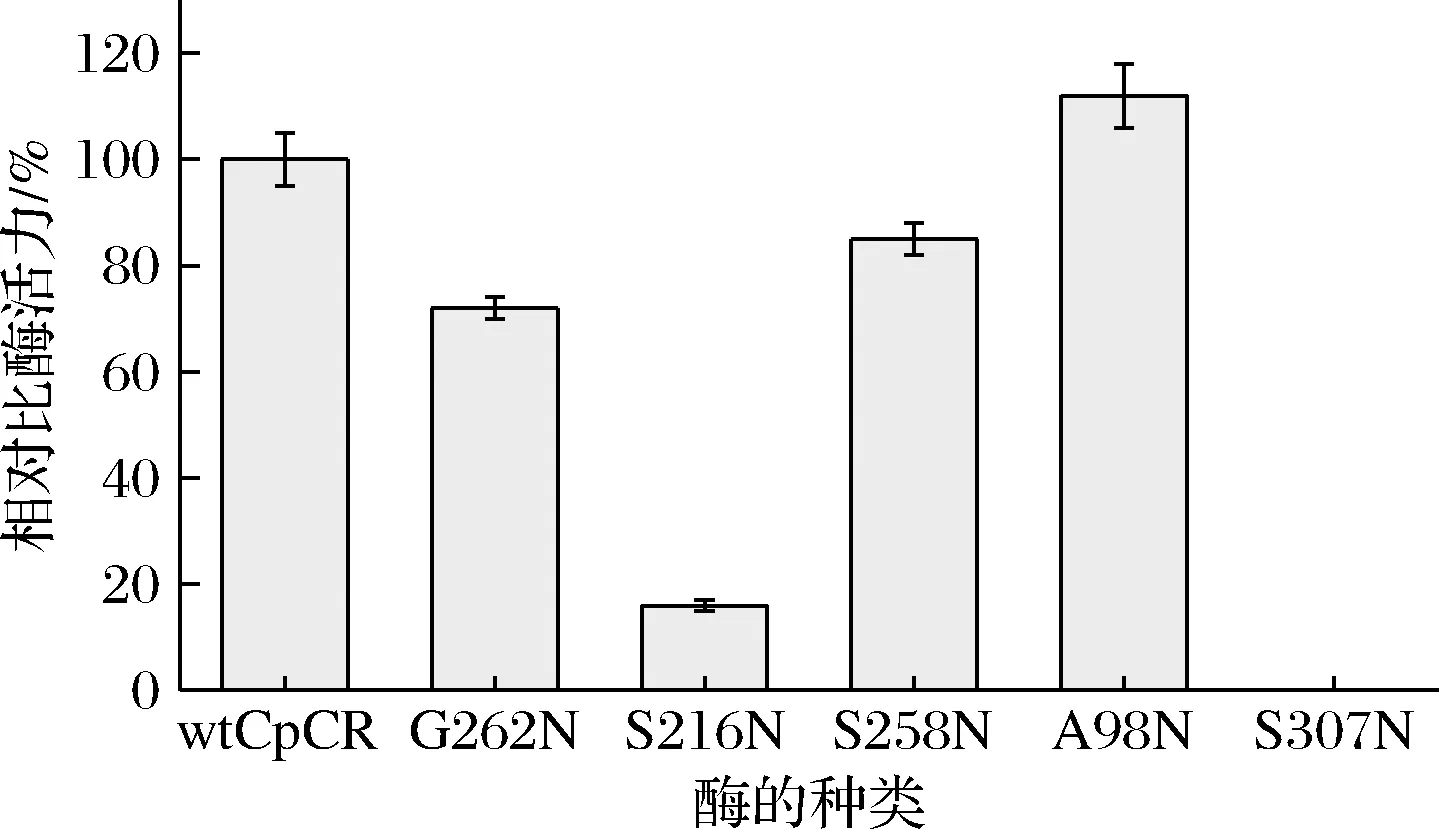
图1 wtCpCR与5个突变体酶的相对比酶活力Fig.1 Relative specific activity between wtCpCR and 5 mutants
2.2 wtCpCR及突变酶的稳定性研究
2.2.1 wtCpCR及突变酶的双相界面稳定性变化特点
研究发现,wtCpCR在PB、PB-正己烷、PB-甲基叔丁基醚3种溶剂体系的t1/2依次下降,特别是PB-甲基叔丁基醚的双相体系中,该酶在25.9 min已下降为初始酶活力的一半,说明甲基叔丁基醚溶剂对酶的三维空间折叠影响很大,对酶有较强的毒性,导致酶快速失活。从图2-a可以看出,所有的突变体酶在PB-正己烷体系中的t1/2变短。但在PB单相体系中,G262N、S258N、A98N的t1/2均有增长,稳定性均增加。而这4个突变体酶在PB-甲基叔丁基醚体系中的t1/2差异较大(图2-b),其中A98N和G262N的t1/2延长,t1/2值分别是wtCpCR的1.7和1.4倍。表明98和262位置上的氨基酸是提高该酶在PB-甲基叔丁基醚体系中的界面稳定性关键氨基酸,通过分子改造后可以增强CpCR酶耐醚类溶剂的能力,对拓展该酶的工业化应用具有重要价值。

a-PB、PB-正己烷;b-PB-甲基叔丁基醚图2 wtCpCR和4种突变酶在PB、PB-正己烷和PB-甲基叔丁基醚的半衰期变化Fig.2 The t1/2 of wtCpCR and 4 mutants in PB, PB-n-hexane and PB-methyl tert-butyl ether
2.2.2 wtCpCR及其突变酶的热稳定性特点
在4~50 ℃的温度下,研究了wtCpCR和突变体酶的热稳定性。从图3可以看出,4个位点的突变均对酶的热稳定性有一定的影响,T50值略有下降,其中S216N的T50值为31 ℃,下降较大,耐温性降低;而G262N的T50值与wtCpCR接近,为36 ℃,较wtCpCR下降1 ℃。

图3 wtCpCR和4种突变酶的T50变化Fig.3 Change of T50with wtCpCR and 4 mutants
2.2.3 剪切力对wtCpCR和突变体酶稳定性的影响
按照1.2.4.4方法研究100、200、300 r/min 3个不同剪切强度对wtCpCR及其突变酶的稳定性的影响,相对稳定性如图4所示。研究发现,随着剪切力的增加,wtCpCR和突变体酶的t1/2也下降。但在300 r/min的高剪切力下,G262 N和A98 N的稳定性比原始酶wtCpCR好,t1/2值是wtCpCR的1.3倍,G258 N突变体在高剪切力作用下酶的稳定性下降较多。说明对wtCpCR在262、98位开展定点突变,能提高酶的耐剪切能力。
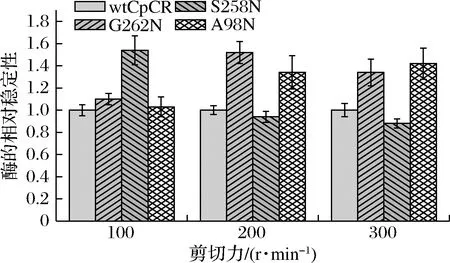
图4 wtCpCR和4种突变酶在不同剪切力强度下的相对稳定性Fig.4 The relative stability of wtCpCR and four mutant enzymes under different shear force stress
2.2.4 氧对wtCpCR和突变体酶稳定性的影响
氧对G262N和A98N两种突变体酶稳定性的影响结果如图5所示。wtCpCR在无氧条件下的稳定性比有氧条件要好;但经过定点突变得到的突变酶G262 N在有氧条件下的稳定性更好,其中t1/2值为11.87 h,耐氧能力比野生酶提高1.4倍;无氧条件下,两个突变体酶的稳定性均有不同程度下降。
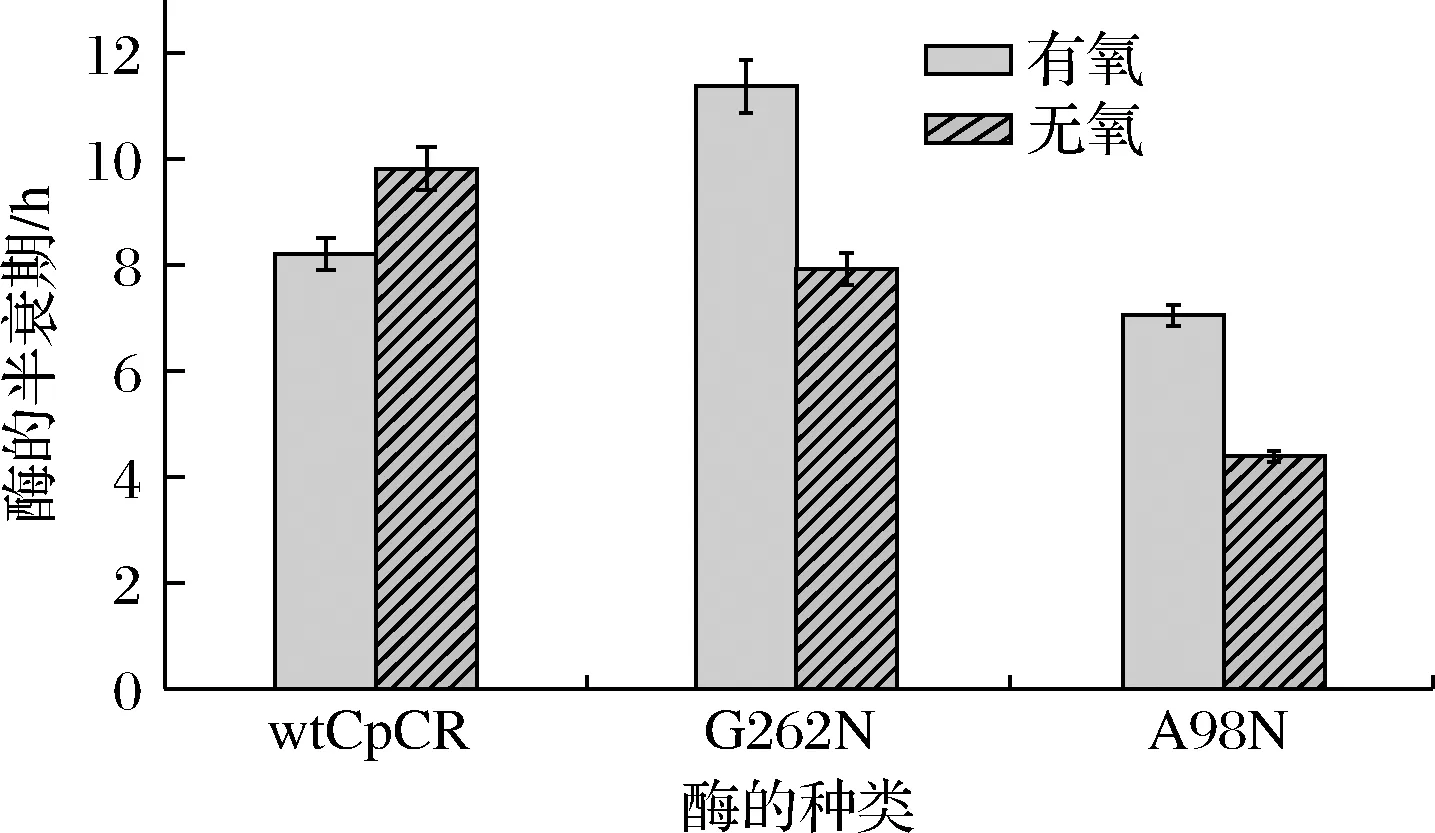
图5 有氧和无氧条件下wtCpCR和突变体酶的半衰期变化Fig.5 The t1/2 of wtCpCR and mutant enzymes under aerobic and anaerobic circumstances
2.1.5 辅酶NADPH浓度对wtCpCR和突变体酶的稳定性的影响
按照1.2.4.6的方法测定了0~0.4 mmol/L浓度的辅酶NADPH对酶的稳定性影响。如图6所示,wtCpCR和突变体酶G262N、A98N均随着辅酶NADPH浓度的升高,t1/2也延长,稳定性增强。在整个考察的辅酶浓度区间突变体G262N酶更加稳定,表明262位的甘氨酸是提高CpCR酶稳定性的关键氨基酸。

图6 不同辅酶NADPH浓度对突变体酶的稳定性影响Fig.6 The effect of different concentration about NADPH on the stability of mutants
3 结论
本实验通过蛋白质理性设计和定点突变技术成功得到5个突变体酶A98N、S307N、G262N、S216N和S258N。实验结果表明,以wtCpCR的比活力为参照,突变体酶A98N比活力提高了10%。在酶的稳定性实验结果表明,A98N和G262N在PB-甲基叔丁基醚的双相体系中酶的t1/2延长,耐溶剂稳定性比原始酶wtCpCR分别提高1.7、1.4倍;4个突变体酶的耐热特性均没有提高,T50值为31~36 ℃,T50值与wtCpCR最接近的是G262N;在300 r/min条件下,突变体酶G262N和A98N的稳定性比wtCpCR好,t1/2值是wtCpCR的1.3倍;突变酶G262N在有氧条件下的稳定性更好,其中t1/2值为11.87 h,耐氧能力比wtCpCR强1.38倍;辅酶浓度为0~0.4 mmol/L时,G262N酶更加稳定。综上分析,突变体A98N和G262N在耐醚类溶剂、耐剪切力具有提高,G262N突变体在有氧和辅酶浓度区域稳定性更好。本研究不仅为该酶的98位和262位的双点突变和酶稳定性进一步改造提供重要的科学依据,而且为提高该酶双相体系生物催化工艺经济性提供重要保障。

