基于适配体识别-杂交链式反应可视化检测金黄色葡萄球菌
卢春霞,王昌烜,黄巧,陈霞,李红敏,付家莉,张云红,王双慧
1(长江师范学院 现代农业与生物工程学院,重庆,408100)2(苏州赛飞福德检测科技有限公司,江苏 苏州,215100)3(新疆农垦科学院,分析测试中心,新疆 石河子,832000)
金黄色葡萄球菌(Staphylococcusaureus)简称金葡菌,属革兰氏阳性菌,广泛分布于自然界,是一种常见的食源性致病菌,常污染肉类、蛋类和乳类等食品,部分菌株产生的金黄色葡萄球菌肠毒素(staphylococcal enterotoxins,SEs)是引起食物中毒的主要致病因子[1],对公共健康和食品安全带来巨大威胁。有统计数据表明,2015年中国大陆由金葡菌引起的食源性疾病占12.6%,仅次于溶血性弧菌和沙门氏菌,是造成食源性疾病的第三大致病菌[2]。鉴于金葡菌的危害,我国食品安全国家标准[3]规定金葡菌的可接受水平和最高安全限量值分别为100、1 000 CFU/g(mL)。因此,如何快速灵敏地检出金葡菌是预防食源性疾病的关键技术和先决条件。
目前,传统的金葡菌的检测方法主要包括微生物培养法[3]、分子生物学检测方法[4]和免疫分析技术[5]。微生物培养法是金标方法,但该法操作步骤复杂,耗时较长(3~5 d),无法满足现场快速检测及批量样品初筛的需要。分子生物学检测技术灵敏度较高,但该法需要精密仪器和专业的技术人员。基于抗体技术的免疫学检测方法具有简便、快速等特点,是目前金葡菌常用的快速检测技术,市售商品以ELISA试剂盒和试纸条为主,但该类方法需要免疫动物,抗体制备成本较高。
近些年,核酸适配体(aptamer)以制备简单、生产成本低、应用范围广、易于修饰和标记等优点,作为一种新型识别分子广泛应用于食品安全[6]、环境分析[7]和临床诊断[8]等领域。在金葡菌检测方面,目前已筛选出多条识别金葡菌的核酸适配体[9-10]。随后人们利用这些适配体,结合纳米材料及化学发光等技术,建立了包括比色传感[11]、荧光传感[12]、拉曼生物传感[13]、电化学传感[14]等各种生物传感检测技术。本团队在基于适配体的食源性致病菌检测领域也做了较多研究[15-16]。
在众多快速检测方法中,可视化检测方法具有简单、便携、检测结果直观等优点而显示出独特的优势。但食品样品通常成分复杂、干扰大,基质效应可能影响检测灵敏度。为实现对靶标的高灵敏检测,可借助一些信号放大技术以提高检测灵敏度。其中,杂交链式反应(hybridization chain reaction,HCR)作为一种生物放大技术近年来引起了人们的广泛关注。HCR是一种自组装信号放大的技术,在常温下即可进行,不需要酶参与,同时,HCR对外部条件要求简单,不需要专业仪器,且输出信号多样化。因此,HCR作为一种简单、有效的新型信号放大策略在分析检测领域得到广泛应用[17]。但目前尚未见到基于适配体和HCR信号放大的金葡菌检测研究报道。
因此,本研究基于金葡菌现有检测技术的不足,以其适配体为识别分子,建立了一种简便灵敏的检测新方法。通过生物素-亲和素作用,将生物素-适配体1固定在酶标板表面,依次加入靶标和检测探针(含有引发链和适配体2),在酶标板表面形成适配体1/靶标/检测探针夹心复合物。然后加入生物素-发夹DNA,约定俗成引发HCR反应,使带有生物素的发夹DNA在酶标板表面“生长”形成dsDNA长链。然后将链霉亲和素-辣根过氧化物酶(streptavidin-horseradish peroxidase,SA-HRP)标记在dsDNA每个节点上,通过HRP催化3,3′,5,5′-四甲基联苯胺(tetramethylbenzidine,TMB)显色实现靶标的定性及定量检测。本方法结合了HCR和酶催化显色双重信号放大策略,更大限度地提高了检测灵敏度,为食品中金葡菌快速检测提供新的技术支撑。
1 材料与方法
1.1 实验材料
金黄色葡萄球菌(S.aureus)ATCC6538、金黄色葡萄球菌ATCC29213、大肠埃希氏菌(Escherichiacoli)O157:H7 ATCC25922、单核细胞增生李斯特菌(Listeriamonocytogenes)ATCC19155、鼠伤寒沙门氏菌(Salmonellatyphimurium)ATCC14028、阪崎肠杆菌(Bntorobatersakazakii)ATCC29544等菌株由新疆农垦科学院分析测试中心提供。
牛血清白蛋白 (bovine serum albumin, BSA)、吐温-20(Tween-20)、SA-HRP、三(羟甲基)氨基甲烷(Tris)、TMB显色试剂盒,生物工程(上海)股份有限公司;NaCl、KCl、Na2HPO4、KH2PO4、CaCl2、MgCl2·6H2O(分析纯),国药集团化学试剂有限公司;链霉亲和素包被的酶标板,苏州海狸生物医学工程有限公司;禽肉、乳制品,本地超市。
本研究中所用的核酸适配体、检测探针及发夹DNA由生物工程(上海)股份有限公司合成并纯化,其碱基序列详见表1。

表1 适配体及发夹DNA序列Table 1 Sequences of the aptamer and hairpin DNA
1.2 仪器与设备
Thermo ScientificTMVarioskan Flash全波长扫描式多功能读数仪,美国赛默飞公司;5MX 96孔板混匀仪,美国赛洛捷克公司;424R台式冷冻离心机,德国艾本德公司;BSD-100培养箱,上海博迅医疗生物仪器股份有限公司;UV-280紫外可见分光光度计,尤尼柯(上海)仪器有限公司;Milli-Q Reference超纯水系统,美国密理博公司。
1.3 实验方法
1.3.1 菌悬液的制备
将各种食源性致病菌分别接种到LB液体培养基中,37 ℃振荡培养过夜,使其菌悬液的光密度值达到1.0(OD600nm=0.1,菌落数约1.0×109CFU/mL),用生理盐水将其10倍系列稀释,然后通过平板计数法定量计算菌落数。菌悬液于4 ℃保存备用。
1.3.2 基于适配体-HCR检测金葡菌方法的建立
SA-酶标板使用之前用PBST(10 mmol/L PBS,0.05% Tween-20)洗涤。加入100 μL 生物素化适配体1(60 nmol/L),温育30 min,PBST洗涤。每孔加入200 μL的10 g/L BSA封闭液,室温封闭4 h,PBST洗涤。加入100 μL待测样品或一定浓度的金葡菌溶液,室温孵育30 min,PBST洗涤。加入100 μL检测探针(80 nmol/L),室温孵育30 min,PBST洗涤。bio-H1和bio-H2使用前95 ℃加热5 min,室温冷却,各取50 μL至反应孔中,室温杂交反应60 min,PBST洗涤。然后加入100 μL SA-HRP溶液(体积比1∶40 000),室温反应10 min,PBST洗涤后加入100 μL TMB显色液,避光显色5~7 min。加入100 μL 终止液终止反应,通过颜色变化定性检测金葡菌,并在450 nm处测其吸光度。每个实验重复3次。实验反应体系为适配体筛选缓冲液(20 mmol/L Tris、100 mmol/L NaCl、5 mmol/L KCl、1 mmol/L CaCl2、1 mmol/L MgCl2·6H2O,pH 7.4)[9]。
1.3.3 检测性能评价
1.3.3.1 线性范围、检测限
在优化条对下,用筛选缓冲溶液分别将金葡菌稀释成系列梯度浓度的工作液,采用建立的方法对其进行测定,以不同金葡菌浓度的对数值为横坐标,以各浓度对应的OD450nm值为纵坐标,绘制标准曲线,对其进行进行线性拟合,求得线性方程和相关系数。每个实验重复3次。
1.3.3.2 特异性分析
采用建立的方法分别检测相同浓度(1×104CFU/mL)的金葡菌、大肠杆菌、鼠伤寒沙门氏菌、单增李斯特菌、阪崎杆菌,同时设置空白对照,以分析方法的特异性。
1.3.3.3 方法的应用
采用对空白样品加标实验考察本方法的准确性。参照GB 4789.10—2016对样品进行前处理[18],称取25 g样品置于盛有225 mL生理盐水的无菌均质杯内,用拍击式均质器拍打1~2 min,用筛选缓冲液稀释成1∶10的样品匀液。取100 μL样品匀液,分别加入不同浓度的金葡菌,按照上述建立的检测方法进行检测,计算样品中金葡菌的含量、加标回收率,相对标准偏差(relative standard deviation, RSD)。同时采用国标法[18]进行检测,将检测结果对比分析,评价方法准确性。
1.4 数据处理
实验数据用平均值±标准偏差方式表示,采用单因素方差分析(One-Way ANOVA)方法分析实验数据,显著性水准为P=0.05[19],使用Origin 8.5 软件制图。
2 结果与分析
2.1 检测条件优化
2.1.1 适配体1及检测探针浓度
生物素化适配体1的包被浓度及检测探针浓度对检测灵敏度有较大影响。本实验使用过量的发夹DNA(100 nmol/L)和SA-HRP(稀释体积比1∶20 000),适配体与靶标反应时间40 min,HCR杂交时间2 h,金葡菌检测浓度为104CFU /mL,考察了不同适配体1包被浓度(10~200 nmol/L)和检测探针浓度(10~320 nmol/L)对检测灵敏度的影响。实验结果如图1所示,随着适配体1及检测探针浓度的增加,吸光值逐渐增加,意味着结合金葡菌的数量也逐渐增加,当两者浓度分别超过60、80 nmol/L后,吸光值变化趋于平缓(P>0.05)。因此,后续实验适配体1包被浓度和检测探针浓度分别选择60、80 nmol/L。

a-适配体;b-检测探针图1 适配体1和检测探针浓度对检测性能的影响Fig.1 Effect of concentration of aptamers 1 and detection probe on the detection performance注:不同字母表示差异显著(P<0.05)(下同)
2.1.2 封闭条件
在酶联适配体分析中,封闭酶标板上多余结合位点,降低SA-HRP非特异性吸附较为关键[20]。本实验固定在适配体1包被浓度60 nmol/L,采用BSA封闭后直接加入SA-HRP(体积比1∶20 000),观察BSA封闭浓度和封闭时间对SA-HRP非特异性吸附的影响。结果显示(图2),当BSA封闭质量浓度<5 g/L,吸光值较高,封闭不完全;随着BSA浓度的进一步增加,吸光值逐渐下降,说明SA-HRP非特异性吸附逐渐降低,当BSA质量浓度>10 g/L后,吸光值变化不显著(P>0.05)。另外,非特异性吸附随着封闭时间的延长而降低,当10 g/L BSA封闭时间超过4 h后,吸光值无明显变化(P>0.05)。综上分析,选择10 g/L BSA封闭4 h。

图2 不同封闭条件对SA-HRP非特异性吸附的影响Fig.2 The influence of different blocking conditions on non-specific adsorption of SA-HRP注:小写字母表示同一时间下不同BSA浓度组间显著性分析,大写字母表示同一BSA浓度下不同封闭时间组间显著性分析
2.1.3 适配体与靶标结合时间
为保证靶标与适配体充分结合,本实验固定以上优化条件,考察了适配体1及检测探针与靶标的结合时间对检测性能的影响。结果如图3所示,吸光值随着结合时间的增加而增大,当结合时间超过30 min后,反应基本达到饱和状态,吸光值无明显变化(P>0.05)。因此,后续实验选择结合时间为30 min。
2.1.4 发夹DNA(H1、H2)浓度及杂交时间
在HCR反应中,H1与H2通过互补错位杂交而参与反应,因此一般两者反应浓度比为1∶1。不同发夹DNA浓度对检测性能的影响如图4所示,吸光值随着发夹DNA浓度增加而增大。当H1和H2浓度均达到80 nmol/L后,吸光值变化不显著(P>0.05),可能是H1和H2浓度太大产生了空间位阻,导致杂交链的形成受到了影响。
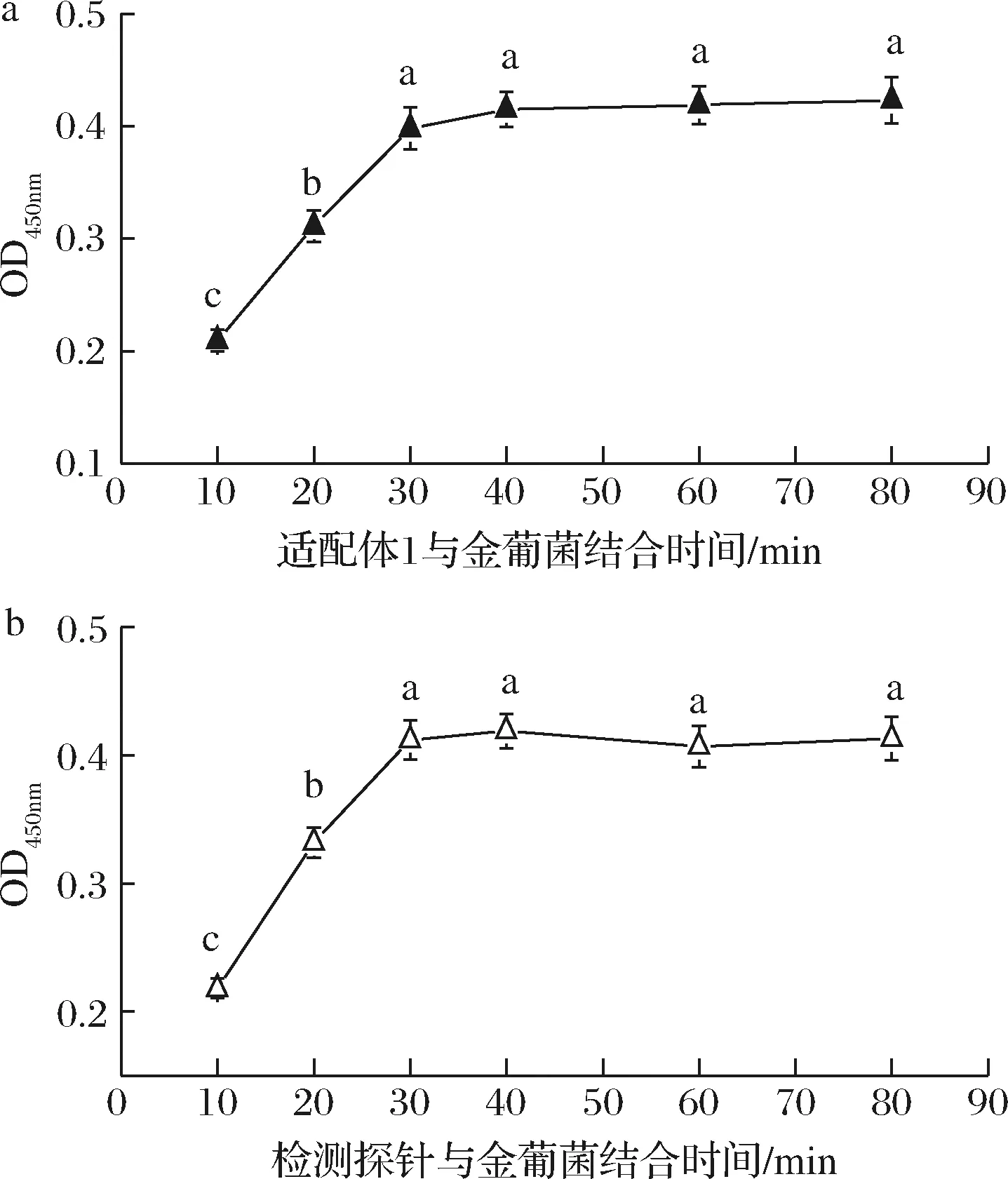
a-适配体1;b-检测探针图3 适配体与靶标结合时间对检测性能的影响Fig.3 The effect of incubation time between S.aureus aptameron the detection performance
固定以上实验条件,研究H1和H2杂交时间对检测性能的影响。结果如图4所示,随着杂交时间的延长,吸光值逐渐增加,当时间达到60 min后,吸光值没有显著变化(P>0.05),说明杂交反应60 min左右基本达到饱和状态。因此,H1和H2最佳反应浓度均为80 nmol/L,杂交时间选择60 min。

a-H1和H2浓度;b-HCR杂交时间图4 发夹探针(H1和H2)浓度及杂交时间对检测性能的影响Fig.4 Effect of concentration and hybridization time of hairpin probe (HP1, HP2)on detection performance
2.1.5 SA-HRP浓度
SA-HRP是显色反应的关键因素,SA-HRP 浓度过高易引起非特异性吸附,浓度过低则显色反应不充分。本研究固定以上实验条件,考察SA-HPR不同稀释体积比(1∶10 000~1∶100 000)对检测性能的影响。结果如图5所示,SA-HRP稀释比例在1∶10 000~1∶40 000时,吸光值变化不显著(P>0.05),随着稀释比例进一步增大,与实验组1∶10 000和1∶20 000相比,吸光值显著降低(P<0.05)。故选择SA-HRP稀释比例为1∶40 000。
2.2 检测性能评价
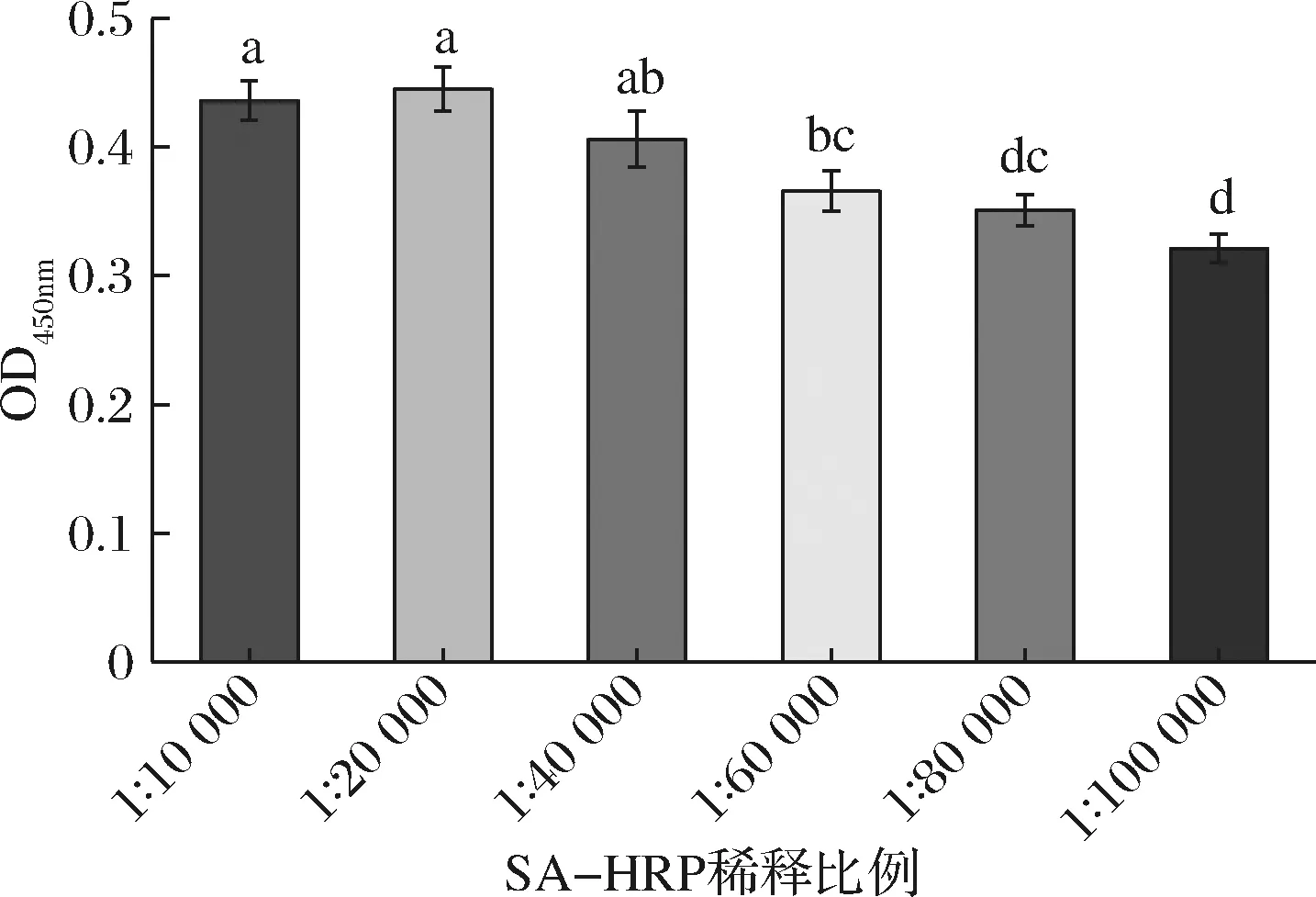
图5 SA-HRP浓度对检测性能的影响Fig.5 The effect of SA-HRP concentration on the detection performance
2.2.1 检测限、线性范围的确定
在优化条件下测定不同浓度的金葡菌(0、5、10、100、500、1 000、10 000、100 000 CFU/mL)。标准曲线如图6所示,反应溶液吸光值随着金葡菌浓度的增加而增大,吸光值强度在101~105CFU/mL呈良好线性关系,线性方程为y=0.140+0.497x,相关系数(R)为0.992。同时溶液颜色的变化与吸光值呈正相关,当金葡菌浓度为10 CFU/mL时,溶液显色较明显,故本方法可视化检测限为10 CFU/mL。结果表明本方法具有高的灵敏度,完全可满足食品中金葡菌限量值的检测要求。
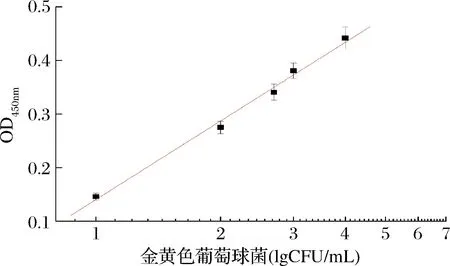
图6 金葡菌浓度与吸光值(450 nm)的线性关系Fig.6 The plots of the absorbance versus at 450 nm versus S.aureus concentration
2.2.2 特异性分析
采用本方法检测同等浓度的金葡菌、大肠杆菌、鼠伤寒沙门氏菌、单增李斯特菌等致病菌,同时设置空白对照,以评估本方法的特异性。结果如图7所示,其余几种致病菌引起的吸光值与空白对照组相近,说明适配体与其余致病菌无交叉反应,本方法具有高的特异性。
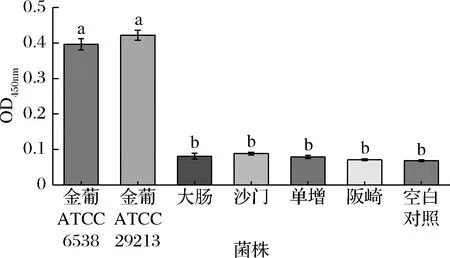
图7 特异性分析Fig.7 Specificity analysis
2.2.3 方法的应用
通过加标回收实验将本方法应用于实际样品检测,检测结果与国标法[18]对比验证。结果如表2所示,两种方法的检测结果没有明显差异(P>0.05),本方法加标回收率为91.8%~98.2%,相对标准偏差<6%,表明检测结果准确可靠实。
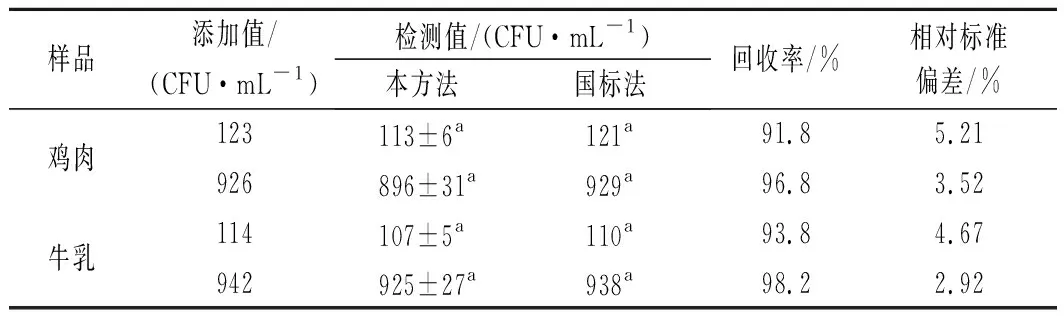
表2 加标回收率(n=3)Table 2 Recovery rates of S.aureus in spiked foods
2.2.4 方法的比较
与基于适配体的其他快速检测方法相比(表3),本方法具有高灵敏度、高准确性、操作简单、检测结果直观等优点。与电化学、拉曼生物传感及压电传感检测方法相比,本方法不需修饰电极,不需特殊专业设备。与基于纳米材料的比色法和荧光法比较,不需制备纳米材料和对适配体进行功能化修饰。与抗原-抗体识别原理的免疫分析技术相比,本方法具有识别分子易获得、成本低廉等优点,可极大降低检测成本。

表3 金黄色葡萄球菌检测方法比较Table 3 Comparison of analytical performance of the proposed methods for the detection of S.aureus
3 结论
本研究以金黄色葡萄球菌适配体为识别分子,结合HCR信号放大策略,建立了一种高灵敏、高通量的金黄色葡萄球菌快速检测新方法。在优化条件下,金黄色葡萄球菌的检测线性范围为101~105CFU/mL,可视化检测限为10 CFU/mL,在鸡肉和牛乳中加标回收率达到91.8%~98.2%,检测结果与国标方法无显著差异。本方法前处理简单,样品不需要增菌,检测灵敏度高,成本较低,更有利于现场检测,对于其他食源性致病及目标物的检测具有一定的借鉴和参考价值。

