冬小麦扩展蛋白TaEXPA8黑曲霉工程菌的构建及纤维素水解作用分析
王雪,冯旭,贺付蒙,徐永清,袁强,李丽,刘丹,孔德兴,李凤兰
(东北农业大学 生命科学学院,黑龙江 哈尔滨,150030)
秸秆是农业生产中的副产物,我国的秸秆总量巨大,但综合利用效率极低[1]。焚烧是处理秸秆的主要方式,但该方法不仅造成资源浪费,同时导致大气环境的严重污染[2-3]。秸秆中富含纤维素,通过降解纤维素使其转化为新型能源能够极大的缓解现阶段的能源短缺和环境污染问题,但降解效率过低仍是现阶段限制该项产业发展的瓶颈之一[4]。纤维素具有微纤维组成的复杂、多层结构,这种结构使纤维素具有较强的硬度且极难溶于水,纤维素酶也因不能进入微纤维中纤维链的深处从而导致酶解效率较低[5]。因此,探索高效、简便的纤维素降解方法具有重要的实际价值。
现阶段辅助纤维素降解的方式通常有物理法、化学法、物理化学法及生物法[6]。在以上几种方法中,前3种通常需要高温或高压,成本较高,而生物法通常在常温下即能完成,成本低且无污染[7]。纤维素的水解是一个复杂的过程,自然界中能够降解纤维素的生物通常具有包含纤维素酶在内的多酶体系,包括内切葡聚糖酶、纤维二糖酶、β-葡萄糖苷酶等,这些酶能够发挥协同作用,将纤维素降解为可溶性多糖[8]。然而,生物法降解纤维素所需的时间仍然较长,且效率不高。因此,迫切需要高效降解纤维素的微生物或者提高纤维素酶效率的添加剂[9]。
扩展蛋白以非酶活性的作用方式发挥功能,即在不改变细胞壁共价结构的条件下,只通过破坏基质多糖与纤维素微纤丝之间氢键的方式直接作用于细胞壁[10]。近些年的研究表明,扩展蛋白能够以协同蛋白的方式提高纤维素酶的水解效率,尤其是来自微生物中的扩展蛋白[11-12]。来源于B.subtlis的扩展蛋白BsEXLX1与纤维素酶混合协同作用于纤维素底物,其活力相比于单一纤维素酶提高了2~5.7倍[13]。来源于真菌A.fumigatus的扩展蛋白AfSwol与内切纤维素酶协同作用于底物羧甲基纤维素72 h后,水解活力提高了1.2倍[14]。因此,寻找高效、合适的扩展蛋白对于提高纤维素降解效率和降低生产成本是非常必需的。
扩展蛋白在天然生物体中的表达量较低,需要体外高效的表达系统以满足生产需求。大肠杆菌通常用于外源蛋白的表达,然而植物及真菌的扩展蛋白在大肠杆菌中表达时,重组蛋白会发生变性形成包涵体从而失活[15-16]。因此,本研究选择了黑曲霉(Aspergillusniger)表达系统以生产冬小麦(Triticumaestivum)扩展蛋白TaEXPA8,同时对该蛋白在纤维素水解中的作用进行了初步探索,为植物扩展蛋白在纤维素水解中的应用提供理论基础及新的方法和思路。
1 材料与方法
1.1 植物材料及菌株
冬小麦“东农冬麦1号”(Dongnongdongmai-1,DN-1)由东北农业大学植物资源与分子生物学实验室提供,大肠杆菌(Escherichiacoli)Trans-T1感受态、根癌农杆菌(Agrobacteriumtumefaciens)AGL1感受态购于北京全式金生物科技有限公司,黑曲霉CICC2462由东北农业大学遗传学实验室提供。
1.2 试剂盒、酶及表达载体
RNA、DNA提取试剂盒(Easy Pure®)、反转录试剂盒(Easy Script®)、高保真PCR酶(Trans Fast®)、pEASY-T3克隆载体,北京全式金生物科技有限公司;SDS-PAGE试剂盒,Thermo Fisher公司;限制性内切酶ApaΙ和Hind Ⅲ、T4-DNA连接酶,NEB公司;pSZHGS表达载体由东北农业大学遗传学实验室提供。
1.3 扩展蛋白TaEXPA8基因的克隆
采用试剂盒对东农冬麦1号叶片中的总RNA进行提取,1.2%(质量分数)琼脂糖凝胶电泳检测RNA质量并测定浓度,利用反转录试剂盒获得cDNA,方法详见说明书。通过PCR法获得TaEXPA8基因的全长,本试验所用引物如表1所示。PCR产物经纯化后连接T3克隆载体并转化至大肠杆菌中用于测序,同时对结果进行NCBI在线Blast分析。
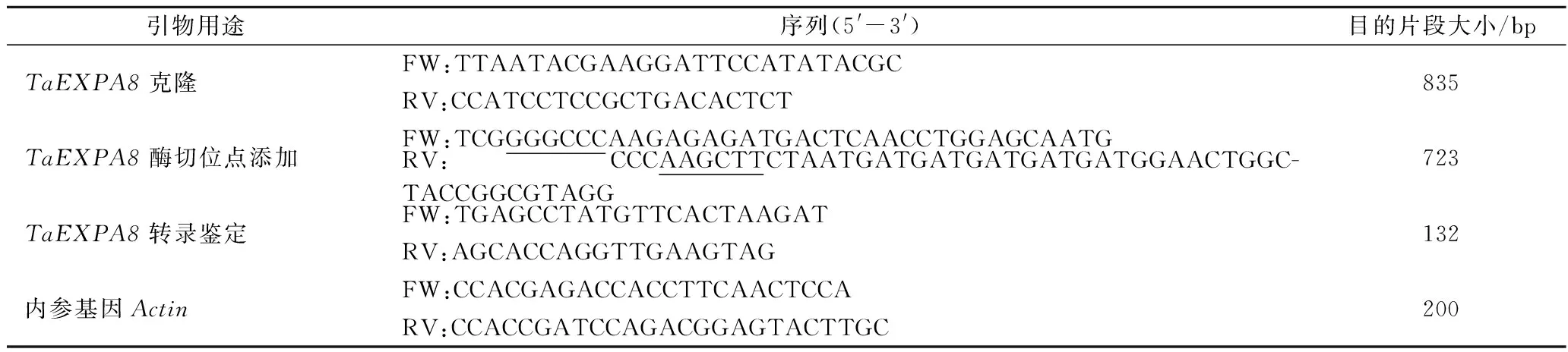
表1 试验所用引物列表Table 1 List of primers used in the experiment
1.4 pSZHGS-TaEXPA8表达载体的构建
通过PCR法在TaEXPA8基因的上下游分别添加ApaΙ和Hind Ⅲ酶切位点并切除信号肽,产物经纯化后备用。利用限制性内切酶ApaΙ和Hind Ⅲ分别对上述PCR产物和pSZHGS表达载体进行双酶切,酶切产物经纯化后通过T4-DNA连接酶进行连接,连接产物转化至大肠杆菌中用于测序。对测序正确的阳性菌株进行扩大培养,提取质粒进行双酶切鉴定。
1.5 表达载体转化黑曲霉
根癌农杆菌介导的黑曲霉遗传转化方法参照李杰等[17]进行,具体方法如下。将pSZHGS-TaEXPA8表达载体转化至根癌农杆菌AGL1中,方法详见说明书,阳性农杆菌经PCR鉴定后进行活化培养。分别取二次活化的农杆菌菌液1.5 mL和适量的黑曲霉菌丝置于无菌EP管中,混合后涂布于铺有玻璃纸的固体马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)(含200 μmol/L的乙酰丁香酮),28 ℃共培养2 d 后进行转膜培养,潮霉素及头孢噻肟钠为抗性筛选,提取阳性菌落的DNA并进行PCR鉴定。挑选鉴定结果正确的菌落于马铃薯葡萄糖水培养基中进行扩培,按照10%的接种量接种于发酵培养基,30 ℃,200 r/min培养6 d后取发酵液于50 mL离心管中,离心后取沉淀进行RT-PCR鉴定以检测TaEXPA8基因的转录水平。
1.6 TaEXPA8蛋白的SDS-PAGE检测
取少量TaEXPA8黑曲霉工程菌的发酵上清液进行SDS-PAGE试验以检测TaEXPA8蛋白的表达情况,操作方法详见试剂盒说明书。
1.7 TaEXPA8工程菌的纤维素水解作用分析
采用滤纸崩解试验检测TaEXPA8工程菌的纤维素水解作用,在纤维素酶液中分别添加等体积的TaEXPA8工程菌、野生型黑曲霉菌株的发酵上清液,以培养基为空白对照。取10 mL上述液体分别添加到铺有50 mg无淀粉滤纸的培养皿中,25 ℃,2 d后取出滤纸于显微镜下观察,同时采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定体系中的葡萄糖含量[18]。
1.8 数据处理
GraphPad Prism 5.0软件用于差异显著性分析及作图,所有数值均以平均值±标准差表示。
2 结果与分析
2.1 冬小麦总RNA的提取
东农冬麦1号植株叶片总RNA的电泳结果如图1所示,28S、18S和5S条带清晰,无降解现象,浓度的测定结果为(540±17)ng/μL,OD260/OD280为2.0±0.1。结果显示RNA的纯度较高,浓度适宜,可以用于下一步试验。

M-maker DL 2 000;1-RNA图1 东农冬麦1号叶片总RNA电泳结果Fig.1 Results of total RNA electrophoresis from DN-1 leaves
2.2 TaEXPA8基因的克隆
以RNA反转录的cDNA为模板对TaEXPA8基因进行克隆,电泳结果(图2)显示目的条带大小在750~1 000 bp,与引物设计时预期的条带大小一致,可以进行测序。将PCR产物纯化后连接至T3克隆载体并转化大肠杆菌进行测序。NCBI的在线Blast分析结果(图3)表明所获得PCR产物与TaEXPA8基因的序列吻合度为99%,即已经成功从东农冬麦1号中获得了TaEXPA8基因,可以进行下一步试验。

M-maker DL 2 000;1-TaEXPA8基因克隆结果图2 TaEXPA8基因的克隆结果Fig.2 Cloning results of TaEXPA8 gene

图3 TaEXPA8基因测序结果的NCBI在线Blast分析Fig.3 NCBI online blast analysis of TaEXPA8 gene sequencing results
2.3 pSZHGS-TaEXPA8表达载体的构建
通过PCR在TaEXPA8基因的上下游分别添加ApaΙ和Hind Ⅲ酶切位点并切除信号肽。分别对PCR产物和pSZHGS表达载体进行双酶切,酶切产物连接后转化至大肠杆菌。对构建好的pSZHGS-TaEXPA8表达载体进行双酶切鉴定,结果(图4)表明TaEXPA8基因已经成功插入pSZHGS表达载体的ApaΙ和Hind Ⅲ酶切位点之间。

M1-maker DL 2 000;1-pSZHGS-TaEXPA8表达载体的双酶切结果;M2-maker DL 15 000图4 pSZHGS-TaEXPA8表达载体的双酶切结果Fig.4 Results of double digestion of pSZHGS-TaEXPA8 expression vector
2.4 转化pSZHGS-TaEXPA8表达载体黑曲霉菌株的获得
将pSZHGS-TaEXPA8表达载体转化至根癌农杆菌AGL1中,活化后的农杆菌菌液与黑曲霉共培养(图5),并通过PCR分别在DNA和mRNA水平上对工程菌中的TaEXPA8基因进行检测,结果见图6。PCR的结果显示已经在黑曲霉工程菌的DNA中检测到TaEXPA8基因,RT-PCR的鉴定结果表明该扩展蛋白基因在工程菌中能够正常的进行转录。
图5 转化pSZHGS-TaEXPA8表达载体的农杆菌与黑曲霉共培养结果Fig.5 Co-culture of Agrobacterium transformed pSZHGS-TaEXPA8 expression vector with Aspergillus niger
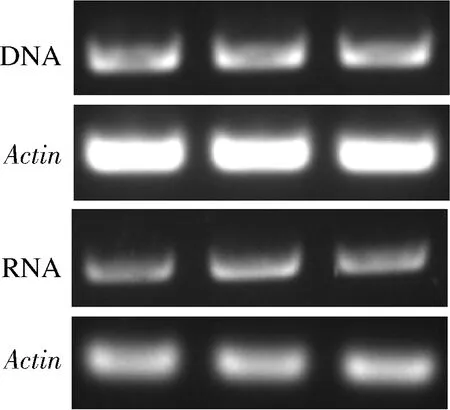
图6 TaEXPA8黑曲霉工程菌的鉴定结果Fig.6 Identification results of TaEXPA8 engineered Aspergillus niger
2.5 TaEXPA8蛋白的SDS-PAGE检测
通过SDS-PAGE检测黑曲霉工程菌发酵上清液中TaEXPA8蛋白的表达情况,结果如图7所示。TaEXPA8蛋白的分子质量约为25 kDa,相比于野生型菌株,工程菌在相应的位置处有条带出现,但不明显。由此可见TaEXPA8蛋白已经表达,但表达量较低。

M-蛋白质marker;1-培养基上清液;2-野生型菌株发酵上清液;3-TaEXPA8重组菌株发酵上清液图7 TaEXPA8蛋白的SDS-PAGE检测结果Fig.7 SDS-PAGE results of TaEXPA8 protein
2.6 TaEXPA8工程菌的纤维素水解作用分析
滤纸的崩解试验结果如图8-A所示,相比于空白对照和纤维素酶液的单独处理,TaEXPA8重组菌株的上清液能够显著促进纤维素酶发挥功能,滤纸的崩解程度较高。葡萄糖含量的测定结果也进一步支持这一观点。对照组中葡萄糖的含量为0.064 mg/mL,添加TaEXPA8工程菌上清液的处理组相比于对照增加了21.2%,差异显著(图8-B)。

A-TaEXPA8工程菌发酵上清液的滤纸崩解作用分析;B-滤纸崩解体系中葡萄糖的含量图8 TaEXPA8黑曲霉工程菌的纤维素水解作用分析结果Fig.8 Cellulose hydrolysis analysis results of TaEXPA8 engineered Aspergillus niger注:不同小写字母表示差异显著(P<0.05)
3 讨论
纤维素在自然界中的存量非常大,通过降解纤维素生产乙醇是现阶段可行的能源替代方案,但寻求高效的降解方法仍是目前亟待解决的关键难题。生物法降解纤维素相比于传统的方法具有很多优势,但仍需要高效的酶系统以提高降解效率。多项研究显示,扩展蛋白能够协同纤维素酶发挥功能并提高水解效率。原理为扩展蛋白在破坏纤维素微纤丝之间氢键的同时增强了纤维素基质的表面积,进而提高了纤维素酶的吸附能力,从而使水解效率上升。在纤维素酶解时添加少量的扩展蛋白可以显著提高纤维素酶的活性,从而减少所需的总酶负载[19]。在本研究中,TaEXPA8工程菌的上清液显著促进了纤维素酶处理下滤纸的崩解,葡萄糖的测定结果也显示水解效率显著增加。结果表明,除了微生物中的扩展蛋白外,来自于冬小麦的扩展蛋白TaEXPA8在纤维素降解过程中也具有相同的功能,这为寻找高效降解纤维素的扩展蛋白提供了新的思路。
植物扩展蛋白的异源表达是非常困难的,直到2014年才首次实现来自于番茄(Lycopersiconesculentum)的扩展蛋白LeEXP2在毕赤酵母(Pichiapastoris)中有活性的表达,但最大表达量仅为71 mg/L[20]。寻找合适的表达系统对于目标蛋白的产量和活性至关重要。在本研究中,RT-PCR的结果显示,TaEXPA8基因在工程菌中的转录水平较高,但SDS-PAGE的结果却显示蛋白的表达水平较低。在类似的研究中,目标基因多来自于微生物中,作为来自高等植物中的TaEXPA8可能与黑曲霉的表达系统不相适应,猜测这可能是蛋白表达水平较低的原因之一,更换表达载体或者对该基因进行密码子优化可能是有效的解决方案。TaEXPA8工程菌的上清液使纤维素酶的水解效率提高了21.2%,对于纯化的TaEXPA8蛋白,这一效率可能会更高,表明该蛋白具有潜在的应用前景。本研究对植物扩展蛋白在纤维素降解过程中的作用进行了新的尝试,虽然工程菌的产量较低,但对后续的相关研究也具有一定参考价值。
4 结论
本研究从冬小麦中克隆了扩展蛋白基因TaEXPA8,并构建了表达TaEXPA8蛋白的黑曲霉工程菌。工程菌的发酵液能够显著促进纤维素酶的水解效率,但TaEXPA8蛋白的产量较低。同微生物中扩展蛋白的功能相似,本研究揭示了来自于植物中的扩展蛋白在协同纤维素生物降解过程中也具有积极作用,但异源高效表达植物扩展蛋白的方法还需进一步的研究以获得,如何提高扩展蛋白的产量及纯度等工作仍是后续研究的重点。

