Caulobacter crescentus蔗糖水解酶突变体S271A的重组表达及其转化蔗糖制备松二糖的研究
邢晨晨,王蕾,郭志勇,张康,陶秀梅,吴敬*
1(江南大学,食品科学与技术国家重点实验室,江苏 无锡,214122)2(江南大学 生物工程学院,江苏 无锡,214122)
松二糖(turanose)分子式为C12H22O11,是一分子果糖和一分子葡萄糖以α-1,3糖苷键连接而成的还原性二糖,在自然界中基本以D-构型存在,是蔗糖的同分异构体[1]。松二糖存在于蜂蜜中,甜度是蔗糖的一半,其黏度、气味和甜味持久性都和蔗糖相似[2-3]。与蔗糖相比,松二糖不能被致龋微生物发酵,具有不致龋齿的优势;同时,松二糖具有低热量的特点,适合肥胖症、高血脂、高血压和糖尿病患者食用[4-5]。因此松二糖在食品工业中广泛应用于食品添加剂,并有可能取代蔗糖成为一种具有前景的新功能性甜味剂[6]。
用酶转化法制备松二糖转化率高,可控性强,并且反应条件较温和,因此有广阔的前景。文献报道制备松二糖的酶主要有2种:环糊精葡萄糖基转移酶和淀粉蔗糖酶[2, 7-8]。SHIBUYA等[2]将α-环糊精和果糖作为底物,使用嗜热脂肪芽孢杆菌来源的环糊精葡萄糖基转移酶制备松二糖的产率为45%。WANG等[8]以2.5 mol/L蔗糖为底物,添加400 U/L多糖奈瑟球菌来源的淀粉蔗糖酶制备松二糖,其产率可达56%。AGARWAL等[9]将淀粉蔗糖酶在大肠杆菌中进行重组表达,经酶转化后松二糖产率为47%。SU等[7]构建了多糖奈瑟球菌来源的淀粉蔗糖酶突变体(NpAS G396S),在食品级菌株枯草芽孢杆菌(Bacillussubtilis)中成功表达,经酶转化后松二糖产量为410 g/L,产率为60%,为单一底物制备松二糖的最高水平,但其产物中存在大量的副产物麦芽寡糖。此外,该酶的热稳定性较差,在30 ℃条件下半衰期仅为48 h,不利于大规模的工业化应用[10]。
实验室前期构建了Caulobactercrescentus来源蔗糖水解酶的突变体S271A (CcSH S271A),CcSH S271A是具有淀粉蔗糖酶特征的典型转苷酶,可利用蔗糖为底物进行分子内转苷(异构)反应制备松二糖。GUO等[11]研究表明CcSH S271A还具有麦芽寡糖副产物少的特点,可代替淀粉蔗糖酶制备松二糖。本研究将ccshS271A的基因在B.subtilis中成功表达,然后利用该重组酶进行松二糖的制备,并对该酶催化蔗糖制备松二糖的酶转化工艺进行研究。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
菌株B.subtilisWS11[12-13]、B.subtilisSCK6、含有ccsh和ccshS271A基因的重组质粒pET-24a(+)-ccsh和pET-24a(+)-ccshS271A以及质粒pUB110由本实验室保藏;重组质粒pUB110-ccshS271A和重组菌B.subtilisWS11/pUB110-ccshS271A由本研究构建。
1.1.2 培养基与试剂
LB液体培养基(g/L):酵母粉 5,蛋白胨 10,NaCl 10。
TB发酵培养基(g/L):酵母粉 24,蛋白胨 12,KH2PO42.31,K2HPO4·3H2O 16.43,甘油 5。
2×Phanta Max Master Mix,诺唯赞(南京)生物科技技术股份有限公司;聚丙烯酰胺凝胶电泳试剂盒,碧云天生物技术有限公司;质粒抽提试剂盒、琼脂糖凝胶DNA回收试剂盒,天根生化科技(北京)有限公司;其他试剂均为国产分析纯,国药集团。
1.2 实验方法
1.2.1 重组菌B.subtilis的构建
依据质粒pUB110和基因ccshS271A的核酸序列,设计以下引物(由5′→3′端,斜体代表同源臂序列)[14]。
P1:aaaaatcaaataaggagtgtcaagaatgattagtaccgcatcta-ttccgacc;
P2:agcttggaggtgtttttttattaccacgagcaactaaccaggtgatac;
P3:tggtatcacctggttagttgctcgtggtaataaaaaaacacctccaa-gctgagt;
P4:accgaagcagaaacagaacgccgccgatccaggagaacaaaa-acgattttttgag;
以质粒pET-24a(+)-ccshS271A为模板,引物P1和P2扩增得到大小为1 827 bp的ccshS271A基因;以质粒pUB110为模板,引物P3和P4扩增得到大小为7 276 bp的线性化质粒。使用POE-PCR的方法将ccshS271A的基因片段和pUB110线性化质粒进行连接[14]。将连接产物转化B.subtilisSCK6[15-16],获得含有ccshS271A基因序列的重组质粒pUB110-ccshS271A。重组质粒进一步转化B.subtilisWS11,对转化子提取质粒后由测序公司进行核酸序列检测,获得正确的重组质粒和重组菌,并保存甘油菌B.subtilisWS11/pUB110-ccshS271A。
1.2.2 重组菌的摇瓶发酵及重组酶的制备
按2‰的接种量,将保存在甘油管中的菌液接种到LB液体培养基中进行培养。而后将培养8~10 h的种子液按5%的接种量接种到TB发酵培养基中,在温度为33 ℃的恒温摇床里,持续发酵24 h。重组酶为胞内酶,收集发酵后的菌体,用50 mmol/L的pH 8.0的K2HPO4-KH2PO4缓冲液复溶后进行高压匀浆破壁。破壁液体离心后收集上清液,即为重组酶的粗酶液。
1.2.3 蔗糖水解酶活力测定
使用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法对CcSH和CcSH S271A进行酶活力测定[17]。
用50 mmol/L的pH 8.0的K2HPO4-KH2PO4缓冲液配制0.3 mol/L蔗糖溶液作为底物。在具塞试管中加入1.9 mL的底物溶液,放置在水浴锅中预热10 min。预热结束向具塞试管中加入0.1 mL适当稀释的胞内酶液后混匀,反应10 min后加入3 mL的DNS溶液。而后在100 ℃水中煮沸7 min,并迅速放入冰水中进行冷却。最后加入10 mL蒸馏水定容到15 mL,在OD540下测定吸光值。一个酶活力单位(U)为在上述条件下催化产生1 μmol/min还原糖当量所需的酶量[8]。
1.2.4 蛋白质的纯化方法
采用Ni-Sepharose-HP柱将带有His-Tag的重组酶粗酶液进行纯化。粗酶液上样结束后用A液进行冲洗,而后分别用体积分数为5%、10%和15% B液进行冲洗,最后用B液洗脱后收集所有的洗脱液,即为纯化的重组酶。
结合缓冲液(A液)成分(mmol/L):Tris-HCl 25,NaCl 500,调节pH至7.0。
洗脱缓冲液(B液)成分(mmol/L):咪唑 300,Tris-HCl 25, NaCl 500,调节pH至7.0。
1.2.5 酶学性质分析
温度对酶活力的影响:将酶在30、35、40、45、50、55 ℃条件下按照1.2.3所示方法进行酶活力测定。
温度稳定性的考察和半衰期的测定:将酶分别置于30、35、40、45 ℃的水浴锅中,30、35 ℃每隔24 h取样,40、45 ℃每隔8 h取样,测定样品的酶活力,考察酶的温度稳定性并测定半衰期。半衰期为酶活力下降为最初活力一半时所需的时间。
pH对酶活力的影响:用不同pH(5.0、6.0、6.5、7.0、7.5、8.0、8.5、9.0)的50 mmol/L K2HPO4-KH2PO4缓冲液和不同pH(9.0、10.0、11.0)的50 mmol/L Na2CO3-NaHCO3缓冲液配制底物,并用上述不同pH的缓冲液将酶液稀释至合适的倍数,在30 ℃的条件下测定酶活力。
pH稳定性的考察:将上述用不同pH缓冲液稀释的酶液在30 ℃水浴锅中放置48 h后测定酶活力。
相对酶活力:定义最高酶活力为100%,其他条件下测得的酶活力与最高酶活力的相对值即为相对酶活力。
1.2.6 松二糖的酶转化工艺优化
以不同浓度的蔗糖(1.0、1.5、2.0、2.5 mol/L)为底物,用不同pH (5.0、6.0、7.0、8.0、9.0、10.0)的缓冲液溶解底物,CcSH S271A分别以不同添加量(30、60、90、120、150 U/g蔗糖)添加至底物中,置于转速为150 r/min、不同温度(20、25、30、35、40、45、50 ℃)的水浴摇床中反应48 h。每次酶转化工艺控制单一变量,逐步优化。
1.2.7 HPLC检测产物
将酶转化反应产物离心取上清液,用水稀释至适当倍数后与乙腈等比例进行混合,并用0.22 μm的滤头进行过滤。使用Agilent 1200 HPLC色谱仪的示差折光检测器(refractive index detector,RID)进行检测,色谱柱为(4.6 mm×250 mm,5 μm) Syncronis Amino Column,柱温为35 ℃,流动相是体积分数为80%的乙腈和水的混合液,流速为0.8 mL/min,松二糖产率的计算如公式(1)所示:

(1)
2 结果与分析
2.1 蔗糖水解酶突变体在枯草芽孢杆菌中的构建与表达
将1.2.1所示方法构建成功的重组菌B.subtilisWS11/pUB110-ccshS271A按照1.2.2所示的方法获得重组酶CcSH S271A,并进行SDS-PAGE分析。如图1所示,泳道1在66.2 kDa附近有一条清晰的蛋白条带,与CcSH S271A理论相对分子质量(65.7 kDa)相符,且测得胞内上清液的酶活力为3.0 U/mL,说明CcSH S271A在B.subtilisWS11中表达成功。
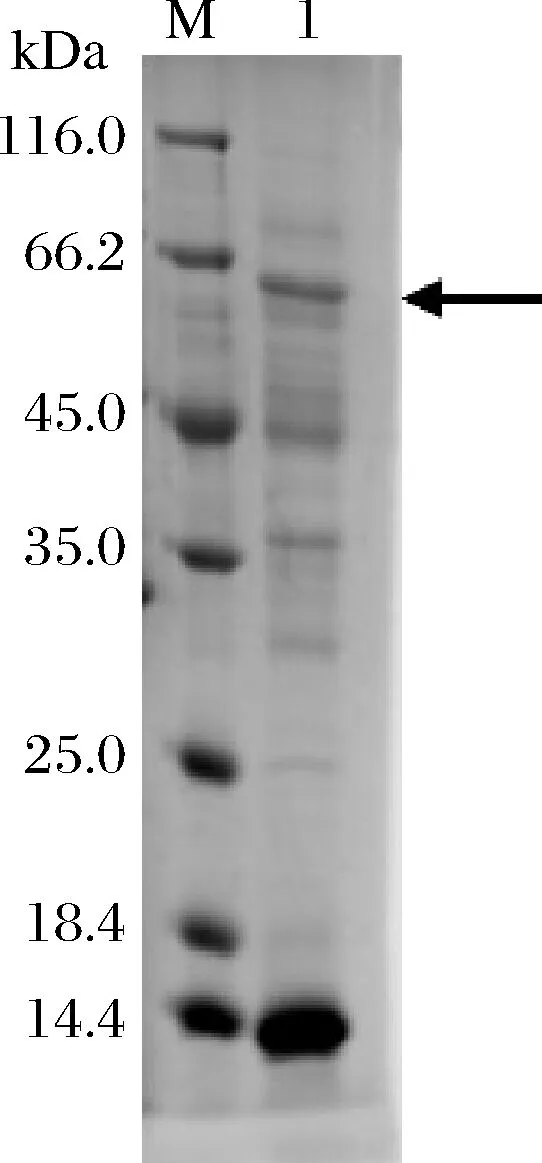
M-中分子质量蛋白marker;1-重组菌胞内上清液图1 重组蛋白CcSH S271A的SDS-PAGE分析Fig.1 SDS-PAGE analysis of recombinant protein CcSH S271A
2.2 C.crescentus蔗糖水解酶及突变体的纯化及酶学性质分析
2.2.1C.crescentus蔗糖水解酶及突变体的纯化
对蔗糖水解酶野生型CcSH和突变体CcSH S271A进行纯化,SDS-PAGE结果如图2所示,在泳道1和2的66.4 kDa附近有单一的蛋白条带,与CcSH和CcSH S271A理论相对分子质量相符,表明该酶达到电泳纯。使用DNS法分别测定纯化前后的野生型和突变体的酶活力,并用BRADFORD法[18]测定蛋白质浓度,计算得出CcSH和CcSH S271A纯化后的比活力分别为12.5、13.1 U/mg,说明单点突变S271A并未影响该酶的比活力。

M-低分子质量蛋白marker;1-纯化CcSH;2-纯化CcSH S271A图2 纯化CcSH和CcSH S271A的SDS-PAGE分析Fig.2 SDS-PAGE analysis of purified CcSH and CcSH S271A
2.2.2 温度对C.crescentus蔗糖水解酶及突变体的影响
酶的三维结构和分子热运动会受温度的影响,从而对酶结合和利用底物的能力产生影响,因此,酶促反应的催化速率会受到温度的影响[19-21]。如图3所示,野生型和突变体的酶活力随着温度升高呈现先升后降的趋势,最适温度均为45 ℃,当温度超过50 ℃时酶活力骤降,说明酶促反应时的温度不宜过高。

图3 温度对CcSH和CcSH S271A反应活性的影响Fig.3 Effect of temperature on the activity of CcSH and CcSH S271A
为了探究重组酶的热稳定性,分别测定该酶在30、35、40、45 ℃的半衰期。如图4所示,在30、35、40、45 ℃时,野生型CcSH和突变体CcSH S271A半衰期分别为312、120、48、40 h。结果说明,30 ℃时野生型和突变体热稳定性最好。

a-30 ℃温度稳定性;b-35 ℃温度稳定性;c-40 ℃温度稳定性;d-45 ℃温度稳定性图4 CcSH和CcSH S271A的温度稳定性Fig.4 Thermostability of CcSH and CcSH S271A
2.2.3 pH对C.crescentus蔗糖水解酶及突变体的影响
酶促反应的pH会影响酶的解离状态,影响酶促反应的催化速率[22]。如图5-a所示,CcSH和CcSH S271A的最适pH均为8.0,在偏酸和偏碱的条件下酶的催化活力均下降,pH在6.5~8.5时,相对酶活力均在85%以上,超过该pH范围时,酶活力骤降。
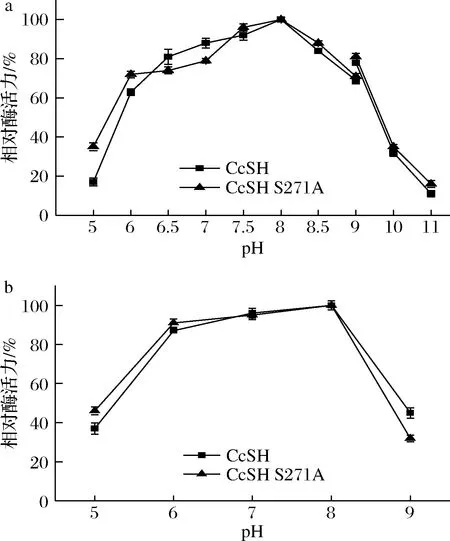
a-CcSH和CcSH S271A的反应活性;b-CcSH和CcSH S271A的稳定性图5 pH对CcSH和CcSH S271A反应活性和稳定性的影响Fig.5 Effect of pH on the activity and stability of CcSH and CcSH S271A
由图4可知,CcSH和CcSH S271A在30 ℃时热稳定性最好,因此将上述不同pH的酶液在30 ℃水浴锅中放置48 h后进行酶活力的测定,考察酶的pH稳定性。如图5-b所示,CcSH和CcSH S271A在偏碱或偏酸的条件下放置48 h后酶活力均下降明显,pH在6.0~8.0酶活力较稳定,相对酶活力均在80%以上,且在pH 8.0时该酶最稳定。
2.3 C.crescentus蔗糖水解酶突变体制备松二糖的工艺优化
以蔗糖为底物,突变体CcSH S271A合成的产物中松二糖占比最高,在初始酶转化工艺条件下产率可达56.3%,而野生型在同等条件下松二糖产率仅为22.8%。因此选择突变体CcSH S271A进行松二糖的制备,并从加酶量、初始pH、反应温度和蔗糖浓度4个方面对制备松二糖的工艺进行优化。
加酶量对合成松二糖的影响:结果如图6-a所示,松二糖的产量随着加酶量的增加呈现先升后降的趋势,当加酶量为60 U/g蔗糖时,达到松二糖最高产率58.2%。过量添加酶会对松二糖的生成有负面影响,造成该现象的原因可能是CcSH S271A存在副反应水解反应[11],在产物松二糖达到一定产量后,生成松二糖的转苷(异构)反应接近平衡状态,此时加酶量的增加不会进一步增加松二糖的产量。但是,副反应水解反应随加酶量的增加而增加,其水解底物蔗糖的能力加强,使得用于参与异构反应的底物量减少,导致松二糖的产量降低。
反应温度对合成松二糖的影响:在上述最优加酶量的基础上,对酶转化的温度进行优化。结果如图6-b 所示,在温度为30 ℃时,达到松二糖的最高产率58.4%,随着温度的升高,松二糖的产率降低。此时的酶转化最适温度与酶促反应的最适温度不一致,分析推测原因主要有3点:第一,制备松二糖时利用的是CcSH S271A酶的转苷活性,而利用DNS法检测的是转苷活性和水解活性的总活性,转苷活性的最适温度与该酶的转苷和水解总活性的最适温度不一致;第二,测定的酶活力考察的是短时间的酶催化性能,而酶转化制备松二糖考察的是一段较长的时间内酶的综合性能,这段时间内底物已经部分转化为产物,因此存在反应的平衡问题;第三,如图4所示,CcSH S271A在30 ℃时比在45 ℃时更稳定,低温下酶活力保持更久,使得松二糖产率较高。
初始pH对合成松二糖的影响:酶蛋白在一定的pH范围内酶活力相对稳定,而pH过酸或者过碱时会导致酶蛋白的催化中心相同电荷的基团互相排斥,从而解离,这会使得酶蛋白变性失活。在上述最适加酶量和最适温度的基础上,对初始pH进行优化。结果如图6-c所示,当pH为8.0时,达到松二糖的最高产率66.3%,随着pH的升高,松二糖的产率迅速降低。
蔗糖浓度对合成松二糖的影响:在上述酶转化工艺条件优化的基础上,对底物蔗糖浓度进行优化。结果如图6-d所示,当蔗糖浓度为2.0 mol/L时,松二糖的产量为453.5 g/L,产率可达66.3%,比SU等[7]报道的在相同的酶转化条件下的松二糖产量提高了43.5 g/L。
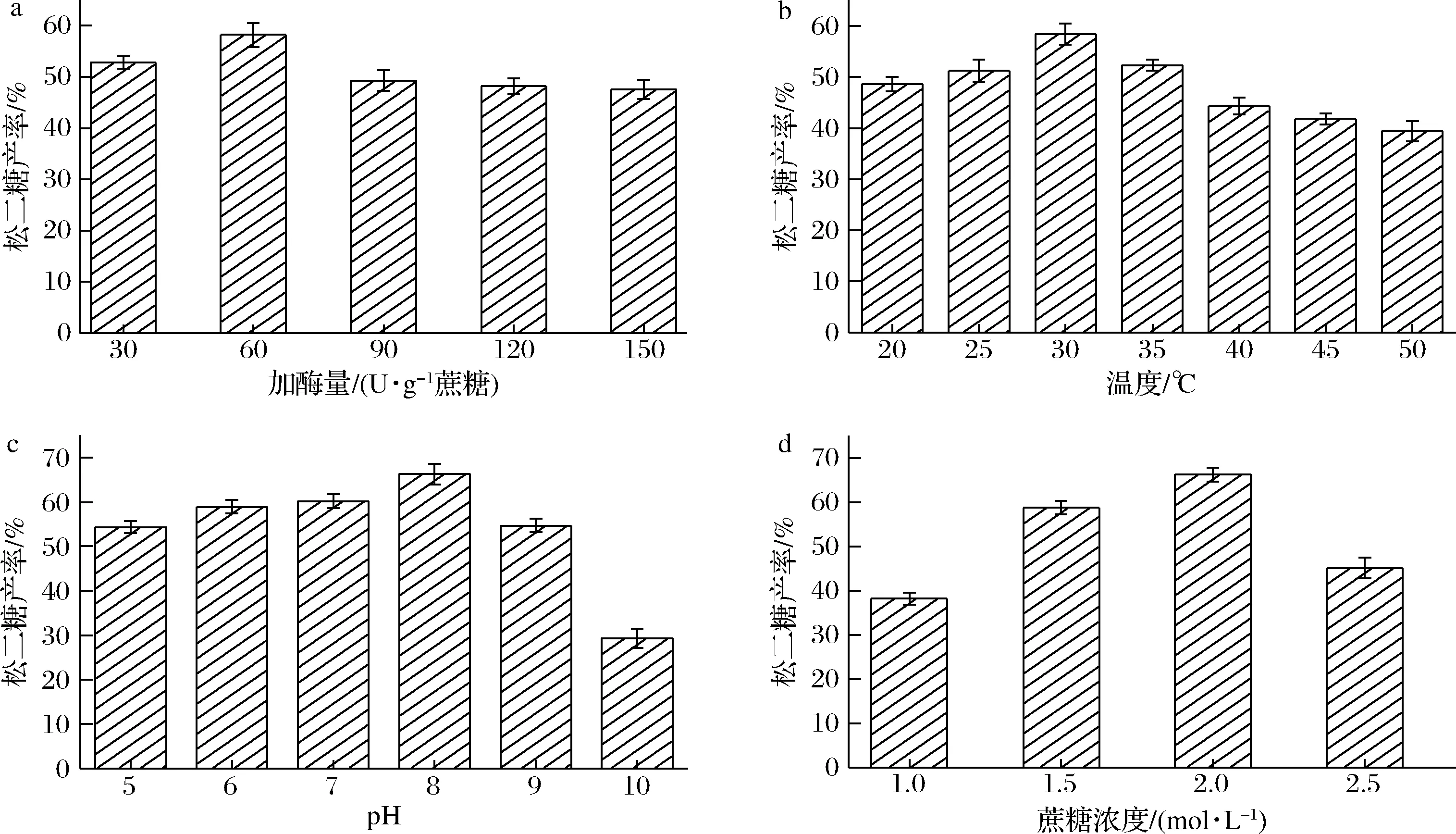
a-催化制备松二糖的CcSH S271A加酶量优化;b-催化制备松二糖的温度优化;c-催化制备松二糖的初始pH优化;d-催化制备松二糖的初始蔗糖浓度优化图6 C.crescentus蔗糖水解酶突变体制备松二糖的工艺优化Fig.6 Process optimization of the C.crescentus sucrose hydrolase mutant for the preparation of turanose
3 结论
本研究将C.crescentus来源蔗糖水解酶突变体ccshS271A的基因与表达载体pUB110连接转入食品安全级菌株B.subtilisWS11,获得重组菌B.subtilisWS11/pUB110-ccshS271A。对CcSH S271A的酶学性质进行研究,该酶在45 ℃、pH 8.0的条件下酶活力最高,且在30 ℃条件下热稳定性最好,半衰期为312 h,比常用作制备松二糖的淀粉蔗糖酶高264 h[10]。而后对CcSH S271A制备松二糖的酶转化工艺进行系统优化,最终获得最优反应体系,在pH 8.0,30 ℃的条件下,以2.0 mol/L蔗糖为底物,添加60 U/g蔗糖的CcSH S271A制备松二糖,产率为66.3%,为目前报道的最高松二糖产率[7],为工业上大体系进行酶转化制备松二糖提供了理论依据。

