不同温度对人体髂静脉保存效果的影响
任章勇,吕少诚,王芳菲,赵昕,郎韧,贺强
首都医科大学附属北京朝阳医院 肝胆外科,北京 100020
近年来随着血管外科技术及器官移植技术的发展,血管重建技术广泛应用于血管外科、肿瘤外科、移植外科等的手术中[1-4],临床上对血管移植物的需求越来越大。尽管各类生物工程类血管移植物陆续推出,同种异体血管依然是成本低廉、组织相容性好、近远期通畅率高的常用血管移植物。深低温冷冻保存(frozen storage,FS)是离体血管组织最常用的保存方式,据报道可保持细胞活性长达数年之久[5-6],但该保存方案需要昂贵的保存设备以及烦琐的降温和复温步骤,在临床中的应用遭到一定程度的限制。低温冷藏保存(cold storage,CS) 方案是目前临床医疗实践中离体血管组织常用的短期保存方式,但其安全使用时限及其对离体血管结构和功能的影响尚缺乏系统性的研究。本研究在血管结构、细胞活性、抗张力性能等方面评估不同保存温度对离体人髂静脉的影响。
材料与方法
1 实验材料 血管来源于12 例成年脑死亡器官捐献者的共24 条髂静脉。本研究已取得捐赠者家属的同意,并获得北京朝阳医院伦理委员会批准(伦理编号:2021-科-16)。本研究中所有程序均按照机构研究委员会的伦理标准和1964 年赫尔辛基宣言进行。
2 实验仪器 透射电子显微镜(日本,HITACHI),光学显微镜(日本,Olympus),-80℃冰箱(美国,ThermoFisher),立式冷藏柜(青岛海尔特种电冰柜有限公司),液氮存储罐(美国,ThermoFisher),HLD 手摇式螺旋机架(乐清市艾德堡仪器有限公司);HP-50N 高精度数显拉力计(乐清市艾德堡仪器有限公司);多功能酶标仪(美国,ThermoFisher)。
3 实验试剂 UW液[University of Wisconsin solution,百时美施贵宝(中国) 投资有限公司];199 培养基(美国,Sigma);青霉素-链霉素双抗液(美国,ThermoFisher)。
4 血管获取、分组及保存液配制 血管来源于成年脑死亡器官捐献者,选取双侧髂静脉,用0.9%氯化钠注射液冲去血渍,去除血管周围脂肪等组织,修剪为长1.2~ 1.5 cm 的血管段并通过简单随机法随机分为冷藏(CS)组、冷冻(FS)组和新鲜对照(fresh control,FC)组;分别设置保存1 d、3 d、5 d、1 周、2 周、4 周共6 个检测时间点;每组于每个检测时间点均设置10 个样本。FC 组只参与第1 次检测,不参与保存过程。
CS 组的保存液组成(1 L)为青霉素&链霉素双抗液1 000 U、无菌0.9% 氯化钠注射液500 mL、Medium199 培养液500 mL。取40 mL 上述保存液于50 mL 无菌离心管中,每个冻存管保存5 段血管,封口膜封口后置于4℃冰箱中保存。保存时间大于1 周的标本每隔1 周更换1 次保存液。
FS 组的保存液组成(1 L)为青霉素&链霉素双抗液1 000 U、无菌0.9% 氯化钠注射液450 mL、Medium199 培养液450 mL、DMSO 100 mL(保存方式及保存液组成参照欧洲同种异体移植物保存库的建议[5])。取4 mL 上述保存液于5 mL 无菌冻存管中,每个冻存管保存1 段血管,封口膜封口后置于-80℃冰箱中的程序性降温盒中进行梯度降温,降温速率为1℃/min,2 h 后取出迅速转移至-186℃的液氮储存罐中保存。待检测时将冻存管取出,置于37℃水浴中复温15 min,然后用37℃0.9%氯化钠注射液冲洗3遍,去除血管组织中的DMSO 后送检。
5 血管细胞活性检测 取一段新鲜血管,失活处理作为空白对照。将各组血管段剪碎为1~ 2 mm的组织碎片,加入12 孔细胞培养板中,再向培养孔加入2 mL 新鲜配置的MTT 液(1 mg/mL),于37℃的温箱中孵育1 h,弃去培养孔中的MTT液,加入1 mL DMSO,室温下震荡15 min,洗脱细胞内的蓝紫色结晶,多功能酶标仪于570 nm 下读取各组血管洗脱液的吸光值(Di)和空白对照组吸光值(D0);称取各组血管段的重量(mi);结果以单位重量的吸光值表示:MTT(OD/m)=(Dx-D0)/mi。
6 血管极限应力测试 用4-0 Prolene 线于血管段两端“8”字缝合牵引线,将两端的牵引丝线分别系在拉力测试台的两个夹具上,缓慢摇动手柄增加张力,直至丝线从血管上拉下,记录此时的最大拉力Fmax。
7 血管组织病理检测 各组标本取出后,经10%中性甲醛固定、脱水、包埋和切片后,分别行HE 染色、Masson 染色及EVG 染色,于光学显微镜下观察血管段内膜、胶原纤维和弹性纤维的变性情况。
8 血管TUNEL 荧光检测 各组标本取出后,经10% 中性甲醛固定、脱水、包埋和切片后行TUNEL 荧光染色检查,每张切片随机选取5 个高倍视野(200×),使用Image J 软件统计每个视野中阳性细胞数占总细胞数的比例,作为凋亡指数,评估血管细胞的凋亡情况。
9 统计学方法 使用EXCEL2016 进行数据汇总,使用SPSS25.0 进行研究资料分析。研究资料中的计量数据,均通过正态性检验,以表示,两组间的比较为成组t检验或校正t'检验(统计量为t),组内前后比较为配对t检验(统计量为t)。考虑到本研究资料为同样本来源,有较强的配对样本属性,故多时点观测资料按重复观测资料行重复测量方差分析(统计量为F)+两两组间比较LSD-t检验(统计量为LSD-t)+两两时间比较差值t检验(统计量为t)。统计检验水准α=0.05,均为双侧检验。重复测量分析及分割检验的多次比较按Bonferroni 校正法进行检验水准调整,α'=0.05/n,n 为多次比较的次数。
结果
1 不同血管保存组之间一般资料的比较 新鲜血管长度为(1.44 ± 0.05) cm,周长为(4.24 ± 0.06) cm,重量为(0.33 ± 0.01) g。经1 d~ 4 周的保存后,冷藏组与冷冻组的血管长度、宽度和重量,组间及组内差异均无统计学意义(两因素重复测量方差分析,组间、组内,交互等3 个维度P均>0.05)。见表1。
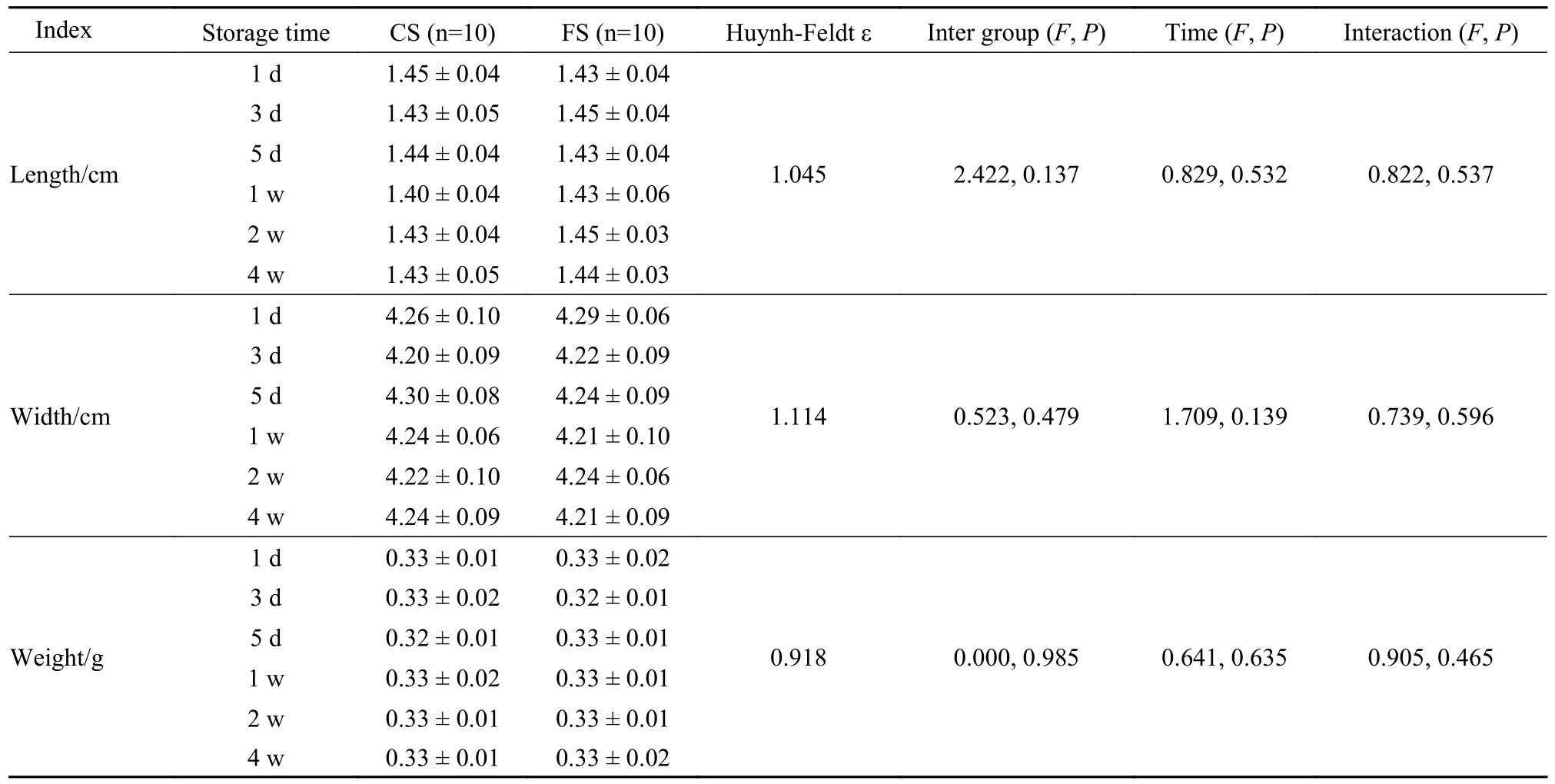
表1 各组血管长度、宽度及重量的比较Tab.1 Comparison of the length,width and weight of blood vessels in different preservation groups
2 血管细胞活性检测结果 新鲜组血管细胞活性结果为(2.76 ± 0.56) OD/m。经1 d~ 4 周的保存后,各个保存组血管在各个时间点细胞活性均低于新鲜组,差异有统计学意义(P<0.05);在保存1 d 和3 d 时冷藏组细胞活性高于冷冻组,3 d~2 周时两组细胞活性相当,2 周及4 周后冷藏组细胞活性低于冷冻组。部分差异有统计学意义(P<0.05)。见表2。
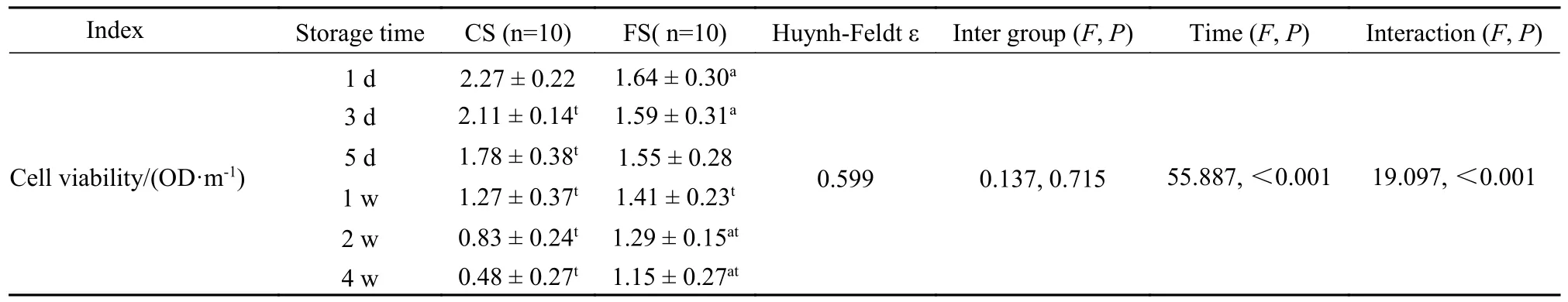
表2 各组血管在不同时间点细胞活性结果Tab.2 Results of cell activity of blood vessels in each preservation group at different time points
3 极限应力测试结果 新鲜组血管极限应力Fmax为(12.11 ± 0.55) N。冷藏组极限拉力值Fmax随着保存时间的延长逐渐减小,但5 d 内其与新鲜组比较差异无统计学意义,但优于冷冻组,差异有统计学意义(P<0.05)。1~ 2 周两组抗张力效果相当,4 周后冷藏组的抗张力性能弱于冷冻组(P<0.05)。见表3。

表3 各组血管极限拉力值结果Tab.3 Results of ultimate tension value of blood vessels in different preservation groups
4 TUNEL 荧光结果 如图1 所示:新鲜血管血管壁中平滑肌及内皮细胞的细胞核被DAPI 染成蓝色,外膜层可见个别绿色荧光的凋亡细胞。随着保存时间的延长,两个保存组血管内凋亡细胞均逐渐增多,保存1 周后,冷藏组管壁内膜层和外膜层可见绿色荧光的凋亡细胞,冷冻组管壁亦可见散在凋亡细胞,平均凋亡指数分别为6.09% ±0.90%和3.96% ± 0.69%(P=0.001);保存2 周后,冷藏组管壁全程可见凋亡细胞,内膜层及外膜层更明显,冷冻组管壁凋亡细胞较前增多,平均凋亡指数分别为34.58% ± 3.40%和17.45% ± 1.74%(P<0.001);保存4 周后,两保存组血管壁凋亡细胞均进一步增多,平均凋亡指数分别为74.90% ±5.68%和31.23% ± 1.52%(P<0.001)。
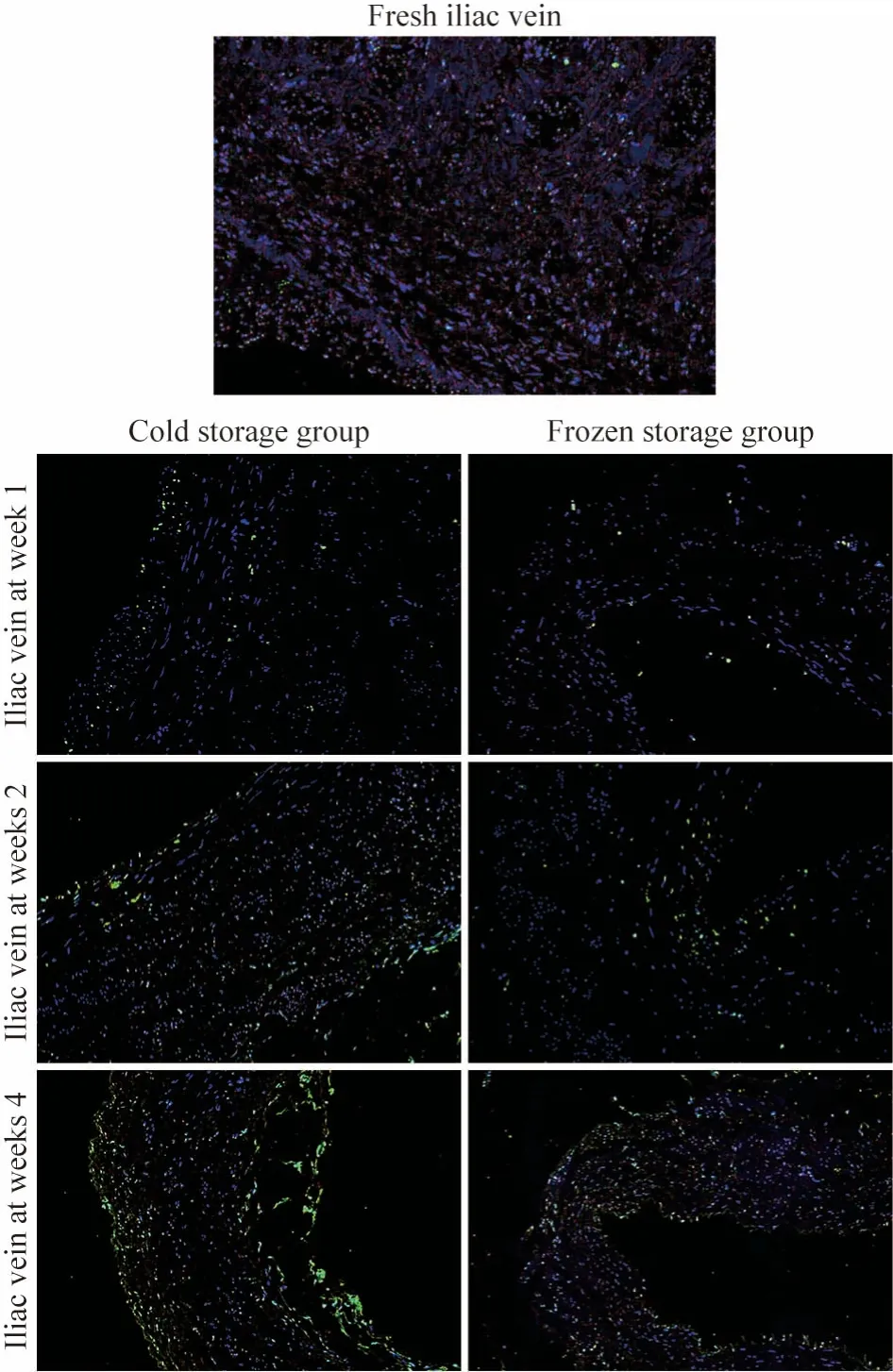
图1 各保存组血管在不同时间点TUNEL 荧光染色(100×)Fig.1 TUNEL fluorescence staining of blood vessels in each preservation group at different time points (100×)
5 组织病理学结果 如图2 所示:新鲜血管HE染色可见血管管壁各层结构清晰,内膜由单层内皮细胞附着于内弹性膜构成,肌层由内环、外纵两层构成,由结缔组织构成血管外膜层;Masson染色可见胶原纤维染为蓝色,连续性良好;EVG染色可见内弹性膜及弹力纤维染为紫黑色,连续性良好。保存1 周后,冷藏组和冷冻组血管管壁各层结构与新鲜血管对比均无明显改变,内皮细胞、肌纤维、胶原纤维及弹力纤维均保存良好。保存2 周后,冷藏组内皮细胞可见脱落破坏,但管壁其余各层均无明显改变;冷冻组内皮细胞肿胀变圆,但连续性良好,其余管壁各层结构仍保存良好。保存4 周后,冷藏组血管着色变浅,细胞核较前明显减少,肌纤维可见水肿样变化,内皮细胞几乎全部破坏脱落,但胶原纤维及弹力纤维仍保存良好;冷冻组内皮细胞出现破坏,其余管壁各层仍保存良好。
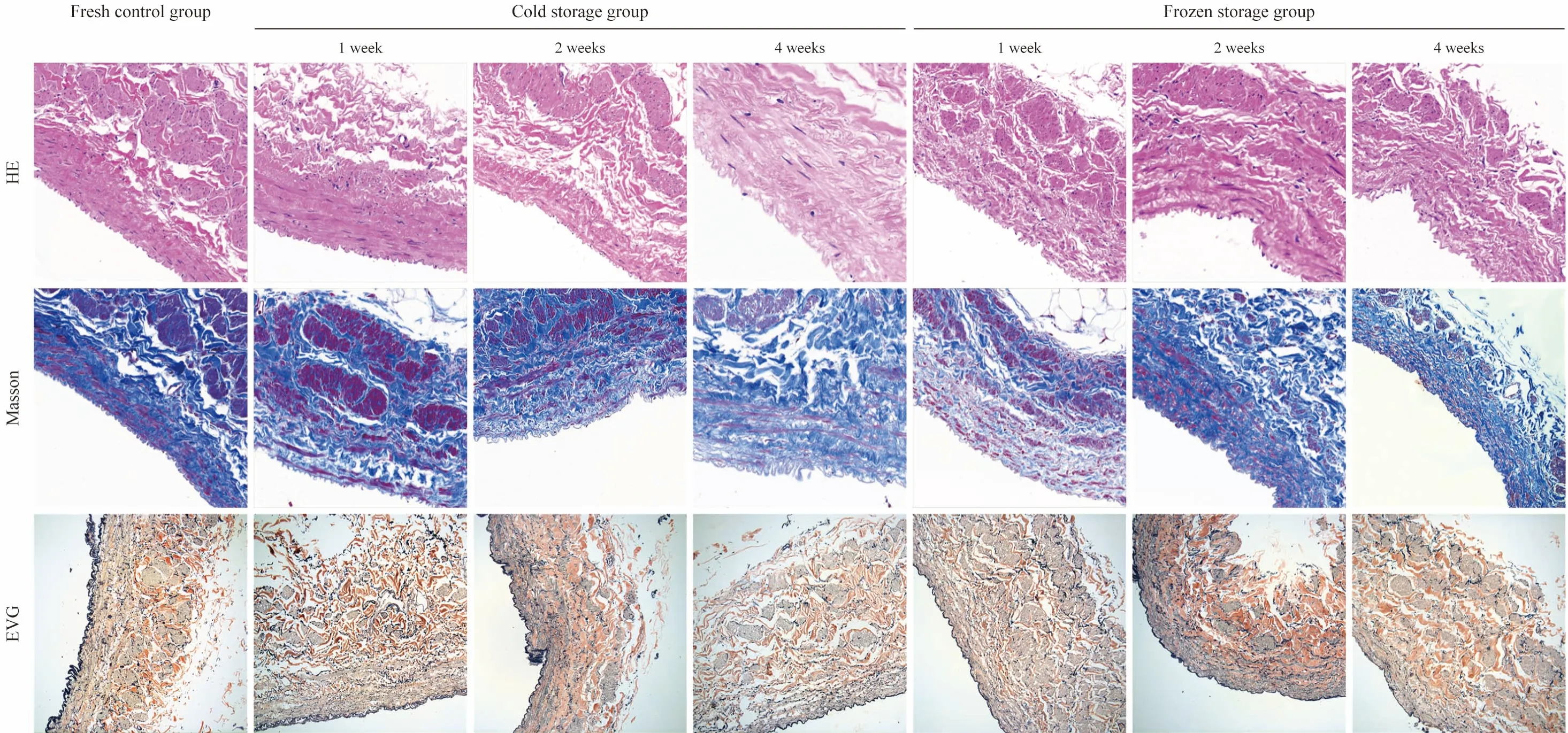
图2 各保存组血管在不同保存时间后的HE、Masson 和EVG 染色(200×)Fig.2 HE,Masson and EVG staining of vessels in each preservation group at different preservation time points (200×)
讨论
目前血管重建中应用的血管移植物有自体血管、人工血管及同种异体血管。迄今为止,自体动脉和静脉仍然是替换病变血管的“金标准”[7]。但自体血管获取会增加患者的手术创伤,并且可获取的自体血管资源有限,已不能满足当前日益增长的临床需求。人工血管在过去的几十年中得到了广泛的应用和研究,尽管经过不同方式进行改良及术后抗血栓治疗,术后6 个月的血管总体通畅率也只有35%~ 77%[8-9]。同种异体血管取自于供体器官获取时的尸体血管,因其来源丰富、管径易匹配、组织相容性好、近远期通畅率高等优点,在临床中具有广阔的应用前景[10]。
深低温冷冻保存方法首先由O'Brien等[11]于1975 年引入到离体主动脉瓣的保存,其原理是通过降低组织细胞的温度而降低细胞代谢速度。Brockbank等[12]通过氚化甘氨酸渗入实验证明液氮冷冻保存两年后的心脏瓣膜组织中成纤维细胞蛋白质合成功能仍保留。Mirabet等[13]亦通过外植体培养和组织学研究证明同种异体移植物的细胞活性能在液氮保存达13 年之久。在随后的几十年里,深低温冷冻保存技术不断得到改进,保存效果得到进一步的提高,该方案被广泛用于组织细胞的长期保存[14-15]。但深低温冷冻并非是同种异体移植物最完美的保存方案,其降温及复温程序均会导致大量细胞损伤甚至死亡[16-17]。与深低温冷冻保存不同,低温冷藏保存并不强调将细胞代谢降为零,而是将细胞代谢抑制到一个较低水平,从而在一定时间范围内保存细胞组织的活性。由于操作方便,不需要烦琐的降温和复温程序以及昂贵的设备,低温冷藏保存技术是现代医疗实践中常见的离体器官保存方式[18-19]。
随着时间的延长,两组血管细胞活性均逐渐降低,但保存3 d 内冷藏组细胞活性高于冷冻组,保存3 d~ 1 周内两种保存方案效果相当,保存2 周后冷藏组血管细胞活性低于冷冻组。TUNEL荧光显示两组血管随着保存时间的延长,凋亡细胞均逐渐增多,冷藏组的变化趋势更为显著。作为血管移植物,抗张力性能的保存尤为重要,其直接影响着血管缝合的成败,但这在以往关于血管保存的研究中极少被研究者关注。我们的研究发现,两组血管的胶原纤维及弹性纤维在组织病理中均未观察到明显的破坏改变,保存1 周内冷冻组血管的抗张力性能较冷藏组和新鲜组低。随着保存时间的延长,冷藏组血管的抗张力性能逐渐下降,而冷冻组血管无明显改变,在4 周时冷藏组抗张力性能低于冷冻组。由此可认为冷藏组血管抗张力性能的下降是由保存时间延长所致,而冷冻组则是在降温和复温过程中导致血管的脆性增加所致。
对于离体静脉的保存,血管结构的完整保留至关重要。静脉管壁主要由内皮细胞和内弹性膜构成的内膜、内环外纵两层平滑肌构成的中膜及结缔组织构成的外膜层组成。我们通过组织病理结果可看出,保存4 周内,低温冷藏和深低温冷冻均能良好地保存血管的中膜和外膜结构,胶原纤维和弹性纤维亦保存良好。但冷藏组在保存2 周后内皮细胞可见脱落破坏,保存4 周后内皮细胞几乎全部破坏脱落,尽管内皮层的完整可减少血栓形成[20],但亦有研究认为血管内皮细胞表达有包括ABO 抗原和HLA 抗原在内的多种自身抗原,其脱落破坏可能会导致宿主特异性抗原的减少从而减少术后排斥反应[21]。内皮细胞在保存过程中的破坏对移植术后的影响尚需进一步的研究评估。
综上所述,2 周内,低温冷藏方案的保存效果与深低温冷冻方案相当,可作为离体静脉安全可靠的保存方案;4 周后,深低温冷冻方案的保存效果优于低温冷藏。但遗憾的是,本研究是植入前的体外观察,其综合保存效果仍需进一步在体实验研究进行评估。

