·基础免疫学·LncRNA CASC7/miR-98-5p/SIRT3轴调控慢性阻塞性肺疾病大鼠气道炎症反应和平滑肌细胞变化①
梁海梅 欧宗兴 王蕾 陈忠仁
(中南大学湘雅医学院附属海口医院呼吸与危重症医学科,海口 570208)
慢性阻塞性肺疾病(chronic obstructive pulmo‑nary disease,COPD)是一种气流受限的阻塞性肺部疾病,病死率逐年增高[1]。目前对COPD的治疗方案多采取药物+戒烟+心理治疗,严重时需要吸氧并使用激素治疗,影响患者的生活质量[2-4]。
长 链 非 编 码RNA(long non-coding RNAs,LncRNAs)的异常表达被证实在包括COPD在内的多种疾病的发生发展中扮演重要角色[5]。随着分子生物学的发展,发现了很多在COPD中起作用的LncRNAs,如LncRNA MCM3AP-AS1在COPD中 表达下调,过表达MCM3AP-AS1能够抑制支气管平滑肌细胞(bronchial smooth muscle cells,BSMCs)增殖[6];敲除LncRNA TUG1可减轻COPD的肺部炎症损伤[7]。但仍然有很多LncRNAs在COPD中的作用不明确,LncRNA CASC7位于NC_000008.11染色体8,曾被证实可抑制非小细胞肺癌的生长和侵袭,同时也可增强重症哮喘患者对激素治疗的敏感性[8-9]。miRNA也属于非编码RNA的一个亚类,目前对于miRNA的研究热点在于被上游LncRNAs海绵化吸附,导致生物学功能被抑制。本研发现了CASC7与miR-98-5p碱基互补配对序列,而miR-98已经被MUSRI等[10]证实在COPD患者中过表达。本研究还发现了miR-98-5p的下游靶基因沉默信息调节因子3(Sirtuin3,SIRT3),既往研究报道SIRT3在COPD中可改善氧化应激导致的细胞损伤[11]。
本研究旨在对CASC3在COPD中的作用进行探讨,并希望明确其具体调控机制,为COPD的诊断和治疗提供新的作用靶点。
1 资料与方法
1.1 资料
1.1.1 临床样本资料40例因肺癌切除术(不伴有COPD)切除的癌旁正常肺组织(距离原发灶边缘至少2~5 cm,且肉眼可见无肺癌浸润),患者无吸烟史。其中男27例,女13例,年龄28~66岁。40例吸烟的非COPD健康志愿者,其中男30例,女10例,年龄31~72岁,烟龄7.3~18.1年,肺功能正常。2017年6月至2019年10月于中南大学湘雅医学院附属海口医院就诊的60例患有COPD的吸烟患者,其中男45例,女15例,年龄35~68岁,烟龄7.6~17.9年。COPD患者均是首次诊断为COPD,同时不伴有其他严重性或慢性临床疾病。每组志愿者均取肺组织和痰液标本,在样本收集之前所有志愿者均签署书面知情同意书,本研究经中南大学湘雅医院附属海口医院伦理委员会批准。
1.1.2 实验动物12只C57BL/6J雄性大鼠购自南京大学南京生物医学研究所,7周龄,体质量(216±20)g。于20℃~25℃、湿度50%~65%下饲养。
1.1.3 实验试剂与仪器脂多糖(LPS)由北京索莱宝科技有限公司提供;TRIzol试剂、胎牛血清、Lipofectamine3000试剂盒、miR-98-5p模拟物与抑制剂、酶标仪、BCA蛋白定量试剂盒、PVDF膜、化学发光剂均由美国赛默飞世尔科技有限公司提供;沉默SIRT3的siRNA质粒由圣克鲁斯生物技术有限公司提供;过表达CASC7的pcDNA3.1质粒由湖南优宝生物科技有限公司提供;逆转录试剂盒、qRT-PCR SuperMix试剂盒由北京全式金生物技术有限公司提供;CFX96Touch系统由美国伯乐公司提供;FISH试剂盒由广州伯信生物科技有限公司提供;平滑肌细胞培养基由宁波明舟生物科技有限公司提供;pGL3载体由淼灵质粒平台提供;人IL-6、IL-8、TNF-α ELISA检测试剂盒由上海将来实业股份有限公司提供;PI3K、p-PI3K、GAPDH一抗、HRP标记的IgG二抗均由英国Abcam提供;CCK-8试剂盒由上海汉恒生物科技有限公司提供;使用的红玫瑰牌香烟由广东卷烟厂提供,每支含焦油13 mg,尼古丁1.3 mg。Annexin V-FITC/PI细胞凋亡检测试剂盒由上海前尘生物科技有限公司提供;流式细胞仪由贝克曼库尔特提供。
1.2 方法
1.2.1 动物模型的建立与体内转染取12只C57BL/6J大鼠,随机分为对照组和COPD模型建立组。对照组置于无菌无烟环境下饲养。COPD组使用LPS灌胃,随后在香烟烟雾(cigarette smoke,CS)室中暴露2个月(5 d/周,4次/d,2 h/次,8支/h)。每隔2周向大鼠鼻腔内注射过表达质粒pcDNA3.1-CASC7及阴性对照、miR-98-5p模拟物和miR-98-5p抑制剂以及相应阴性对照;沉默质粒si-SIRT3与阴性对照物。最后1次暴露结束24 h后,以100 mg/kg剂量给予戊巴比妥钠麻醉处死大鼠,取出肺组织。本研究所有程序均按照相关指导原则和规定进行。
1.2.2 HE染色使用多聚甲醛固定左侧肺叶组织,依次二甲苯脱水、梯度乙醇透明、浸蜡、包埋、切片,行HE染色,封片,显微镜下观察。
1.2.3 大鼠BSMCs的分离与转染急性酶分离法分离BSMCs,首先将生理缓冲液预冷,取出大鼠肺脏后置于其中,通入混合气体(O2∶CO2=19∶1),将支气管主干分离,在解剖显微镜下再将肺动、静脉、间质组织、结缔组织及神经纤维等剥离,最后去除上皮组织。将处理好的气管平滑肌置于生理缓冲液并剪碎(1 mm×1 mm),加入胶原酶、木瓜蛋白酶、牛血清白蛋白、NaCl、KCl、MgCl2、葡萄糖配制成的消化液中,1 h后终止消化得到BSMCs,并重悬,接种于6孔板中,置于培养箱中培养。6 h左右细胞融合度变为70%~90%,进行细胞转染。转染步骤按照Lipofectamine3000试剂盒说明书进行。
1.2.4 qRT-PCR TRIzol试剂用于提取组织和血浆样本中的总RNA,使用逆转录试剂盒将RNA合成第一链cDNA,最后再使用qRT-PCR SuperMix试剂盒在CFX96 C1000系统上完成定量逆转录酶聚合酶链反应,使用2-ΔΔCt方法计算相对表达量,使用U6和GAPDH将数据规范化。本实验使用的引物由北京博尔迈生物技术有限公司提供,序列见表1。

表1 qRT-PCR引物序列Tab.1 qRT-PCR primer sequences
1.2.5 亚细胞定位加入4%多聚甲醛将细胞固定于6孔板,使用1 ml DEPC水洗涤2次,5 min/次;向孔板中加入1 ml/孔的通透液,10 min后弃掉通透液并使用PBS洗涤3次,5 min/次;加入蛋白酶K工作液,使其与细胞均匀接触,孵育10 min,PBS洗涤2次,5 min/次,经多聚甲醛再固定与梯度乙醇脱水,干燥后进行下一步实验。在处理好的样本上滴加20 µl的预杂交液,37℃下封闭孵育30 min,在冰上将探针与杂交液(1∶40)混合成杂交反应液,滴加30µl杂交反应液于样本,73℃下反应5 min,最后在37℃过夜孵育。经2×SSC洗涤后加入DAPI进行染核,封片后使用共聚焦显微镜拍照观察。
1.2.6 双荧光素酶报告实验在基础报告载体pGL3上插入CASC7野生型、突变型序列(CASC7-WT、CASC7-MUT)和SIRT3野生型、突变型(SIRT3-WT、SIRT3-MUT)序列的3'UTR端,将293T细胞植入孔板,再使用Lipofectamine3000试剂将克隆好的报告载体与miR-98-5p NC、miR-98-5p mimic共转染至细胞,静置48 h后,应用双荧光素酶基因报告系统评价各组细胞的萤火虫荧光素酶活性,以海肾荧光素酶活性作为标准化参考。
1.2.7 ELISA应用ELISA试剂盒检测BSMCs上清液和大鼠血清中的IL-6、IL-8和TNF-α分泌水平,简单步骤如下:孔板设置空白孔、标准孔、样本孔,标准孔中加入50µl标准品,样本孔中加入50µl样本,再向标准孔和样本孔中同时加入100µl HRP标记的待测抗体,封闭孔板,37℃下孵育60 min。洗涤干燥后向孔中加入底物,37℃暗室中孵育15 min,加入终止液,酶标仪检测波长为450 nm处的OD值。
1.2.8 Western blot细胞经过RIPA裂解液完全裂解后,得到的产物为总蛋白样本,蛋白经BCA试剂盒定量后,加热变性,SDS-PAGE分离蛋白,再将其转移至PVDF膜,并使用5%脱脂牛奶对其封闭1 h,加入PI3K(1∶1 000)、p-PI3K(1∶500)、GAPDH(1∶1 000)一抗,膜上孵育,4℃过夜。TBST洗涤3次,膜上加入HRP标记的IgG(1∶5 000)二抗孵育,2 h后加入化学发光剂(ECL)将蛋白条带信号放大,并分析条带灰度值,以GAPDH进行标准归一化。
1.2.9 CCK-8将待测细胞重悬,密度调整为2×104个/ml,植入96孔板,2×103个/孔,放入培养箱中,每隔24 h使用CCK-8溶液检测1次细胞存活状态,直至培养到96 h进行最后1次检测。测量450 nm处吸光度值,绘制成曲线。
1.2.10 流式细胞术细胞凋亡程度使用Annexin VFITC/PI双染色法检测,孔板中以每孔2×106个细胞进行接种,加入培养基培养24 h。PBS洗涤细胞,细胞在缓冲液中重悬,加入Annexin V-FITC和PI染色液,孵育30 min,细胞凋亡率采用流式细胞仪检测。
1.3 统计学分析本实验采用±s的形式统计数据,并采用SPSS22.0和GraphPad Prism软件进行分析。两组间差异使用t检验,多组间差异使用单因素分析法,P<0.05表示差异存在统计学意义。
2 结果
2.1 CASC7在COPD中表达降低,miR-98-5p表达升高qRT-PCR检测收集的临床样本,结果显示,与非吸烟者的肺组织相比,非COPD吸烟者和COPD患者肺组织中CASC7表达降低,miR-98-5p表达上升(均P<0.05),且CASC7与miR-98-5p的表达呈负相关(r=-0.503 4,P<0.000 1,图1A~C)。检测痰液标本也得到与组织标本相同的结果(图1D~F)。
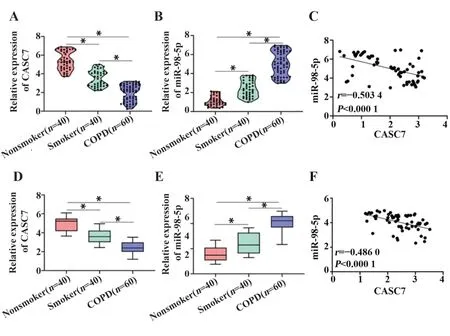
图1 qRT-PCR检测临床标本中CASC7和miR-98-5p的表达Fig.1 Expressions of CASC7 and miR-98-5p in clinical specimens was detected by qRT-PCR
2.2 COPD大鼠模型评估通过HE染色观察COPD大鼠的肺组织,评估建模情况。实验观察结果显示,与正常大鼠肺组织相比,COPD大鼠的肺泡壁变厚,面积增大,血管增多,支气管的管壁增厚,黏液腺增生,有大量炎症细胞浸润,纤毛倒伏,上皮结构紊乱。以上都符合COPD的特征,说明模型建立成功(图2)。

图2 HE染色结果(×200)Fig.2 HE staining results(×200)
2.3 COPD大鼠肺组织中CASC7表达降低,miR-98-5p表达增高,且PI3K通路被激活成功建立COPD大鼠模型后,检测大鼠肺组织中RNA表达,结果发现,与健康大鼠相比,COPD大鼠中CASC7的表达降低,miR-98-5p表达升高(图3A),且PI3K的mRNA与p-PI3K蛋白表达增高(图3B~D),说明PI3K通路被激活(均P<0.05)。
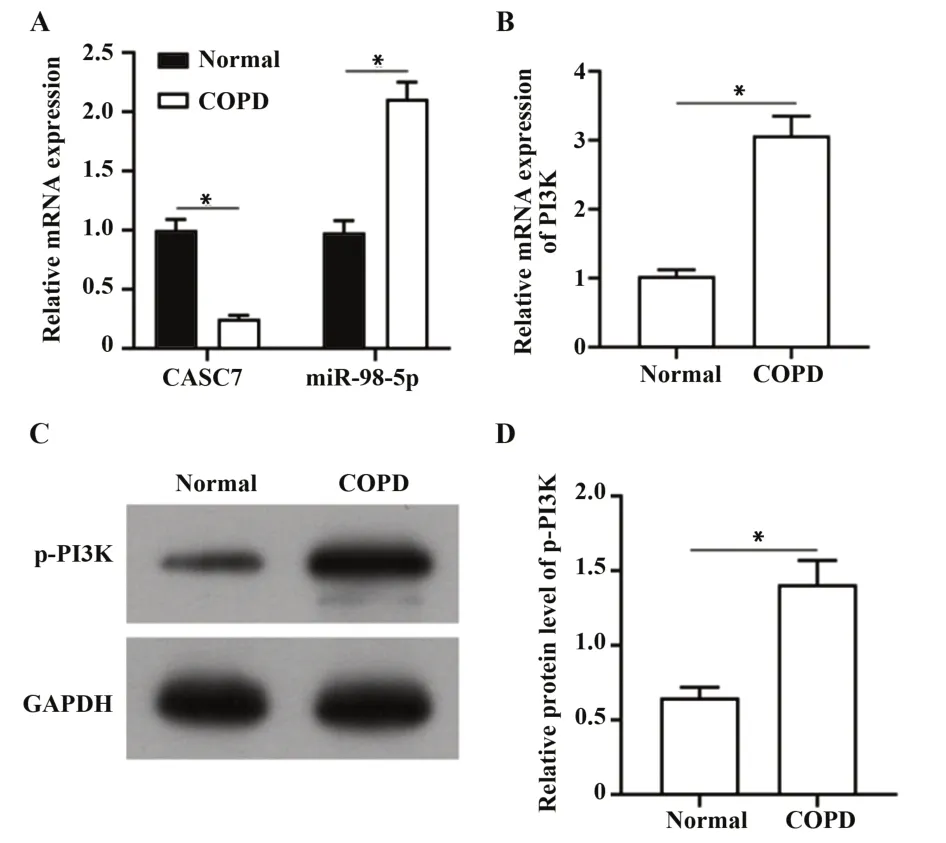
图3 肺组织中CASC7、miR-98-5p、PI3K表达水平Fig.3 Expressions of CASC7,miR-98-5p and PI3K in lung tissue
2.4 过表达CASC7能抑制COPD大鼠血清中炎症因子表达在大鼠体内转染了过表达CASC7的pcDNA3.1质粒,观察CASC7对大鼠血清中炎症因子的作用。ELISA结果表明,与对照组相比,过表达CASC7可抑制炎症因子分泌(均P<0.05,表2)。
表2 ELISA法检测IL-6、IL-8、TNF-α的表达水平(±s,pg/ml)Tab.2 IL-6,IL-8,TNF-α expression levels were detected by ELISA(±s,pg/ml)
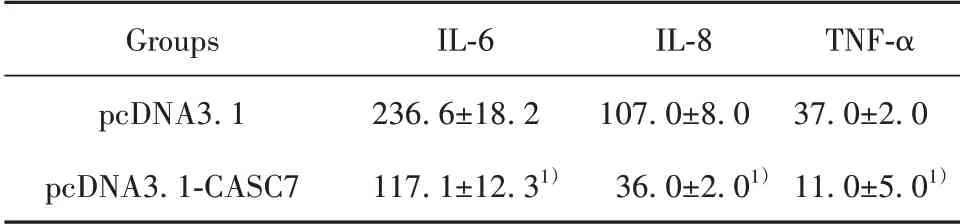
表2 ELISA法检测IL-6、IL-8、TNF-α的表达水平(±s,pg/ml)Tab.2 IL-6,IL-8,TNF-α expression levels were detected by ELISA(±s,pg/ml)
Note:Compared with pcDNA3.1,1)P<0.05.
Groups pcDNA3.1 pcDNA3.1-CASC7 IL-6 236.6±18.2 117.1±12.31)IL-8 107.0±8.0 36.0±2.01)TNF-α 37.0±2.0 11.0±5.01)
2.5 过表达CASC7可抑制BSMCs上清液中炎症因子的分泌和BSMCs细胞增殖,诱导BSMCs凋亡ELISA结果显示,与对照组相比,过表达CASC7可使炎症因子分泌减少(均P<0.05,图4A);CCK8和流式细胞术显示,与对照组相比,过表达CASC7可抑制BSMCs的增殖并诱导其凋亡(均P<0.05,图4B~D)。
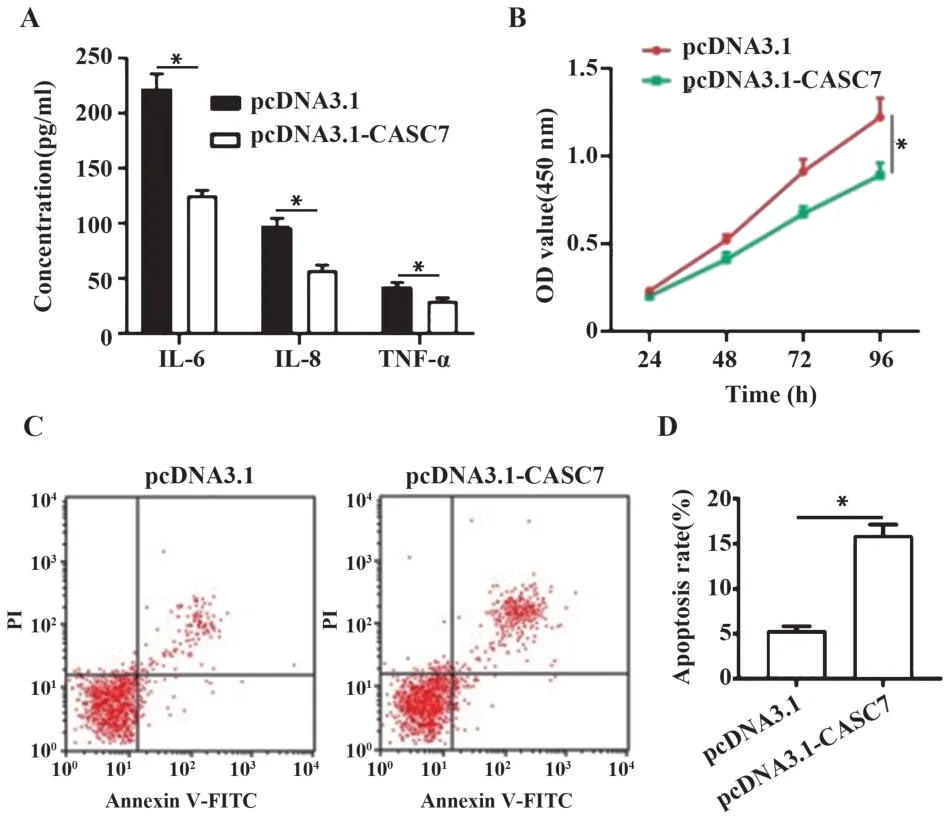
图4 过表达CASC7对BSMCs的生物学作用Fig.4 Biological effects of CASC7 overexpression on BSMCs
2.6 CASC7作为miR-98-5p的分子海绵发挥作用通过亚细胞定位网站(http://lncatlas.crg.eu/)和FISH实验检测出CASC7在细胞质中表达更高,说明CASC7可以作为ceRNA发挥功能(图5A);在lncRNASNP2(http://bioinfo.life.hust.edu.cn/lnc-RNASNP/#!/)中发现CASC7与miR-98-5p的结合位点(图5B),在此基础上本实验进行了双荧光素酶报告实验验证二者存在靶向关系(图5C),CASC7可以作为miR-98-5p的分子海绵。

图5 CASC7和miR-98-5p的靶向关系鉴定Fig.5 Identification of targeting relationship between CASC7 and miR-98-5p
2.7 miR-98-5p通过直接靶向SIRT3调控PI3K信号通路通过RNA22网站(https://cm.jefferson.edu/rna22/)预测了miR-98-5p的下游靶基因SIRT3,并通过双荧光素酶报告实验证明miR-98-5p可靶向调控SIRT3(图6A、B)。检测SIRT3在临床组织样本中的表达水平发现,与非吸烟者的肺组织相比,非COPD吸烟者和COPD患者的肺组织中SIRT3表达降低,痰液标本检测也得到相同结果(均P<0.05,图6C、D)。经分析得出miR-98-5p与SIRT3的表达呈负相关(r=-0.883 7,P<0.000 1,图6E)。Western blot检测p-PI3K蛋白表达,结果发现,过表达miR-98-5p可明显上调p-PI3K蛋白表达,抑制miR-98-5p表达则可下调p-PI3K蛋白表达(图6F、G)。
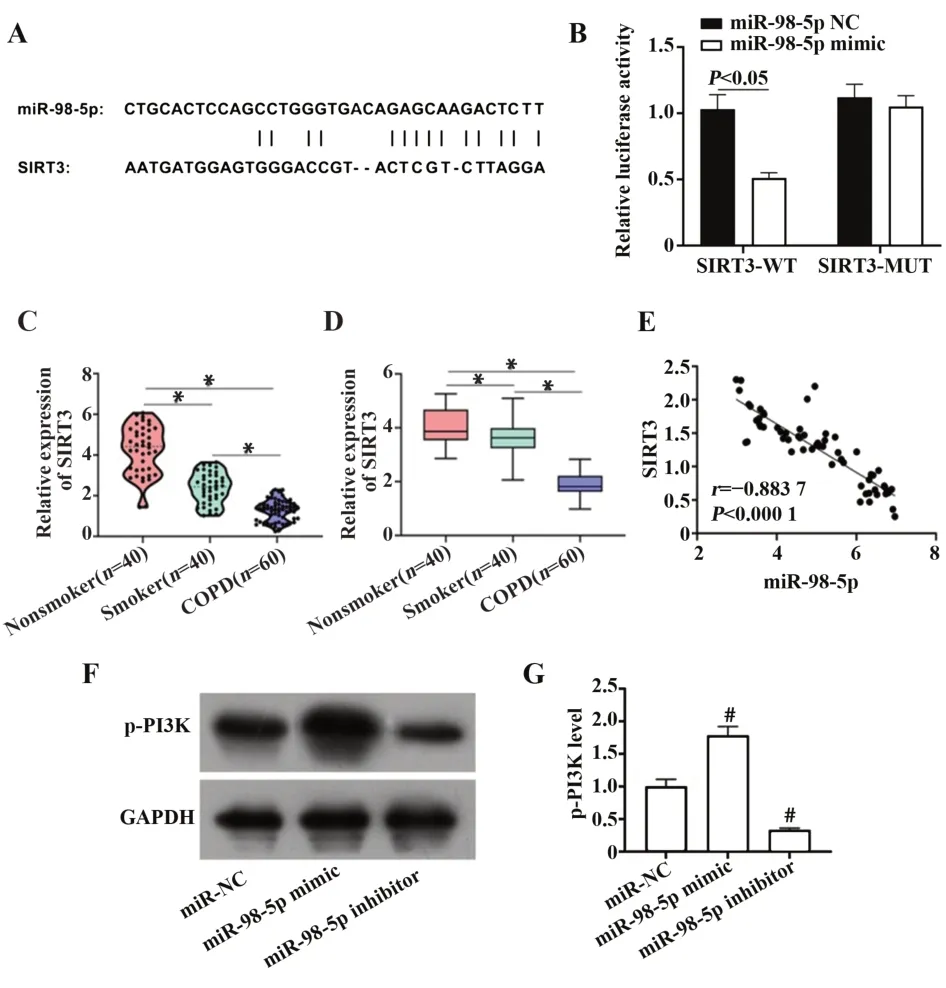
图6 miR-98-5p、SIRT3、PI3K关系验证Fig.6 miR-98-5p,SIRT3,PI3K relationship verification
2.8 改变SIRT3可部分抑制CASC7或miR-98-5p对大鼠血清炎症因子表达的影响与miR-98-5p in‑hibitor+si-NC组 相 比,miR-98-5p inhibitor+si-SIRT3组IL-6、IL-8、TNF-α表达水平上升,说明沉默SIRT3可以部分抑制下调miR-98-5p对炎症因子分泌的影响作用;与CASC7+si-NC组相比,CASC7+si-SIRT3组IL-6、IL-8、TNF-α表达水平均上升(均P<0.05,图7),提示沉默SIRT3也可以部分挽救CASC7的作用。
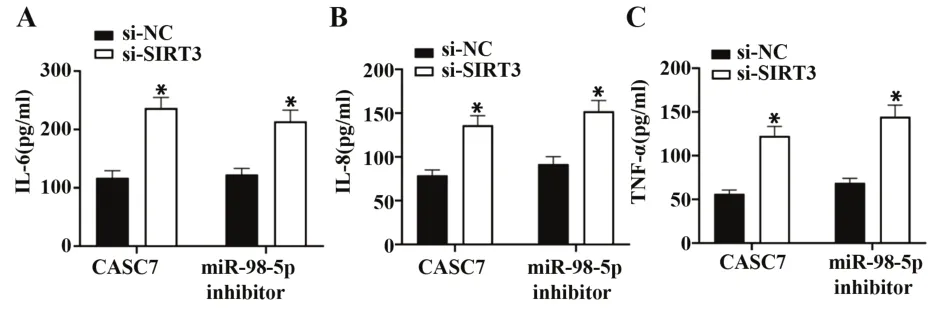
图7 ELISA法检测IL-6、IL-8、TNF-α的表达水平Fig.7 Expression levels of IL-6,IL-8 and TNF-α were detected by ELISA
2.9 敲低SIRT3可以部分逆转过表达CASC7或miR-98-5p抑制剂对BSMCs的作用ELISA结果发现,相较于miR-98-5p inhibitor+si-NC组,miR-98-5p inhibitor+si-SIRT3组各因子的表达均被促进(均P<0.05);相较于CASC7+si-NC组,CASC7+si-SIRT3组IL-6、IL-8、TNF-α表达均上升(均P<0.05,图8A~C)。CCK-8实验结果显示,较miR-98-5p inhibitor+si-NC组,miR-98-5p inhibitor+si-SIRT3组的细胞增殖能力增强(P<0.05),较CASC7+si-NC组,CASC7+si-SIRT3组的细胞增殖被促进(P<0.05,图8D)。流式细胞术结果显示,较miR-98-5p inhibitor+si-NC组,miR-98-5p inhibitor+si-SIRT3组的细胞凋亡率降低(P<0.05);较CASC7+si-NC组,CASC7+si-SIRT3组的细胞凋亡率降低(P<0.05,图8E);Western blot结果显示,与miR-98-5p inhibitor+si-NC组相比,miR-98-5p inhibitor+si-SIRT3组p-PI3K蛋白表达升高(P<0.05),与CASC7+si-NC组相比,CASC7+si-SIRT3组p-PI3K表达升高(P<0.05,图8F)。提示si-SIRT3可以部分逆转miR-98-5p inhibitor或CASC7对细胞产生的影响(图8G)。

图8 敲低SIRT3能影响过表达CASC7或miR-98-5p抑制剂对BSMCs的作用Fig.8 Knocking down SIRT3 could affect effect of overex⁃pressed CASC7 or miR-98-5p inhibitor on BSMCs
3 讨论
本研究从分子生物学角度探究了CASC7在COPD进展中的作用,发现其能够与miR-98-5p竞争性结合进而抑制SIRT3表达,改善COPD大鼠气道炎症反应及BSMCs增殖。
COPD发病的主要原因是气道炎症,且小气道炎症也是COPD的主要病变部位,该过程会使大量炎症细胞浸出,同样也会释放大量IL-6、IL-8、TNF-α,导致气流受限,最终还会引起肺纤维化[12-13]。中性粒细胞的增多是COPD的中心环节,IL-6可抑制中性粒细胞凋亡,推进中性粒细胞增殖,而IL-8与IL-6的分泌也具有相关性[14]。另外肺泡巨噬细胞在COPD中的增多也可间接导致肺组织损伤,肺泡巨噬细胞也促进了TNF-α的产生,TNF-α在肺气肿的发生中占有重要地位[15]。气道炎症也会引起气道管壁增厚,支气管气道平滑肌的增生肥大,从而导致气道重构,气道重构是COPD具有标志性的病理变化[16]。
本研究发现LncRNA CASC7在COPD中低表达,且过表达CASC7抑制了IL-6、IL-8、TNF-α的分泌,抑制BSMCs的增殖,诱导其凋亡,可见CASC7能够对气道炎症起保护作用,并通过抑制BSMCs的增殖来抑制气道管壁增厚现象。既往研究表明,LncRNA CASC7在肺癌中发挥抑癌因子作用[8]。此外,CASC7在哮喘中也发挥保护作用,能够改善严重哮喘的进展[9]。本研究则进一步证实了CASC7在COPD进展中的影响及其保护功能。
很多研究证明LncRNAs作为miRNAs的分子海绵,调节细胞的多种发展过程。本研究利用生物学网站和FISH实验验证CASC7可以海绵吸附miR-98-5p。miR-98-5p在肺部疾病中的作用已被证实。MUSRI等[10]研究了COPD中多种miRNAs的异常表达,结果发现miR-98在COPD患者中上调。本课题组通过实验也得到了在COPD中miR-98-5p表达上调的结论,还发现miR-98-5p与CASC7的表达呈负相关,在COPD中发挥促进疾病发展的作用。而后课题组又发现并验证了miR-98-5p的下游靶基因SIRT3。SIRT3是烟酰胺腺嘌呤二核苷酸依赖性组蛋白去乙酰化酶的一种,存在于线粒体中,并在正常组织中广泛表达,被认为是细胞保护性Sirtuin[17]。研究发现,SIRT3可诱导肺癌细胞的凋亡与坏死,也可抑制COPD气道上皮线粒体氧化应激,改善细胞损伤[11,18]。另外一项研究显示,COPD患者的外周血单个核细胞中SIRT1蛋白表达显著降低[19]。本研究发现SIRT3在COPD中表达下调,并且可以被CASC7/miR-98-5p轴调控,过表达CASC7或miR-98-5p抑制剂对炎症因子和BSMCs的抑制作用均可被沉默SIRT3反转,SIRT3在COPD中发挥保护作用。
另外已有研究表明,SIRT3与人磷脂酰肌醇3激酶(PI3K)信号通路相关,有研究表明人参皂苷Rg3和补肺益肾Ⅱ号方都能有效抑制PI3K活性,缓解COPD的症状[20-22]。本实验验证了miR-98-5p可以通过SIRT3影响PI3K活性,进而参与COPD的发展。
本研究从气道炎症和BSMCs的角度探讨了CASC7在COPD中的生物学功能,可能为COPD的预防与治疗发现了新的生物标志物,并提供了实验依据。

