几种农用抗生素诱导植物对灰霉病的抗性及其 信号转导途径研究
安 康,韩 兴,刘海涛,王 娇,李亚宁,刘大群,
(1.河北农业大学 植物保护学院/河北省农作物病虫害生物防治技术创新中心/国家北方山区农业工程技术研究中心,河北 保定 071001;2. 中国农业科学院 研究生院,北京 100081)
农用抗生素是微生物发酵产生的次级代谢产物,能有效抑制或杀灭农作物病原物以及调节作物生长发育[1]。农用抗生素种类繁多、分布广泛,主要来自真菌、细菌、放线菌以及其他微生物[2],与传统化学农药相比具有毒性低、易降解等特点,在农作物病虫害综合防控中起到重要作用,其防治作用机理包括破坏病原物的细胞结构,抑制病原菌物质能量代谢以及提高植物抗病性等[3]。探明农用抗生素防治植物病害的作用机制,是合理、有效使用这些药剂进行病虫害防控的重要前提。以往的研究中更多只关注农用抗生素对病原菌的直接杀灭作用,随着植物免疫学的迅速发展,农用抗生素对植物本身抗病性的诱导作用也越来越受到研究者们的关注。胡能[4]发现水稻经15 mg/L 农抗702 诱导处理后,可提高植株内防御酶活性,促进抗病相关蛋白的表达,增强水稻对纹枯病、白叶枯病的抗病性。王志坤[5]发现使用12.5 mg/L 武夷菌素处理盆栽茶树,可以促进其叶绿素可溶性糖含量的增长,诱导茶树体内丙二醛含量的下降及抗病相关酶活性的增强。Shimizu 等[6]从杜鹃花中分离到的R-5 菌株能产生放线菌类与多烯类抗生素,可诱导植物产生抗病性。
申嗪霉素是铜绿假单胞杆菌M18 菌株代谢产生的一类26 位大环内酯类抗生素[7],其作用机制是在病原菌发生还原反应的生理过程中产生O2-、H2O2、氧化谷胱甘肽和转铁蛋白,破坏细胞正常代谢,从而抑制病原菌的生长[8]。钱艳杰等[9]发现水稻分蘖期施用申嗪霉素,可促进水稻根系生长以及提高作物产量。朱祥[7]发现申嗪霉素与水杨酸复配后,诱导植物产生抗病性要显著高于单独药剂诱导的处理。多抗霉素是金色链霉菌分泌的一类肽嘧啶核苷酸抗生素,其对病菌的杀灭作用主要是抑制病原菌细胞壁几丁质合成,抑制病原菌芽管和菌丝体局部扩展,从而导致病原菌死亡[10]。春雷霉素是春日链霉菌分泌的一类氨基糖苷类抗生素,可通过干扰病原菌的代谢,破坏蛋白质的生物合成,抑制菌丝生长,使病原菌丧失侵染和繁殖能力[11]。
本实验室前期选取生产上常用的一些农用抗生素,通过温室试验和离体叶片接种试验检测这些农用抗生素诱导烟草对灰霉病的抗性,筛选出申嗪霉素、多抗霉素、春雷霉素这3 种对植物灰霉病诱抗效果较好的抗生素,检测发现其分别在40 mg/L 4 d、5 mg/L 4 d、80 mg/L 3 d 处理条件下对灰霉病的诱抗效果较好。在此前期研究的基础上,本研究进一步检测了这3 种农用抗生素对不同植物灰霉病的诱导抗病性效果,同时对其诱抗烟草灰霉病的信号转导途径相关基因表达量的变化进行了检测和分析,为拓展这些农用抗生素的使用范围及丰富其防治作用机理提供重要的依据。
1 材料与方法
1.1 供试材料
供试药剂:95%申嗪霉素(Shenzinomycin)原药来自上海交通大学生命科学技术学院,70%多抗霉素(Polyoxin)原药来自上海源叶生物科技有限公司,73%春雷霉素(Kasugamycin)原药来自石家庄深泰化工有限公司。
供试植物:本氏烟、茄子、番茄、辣椒、黄瓜、草莓。
供试菌株:灰霉病菌(Botrytis cinerea)菌株由河北农业大学植物病害生物防治实验室保存。
1.2 农用抗生素诱导植物对灰霉病抗性的效果检测
将浓度为40 mg/L 申嗪霉素、5 mg/L 多抗霉素、80 mg/L 春雷霉素分别喷雾处理烟草、草莓、黄瓜、番茄、辣椒、茄子植株的下部叶片。因原药不易溶于水,配置抗生素溶液时先用1 mL 甲醇溶解,再加水稀释至相应浓度。为避免喷雾处理时对上部叶片的影响,操作时使用塑料袋将上部叶片包裹好。每个处理重复10 次,每棵苗取1 片叶。3 种抗生素分别在处理后的第4 天、第4 天、第3 天,取上部未处理的叶片,置于水琼脂培养皿中,每个培养皿中放1 片叶,将直径为0.7 cm 的灰霉病菌菌块接种于叶片左侧(注:其中番茄叶片较小,所以番茄叶片接种直径为0.5 cm 的菌饼),右侧接种PDA 培养基块为对照。21 ℃培养3 d,观察并记录病斑大小,计算病斑减小率。

1.3 抗病信号转导途径相关基因表达量的检测
选取10 ~12 叶期的烟草,按照1.2 方法进行喷雾处理,分别于施药后的24 、48 、72 、96 、120 、144 和168 h,用消毒的剪刀剪下处理叶与系统叶(注:下部喷雾处理的叶片为处理叶,上部未处理的叶片为系统叶)称重,用锡箔纸包好后迅速置于液氮中冷却,-80 ℃保存备用。每次剪下处理叶与系统叶的一部分,保证上述7 个时间点采取的为同一叶片。
1.3.1 RNA 的提取 烟草叶片RNA 的提取采用全式金生物技术有限公司TransZol Up Plus RNA Kit试剂盒。
1.3.2 cDNA 的合成 采用全式金生物技术有限公司TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix 试剂盒。
1.3.3 荧光定量qPCR 检测信号转导途径相关基因的表达量 抗病信号转导途径相关基因及内参基因的引物序列参考Alizadeh[12]和Shoresh[13],具体见表1。
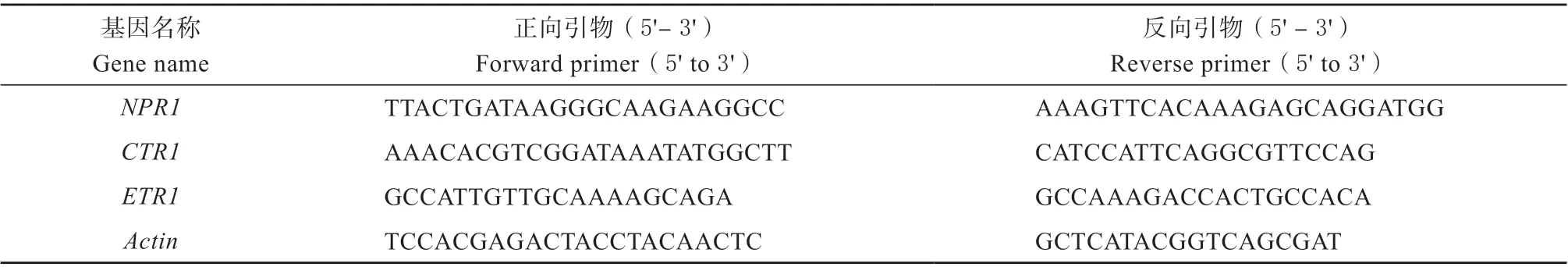
表1 抗病信号转导途径相关基因及内参基因引物Table 1 Primers of genes related to disease resistance signal transduction pathway and the internal reference gene
以反转录的cDNA 为模板,使用全式金生物技术有限公司的qPCR mix,在伯乐BIO-RAD CFX96实时荧光定量PCR 仪中对NPR1、CTR1、ETR1这3 个抗病相关基因的表达量进行检测分析。根据仪器检测到的CT 值,按照公式2-△△CT,计算所测基因的相对表达量。
2 结果与分析
2.1 农用抗生素诱导的不同植物对灰霉病的抗性
2.1.1 申嗪霉素诱导的植物抗病性 如图1 所示,利用40 mg/L 申嗪霉素诱导烟草、茄子、草莓、番茄、辣椒、黄瓜对灰霉病的抗性,处理后的6 种植物叶片上的灰霉病病斑直径均显著低于甲醇对照(P<0.05),病斑减小率从高到低依次为烟草(55.56%)>番茄(47.18%)>黄瓜(45.41%)>茄子(38.71%)>草莓(35.62%)>辣椒(25.85%),表明申嗪霉素能够诱导这6 种植物对灰霉病产生抗性。
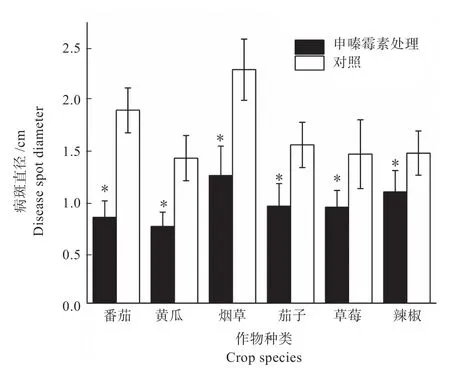
图1 申嗪霉素诱导不同植物对灰霉病的抗性Fig.1 Resistance of different plants against tobacco gray mold after induced by shenzinomycin
2.1.2 多抗霉素诱导的植物抗病性 如图2 所示,利用5 mg/L 多抗霉素诱导烟草、茄子、草莓、番茄、辣椒、黄瓜对灰霉病菌的抗病性,处理后的6 种植物叶片上的灰霉病病斑直径均显著低于甲醇对照(P<0.05),病斑减小率从高到低依次为番茄(46.48%)>黄瓜(45.41%)>茄子(41.29%)>草莓(39.73%)>烟草(37.57%)>辣椒(25.17%)。表明多抗霉素能够诱导这6 种植物对灰霉病产生抗性。
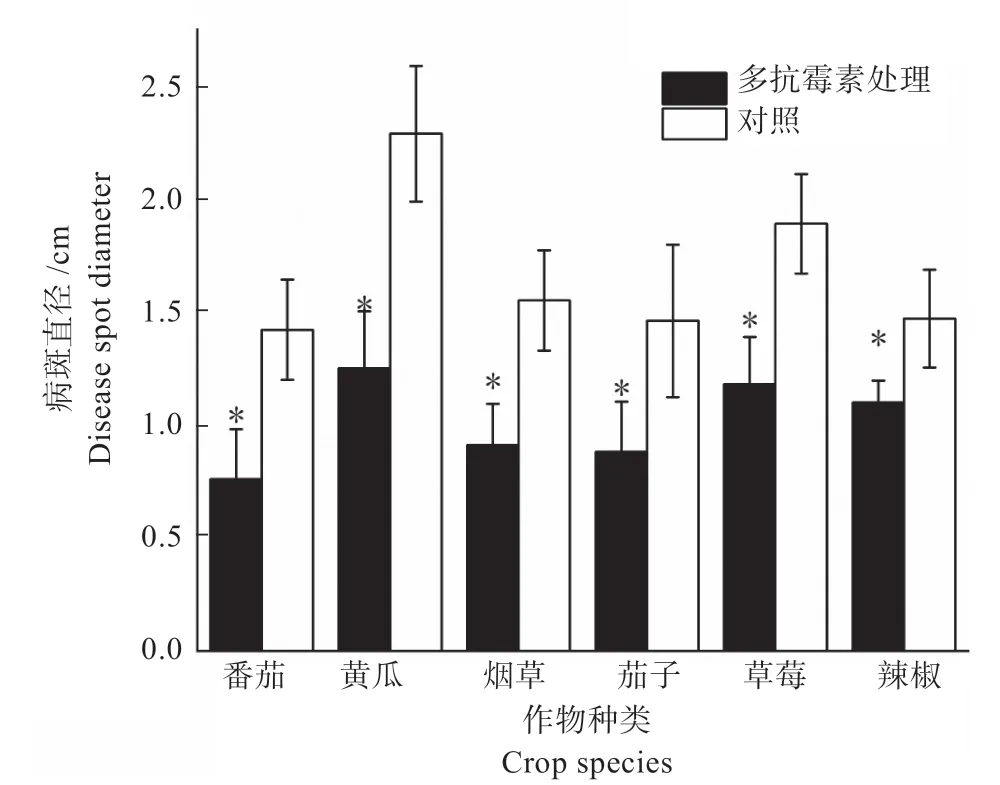
图2 多抗霉素诱导不同植物对灰霉病的抗性Fig.2 Resistance of different plants against tobacco gray mold after induced by polyoxin
2.1.3 春雷霉素诱导的植物抗病性 结果如图3 所示,利用80 mg/L 春雷霉素诱导烟草、茄子、草莓、番茄、辣椒、黄瓜对灰霉病菌的抗病性,处理后的6 种植物叶片上灰霉病的病斑直径均显著低于甲醇对照(P<0.05),病斑减小率从高到低依次为番茄(51.26%)>黄瓜(39.51%)>烟草(34.07%)>茄子(32.59%)>草莓(23.47%)>辣椒(20.17%),表明春雷霉素能够诱导这6 种植物对灰霉病产生 抗性。
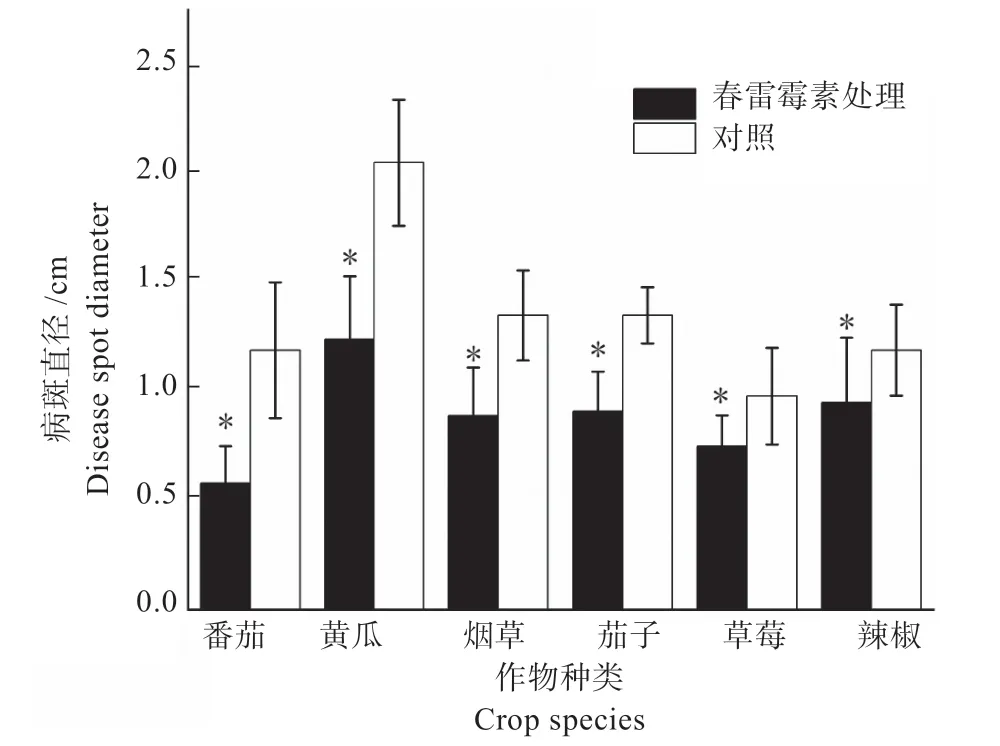
图3 春雷霉素诱导不同植物对灰霉病的抗性Fig.3 Resistance of different plants against tobacco gray mold after induced by kasugamycin
2.2 抗病信号转导途径相关基因表达量的变化
2.2.1NPR1基因表达量的变化NPR1基因是植物抗病信号转导途径的关键基因[14-15],是调节SA 和JA/ET 信号转导途径的重要调控因子。如图4 所示,处理叶中,申嗪霉素处理在120 h、多抗霉素处理在72 h、春雷霉素处理在96 h 时,NPR1基因表达量最高,显著高于清水对照,分别为对照的9.82 倍、5.02 倍、4.13 倍,随后NPR1基因表达量有所下降,但依然显著高于清水对照。系统叶中,NPR1基因表达量呈现出相似的趋势,但存在一定的滞后性,申嗪霉素处理在120 h、多抗霉素处理在96 h、春雷霉素处理在120 h 时NPR1基因表达量最高,分别为清水对照的11.48 倍、3.36 倍、4.10 倍,随后NPR1基因表达量开始下降,但仍显著高于清水对照。表明申嗪霉素、多抗霉素、春雷霉素均可激发烟草植株系统抗病过程中NPR1标志基因的表达,从而激活SA 和JA/ET 信号转导途径,诱导植株产生系统抗病性。
2.2.2CTR1基因表达量的变化CTR1基因位于乙烯(ET)受体下游,是ET 信号通路中关键的负调控因子。如图5 所示,处理叶中,申嗪霉素处理、多抗霉素处理、春雷霉素处理均在120 h 时,CTR1基因表达量最低,清水对照分别为三者的2.27 倍、5 倍、20 倍。系统叶中,CTR1基因表达量呈现出类似的趋势,但存在一定的滞后性,申嗪霉素和春雷霉素在96 h 之后,多抗霉素在72 h 之后,CTR1基因表达量开始低于对照,表达量最低时,清水对照分别为三者的1.61 倍、2.04 倍、2.44 倍,其中多抗霉素在144 h 之后CTR1基因表达量又趋于正常水平。表明申嗪霉素、多抗霉素、春雷霉素可抑制ET下游负调控基因CTR1的表达,从而诱导植株产生系统抗病性。
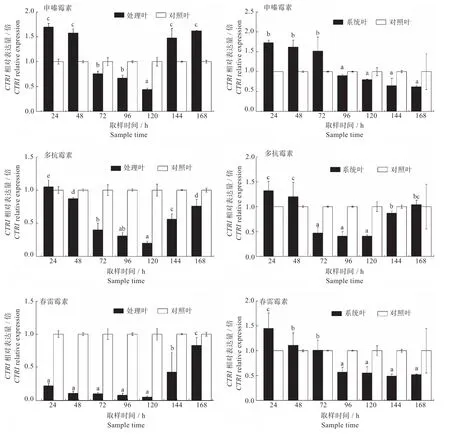
图5 申嗪霉素、多抗霉素、春雷霉素诱导后烟草CTR1 基因表达量的变化Fig.5 Changes in CTR1 gene expression in tobacco after induced by shenzinomycin, polyoxin and kasugamycin
2.2.3ETR1基因表达量的变化ETR1基因是乙烯(ET)信号通路中关键的负调控因子。如图6 所示,处理叶中,申嗪霉素处理在120 h、多抗霉素处理在48 h、春雷霉素处理在120 h 时,ETR1基因表达量最低,清水对照分别为三者的4 倍、2.13 倍、1.69 倍。系统叶中,ETR1基因表达量呈现出类似的趋势,但存在一定的滞后性,申嗪霉素处理在120 h、多抗霉素处理在96 h、春雷霉素处理在144 h 时,ETR1基因表达量最低,清水对照分别为三者的2.08 倍、3.36倍、2.08 倍。表明申嗪霉素、多抗霉素、春雷霉素可抑制ETR1基因在ET 信号转导通路中的表达,从而诱导植株产生系统抗病性。

图6 申嗪霉素、多抗霉素、春雷霉素诱导后烟草ETR1 基因表达量的变化Fig.6 Changes in ETR1 gene expression in tobacco after induced by shenzinomycin, polyoxin and kasugamycin
3 讨论与结论
本研究通过对申嗪霉素、多抗霉素、春雷霉素这3 种农用抗生素诱导烟草、草莓、黄瓜、番茄、辣椒、茄子等不同植物灰霉病抗性试验,发现这3 种抗生素处理后叶片的病斑面积均显著低于对照,表明它们可以诱导不同植物产生对灰霉病的抗性,为拓展这些抗生素的使用范围及其合理有效利用,以及丰富农用抗生素的防治作用机理提供了重要依据。
抗病信号通过复杂的信号转导途径促进或刺激植物潜在防御基因的表达,是植物诱导抗性分子机制的关键之一。目前研究比较深入的信号转导途径有水杨酸途径(SA)、茉莉酸途径(JA)与乙烯途径(ET)[16-18]。NPR1是SA 信号通路关键基因,可以调节PR1、PR5等多个抗病相关基因的表达,诱导植物获得抗病性,是SA 和JA/ET 信号通路的协同交叉过程中的一个关键调控基因[19]。张薇等[20]报道烟草经蛋白激发子PeaT1 处理后,其体内SA含量增加,与诱导抗性相关的PR1a、PR1b、NPR1基因均显著上调。JA/ET 是植物诱导系统获得抗病性(SAR)的第2 信使[21],CTR1基因是ET 转导途径中下游的负调控因子[22]。SA 和JA/ET 信号转导途径是一个错综复杂的网状结构,既相互独立又相互联系。彭金英等[23]报道番茄植株被昆虫取食后,可以激活植物体内SA 和JA/ET 信号转导通路,诱导植物产生抗病性。本研究发现,40 mg/L 申嗪霉素、5 mg/L 多抗霉素、80 mg/L 春雷霉素诱导处理植物后,均能抑制烟草体内ETR1和CTR1基因的表达,促进NPR1抗病基因表达,从而诱导植株产生抗病性。另外,系统叶中的基因表达量相对于处理叶存在一定的滞后性。因此推测申嗪霉素、多抗霉素、春雷霉素的诱导处理,激活了烟草SA 信号通路与JA/ET 信号通路,从而诱导植株产生抗病性。

