加味青蒿鳖甲汤对急性髓性白血病完全缓解患者CD34+源树突细胞诱导过程中IL-6的影响*
尹尚瑾 黄礼明 常宝珠 姚宇红 李秀军 陈 涛 宋 娟 陈孟豪
1贵州中医药大学第二附属医院血液科,贵阳 550003 2郑州工业应用技术学院,河南新郑 451100
急性白血病(acute leukemia,AL)完全缓解后复发是困扰其治愈的一大难题,其中微小残留白血病(minimal residual disease in leukemia,MRD-L)是复发的根源所在[1]。树突细胞(dendritic cells,DC)可提呈白血病抗原,使抗白血病的特异性T细胞启动应答。MRD-L状态下各种细胞因子水平紊乱,以及机体内环境发生改变对DC的转化及功能产生不利影响,引起免疫功能下降、残留的白血病细胞逃逸机体免疫。因此,彻底清除白血病患者体内的MRD是改善AL患者生活质量并延长无病生存期的重要措施。本研究在中医药理论指导下,以扶正透毒、祛毒为治疗原则,探讨加味青蒿鳖甲汤对急性髓性白血病完全缓解(acute myelogenous leukemia complete remission,AML-CR)患者CD34+源DC诱导过程中IL-6水平的影响,以期明确加味青蒿鳖甲汤治疗MRD的可能机制。
1 材料与方法
1.1 临床标本来源
选取贵州中医药大学第二附属医院血液科及贵州省人民医院血液科化疗后达到血液学完全缓解的AML-CR患者8例,患者符合《血液病诊断及疗效标准》[2]中的诊断标准,且经细胞学、免疫学、分子生物学和遗传学确诊为AML,年龄18~65岁,性别不限,患者知情并签署知情同意书。
1.2 主要试剂及设备
人淋巴细胞分离液(天津灏洋公司),RPMI 1640(美国GBICO公司),CD34+细胞免疫磁珠分选试剂盒(瑞士DYNAL公司),FMS样络氨酸激酶3(Flt-3)、白细胞介素-3(IL-3)、血小板生成素(TPO)、干细胞生长因子(SCF)、重组粒细胞-巨噬细胞集落刺激因子(GM-CSF)均来自美国Prepro Tech公司;重组人α-干扰素(IFN-α)、白细胞介素-4(IL-4)、肿瘤坏死因子-α(TNF-α)均来自上海primefene公司;CD80、CD83、CD86、CD1a、HLA-DR抗体由美国BioLegend公司提供。IL-6 ELISA检测试剂盒(武汉华美公司);水纯化装置(SZ-97自动三重纯水整蒸馏器);电热鼓风干燥箱(101-1 AB型,天津伟泰斯特);全自动高压灭菌锅(MLS-3020,日本三洋);倒置显微镜(奥林巴斯IX71);二氧化碳培养箱(Thermo,3111型);低温离心机(TD24-WS,新湘仪);自动酶标检测仪(ELX800,美国通用);流式细胞仪(BD Facscalibur);3 D摇床(KB-7007,海门其林贝尔公司);15 mL、50 mL离心管,25 cm2培养瓶以及6孔板等均来自美国CORNING公司。
1.3 加味青蒿鳖甲汤含药兔血清制备
煎取加味青蒿鳖甲汤(黄芪、黄精、青蒿、鳖甲、白花蛇舌草、半枝莲等)原药并浓缩药液浓度至2 g/mL,室温冷却后置于4℃冰箱备用。将12只新西兰兔(4月龄、体质量约2 kg、来自贵阳鹏程农业科技有限公司)随机分成4组:加味青蒿鳖甲汤高、中、低剂量组及空白组,每组3只,参照《药理实验方法学》[3]人-兔体表面积等效剂量比换算后得出加味青蒿鳖甲汤灌胃高、中、低剂量分别为10 g/kg、5 g/kg、2.5 g/kg;灌胃连续3天,每天2次(于每日早晚进食前),空白组正常饮食不予特殊处理。于最后1次灌胃2 h后在无菌条件下行心脏取血,将取得的血清用微孔滤过膜(0.45 μm)过滤除菌后,在超净台内分装,标记、冻存于-20℃冰箱。
1.4 CD34+细胞体外提取、扩增
用PBS将抽取的AML-CR患者骨髓以1∶1稀释、混匀后,并按2∶1的比例将骨髓贴壁匀速缓慢地加入装有人淋巴分离液的15 mL离心管内,置于离心机中以2000 r/min离心20 min后,提取白膜层并移入新的15 mL离心管内,予PBS按3∶1的比例稀释、混匀后于离心机内以1500 r/min离心10 min后取出,弃上清,再次予PBS按上述比例稀释、混匀后于离心机内以1500 r/min离心10 min后取出,弃上清,所得即为骨髓单个核细胞(BMNC),用1 mL 10% FCS RPMI 1640稀释后混匀备用。将100 μL CD34+免疫磁珠用2 mL EDTA液在磁珠架上清洗干净后弃上清,将收集的BMNC与免疫磁珠充分混匀。于4℃条件下放置于摇床上震荡孵育30 min后,静置于磁架上1 min,弃上清。用2 mL PBS洗涤后置于磁珠架上,弃上清,此步骤重复3次后加入100 μL磁珠清洗液、1 mL 10% FCS RPMI 1640培养基混匀后置于摇床上室温下震荡孵育40 min,再加入2 mL PBS充分混匀加强洗磁珠,于磁珠架上静置2 min,收集上清液于无菌离心管内。如此反复3次,将所收集的细胞悬液以1000 r/min离心5 min后弃上清,以3 mL 10% FCS RPMI 1640培养混匀细胞后移入新的5 mL EP管中,于磁架上静置2 min,用新的15 mL离心管收集剩余液体,重悬得到CD34+细胞。将提取获得的CD34+细胞用移液器加入25 cm2培养瓶中,并在培养瓶中加入Flt3、IL-3、TPO、SCF等细胞因子,在培养瓶中进行CD34+细胞扩增,扩增时间为5~7天,隔天需半量换液,换液同时需补充等量培养基及扩增因子。
1.5 DC诱导
CD34+细胞扩增5~7天后,在显微镜下观察到其细胞数量呈对数生长后离心,并补充5 mL 10%FCS RPMI 1640培养基,将其等分加入6孔培养板中,用培养液调整每孔细胞数约1×106/mL,将6孔培养板分为5组,分别加入含药兔血清及细胞因子以诱导DC,具体分组如下:单纯细胞因子组(A组)、正常兔血清+细胞因子(B组)、加味青蒿鳖甲汤低剂量+细胞因子组(C组)、加味青蒿鳖甲汤中剂量+细胞因子组(D组)、加味青蒿鳖甲汤高剂量+细胞因子组(E组);其中含药兔血清浓度为200 μL/mL,细胞因子浓度分别为IFN-α 100 ng/mL,GM-CSF 100 ng/mL,IL-4 50 ng/mL,TNF-α 100 ng/mL。诱导9天,诱导期间每3~4天进行半量换液,并补充等量的10% FCS RPMI 1640培养基、细胞因子及兔血清,各组在培养第7天半量换液后均加入TNF-α促进DC成熟。
1.6 IL-6检测
在DC诱导过程中的第0天、第6天、第9天分别吸取上清液1 mL置于已标记好的1.5 mL无菌EP管中,于-20℃条件下保存备用,按照ELISA试剂盒说明书于酶标仪检测IL-6的光密度值并计算其水平。
1.7 DC鉴定
在倒置显微镜下观察DC的大小、形态并记录;使用自动细胞计数仪将细胞数量调整至5×105~1×106/mL,用15 mL试管分别收集6孔板中的细胞,再用PBS溶液洗涤6孔板3次并收集洗涤液,经2000 r/min离心5 min后,以2 mL 10% FCS RPMI 1640培养基重悬混匀细胞后取1 mL于小EP管中,开盖于培养箱中培养过夜后分别加入CD83、CD86、CD80、CD1a、HLA-DR抗体各5 μL,再加入细胞100 μL,充分混匀后放置20 min,用流式细胞仪检测DC表面分子CD83、CD86、CD80、CD1a及HLA-DR的表达率。
1.8 统计学分析

2 结果
2.1 CD34+细胞数量及扩增情况
经免疫磁珠提取的CD34+细胞数量以及经培养扩增后的CD34+细胞数量分别为(4.13±1.76)×104个/mL和(5.23±1.67)×106个/mL。
2.2 DC形态观察
随着DC诱导天数的增加,在扩增培养第3天细胞表面变得不规则、毛糙,并相互成簇出现聚集现象;见图1。培养第6天时,细胞胞体增大,聚集增多,细胞表面突起变粗、变长,犹如树杈状分枝;见图2。在第9天时细胞胞体明显增大,突起增多,基本形成具有典型成熟形态的DC;见图3。
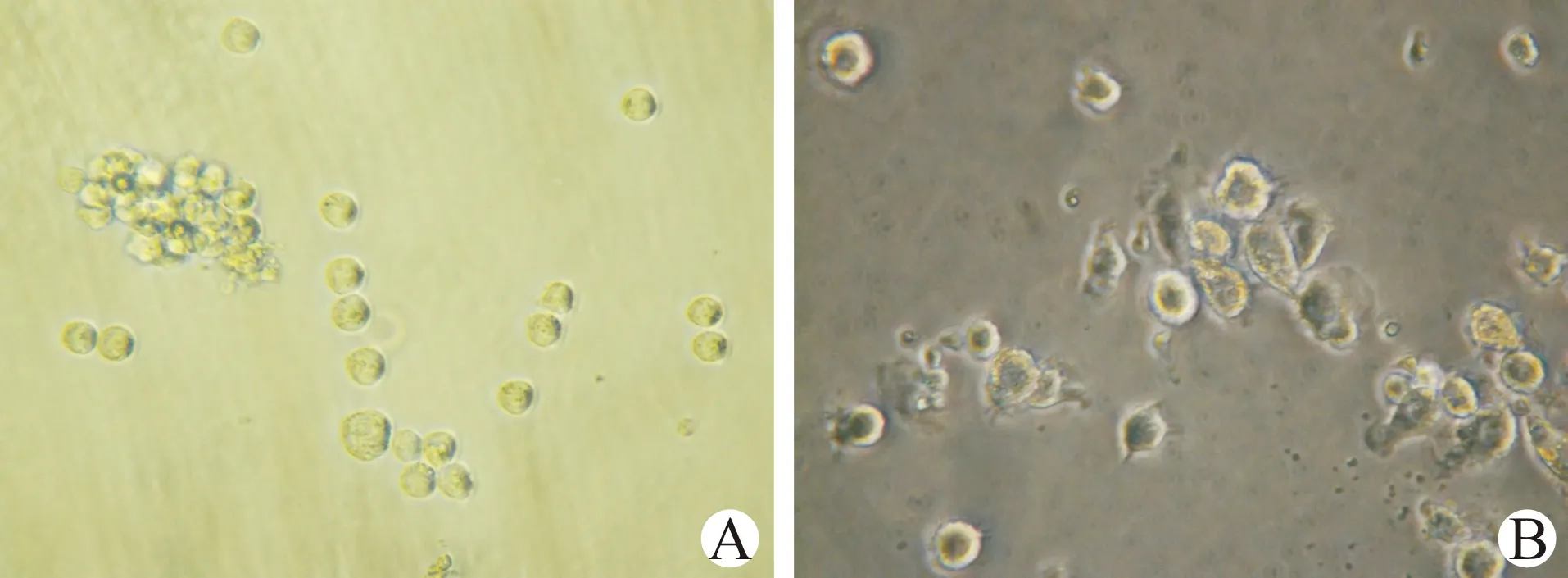
A(×200倍);B(×400倍)图1 扩增培养第3天DC形态
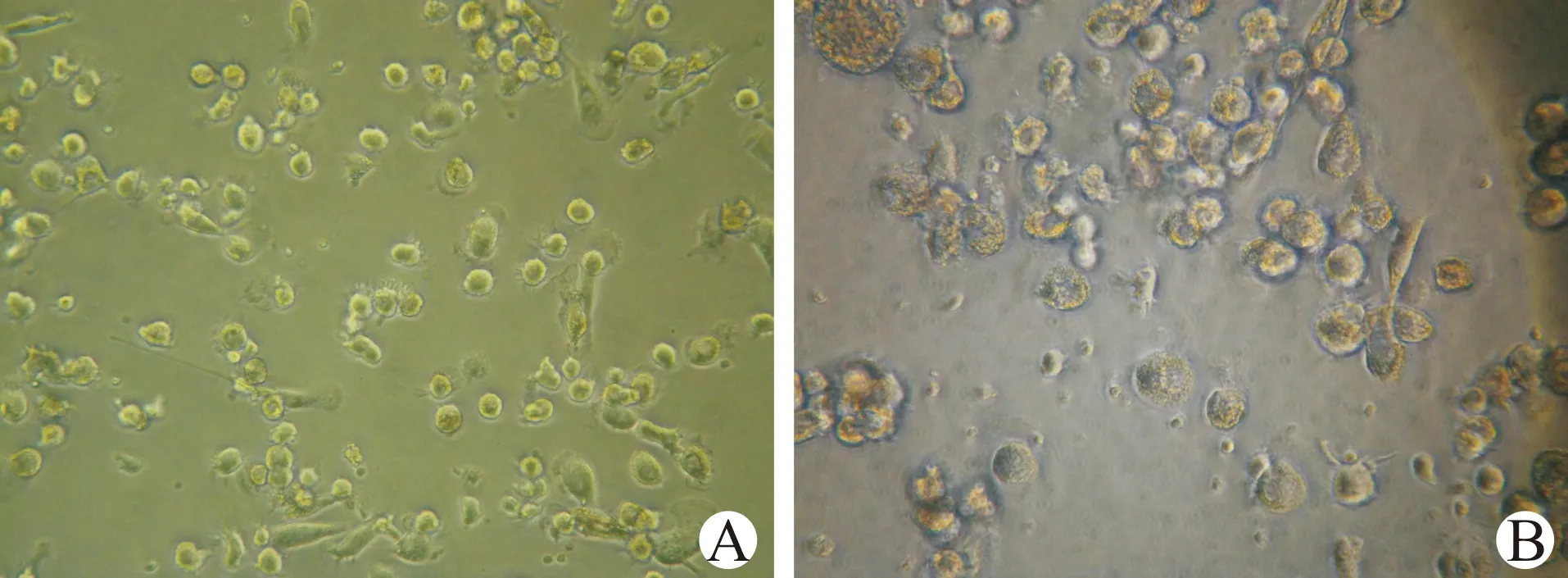
A(×200倍);B(×400倍)图2 扩增培养第6天DC形态
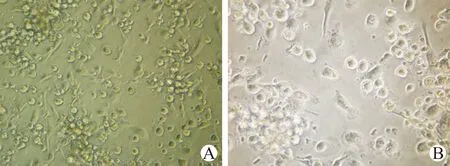
A(×200倍);B(×400倍)图3 扩增培养第9天DC形态
2.3 IL-6含量比较
CD34+细胞诱导成DC的过程中随着时间的推移各含药血清+细胞因子组、正常血清+细胞因子组及单纯细胞因子组中IL-6的水平都随着DC诱导成熟天数的增加而逐渐升高(P<0.05);在同一时间内各含药血清+细胞因子组IL-6浓度均较正常血清+细胞因子组、单纯细胞因子组升高(P<0.05)。在相同时间内各含药血清组中,加味青蒿鳖甲汤高剂量+细胞因子组与加味青蒿鳖甲汤中剂量+细胞因子组比较差异无统计学意义(P>0.05);与加味青蒿鳖甲汤低剂量+细胞因子组相比,加味青蒿鳖甲汤高剂量+细胞因子组、加味青蒿鳖甲汤中剂量+细胞因子组中IL-6浓度均明显升高(P<0.05);正常血清+细胞因子组、单纯细胞因子组之间比较,差异无统计学意义(P>0.05)。见表1。
表1 各组IL-6含量比较
2.4 DC表面分子表达比较
CD80、CD83、CD86、CD1a、HLA-DR表面分子在各含药血清+细胞因子组、正常血清+细胞因子组及单纯细胞因子组中均可表达,但CD80的表达差异无统计学意义(P>0.05);CD83、CD86、HLA-DR表达在各含药血清+细胞因子组中均较正常血清+细胞因子组、单纯细胞因子组高(P<0.05),而含药血清高、中、低剂量+细胞因子组之间比较,差异无统计学意义(P>0.05),正常血清+细胞因子组、单纯细胞因子组之间比较,差异亦无统计学意义(P>0.05);含药血清中剂量+细胞因子组与低剂量+细胞因子组中CD1a的表达较高剂量+细胞因子组、正常血清+细胞因子组、单纯细胞因子组高(P<0.05),而含药血清中剂量+细胞因子组与低剂量+细胞因子组之间比较,差异无统计学意义(P>0.05),含药血清高剂量+细胞因子组与正常血清+细胞因子组、单纯细胞因子组之间比较,差异亦无统计学意义(P>0.05)。见表2。
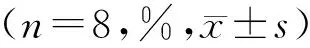
表2 各组DC表面分子表达比较
3 讨论
中医认为,AL的发生与机体正气虚弱、邪毒入血伤髓有关,正气虚弱是本病发生的内因;加之抗癌药物的攻伐使正气进一步受损,以致患者完全缓解后仍然正气不足。化疗是AML的主要治疗手段,但其对白血病细胞的杀灭呈对数级,并不可能彻底杀灭白血病细胞。而且由于血-脑、血-睾丸等屏障的存在,化疗药物难以到达脑、睾丸等部位,所以脑、睾丸等部位可能残留有白血病细胞;这些残留的白血病细胞是导致AL复发的主要原因。化疗药物在有效杀伤白血病细胞的同时也强烈抑制机体的免疫功能,因此AL患者存在着免疫功能紊乱。化疗后患者机体免疫功能进一步下降,使正常的免疫监视功能遭到破坏,残存在血液、骨髓、脑膜、睾丸等部位的少量白血病细胞容易引起AL复发;中医认为这些病位属于至阴之分,因此可以认为,AL完全缓解后的基本病机特点是“正气虚弱,余毒伏阴”。针对这一病机特点,既要扶助正气,也需祛除余毒。同时,由于余毒深伏阴分,尚需将阴分余毒透出阳分以清解。因此,扶正透毒祛毒之法切合AL完全缓解后的病机特点。
本研究选用“入阴透邪”经典方青蒿鳖甲汤,将伏于阴分的毒邪透出阳分而祛除。《温病条辨》指出:“邪气深伏阴分,混处气血之中,不能纯用养阴,又非壮火,更不得任用苦燥。故以鳖甲蠕动之物,入肝经至阴之分,既能养阴,又能入络搜邪;以青蒿芳香透络,从少阳领邪外出”,该方以青蒿、鳖甲为君,生地、知母为臣并佐以丹皮而成。在透除毒邪的同时加用扶正祛毒药物,以恢复机体正气、抵御外邪,并将透出的毒邪祛除而达到“正足邪自祛、邪祛正自安”。扶正药物选用党参、黄芪、白术、茯苓、女贞子、旱莲草,具有益气健脾、滋补肝肾之功效,可使气血得补,正气存内而邪不可干,从而增强机体的抵抗力。祛毒药物选用祛毒解毒抗癌的半枝莲、大青叶、白花蛇舌草、重楼,主要针对缓解期残留的余毒及化疗药物攻伐之毒。青蒿鳖甲汤与扶正祛毒药物合用可使透邪与养阴并存,扶正与祛邪并进,能使脏腑功能得以调整、正气得以恢复、余毒得以清除,从而提高机体免疫力,恢复患者正常的免疫功能。
DC作为特异性免疫应答的始动者,其可提呈大量抗原肽/MHCⅠ类分子复合物、抗原肽/MHCⅡ类分子复合物,并能高表达CD80、CD86等共刺激分子及某些黏附分子;DC能在这些分子信号作用下使T细胞活化、增殖并发挥其功能。DC在人体内分布广泛,除脑以外的全身各个脏器均有分布,但其数量极少。AML-CR患者因为白血病细胞的浸润以及化疗的损伤等多种因素导致免疫功能减弱,包括DC数量的减少、功能的减退。加之白血病细胞的肿瘤免疫原性减弱或抗原调变而出现免疫抑制,使得残留于患者体内的白血病细胞难以清除。因此如何增加并完善白血病患者体内的DC数量及功能,使其有效提呈肿瘤抗原,从而发挥免疫监视作用对于改善AML-CR的预后具有重要意义。
本研究结果显示,随着DC诱导时间的进展,在倒置显微镜下发现细胞表面逐渐变得毛糙、不规则,并聚集增多,第9天左右时可呈现成熟的DC形态,即细胞表面如树突状;为更好地了解DC的成熟情况,通过流式细胞术对DC的表面抗原CD80、CD83、CD86、CD1a、HLA-DR进行检测,结果显示:各组含药血清+细胞因子组均能高表达CD83、CD86、HLA-DR,但CD80的表达差异无统计学意义;CD1a在含药血清中剂量组与低剂量组中的表达明显高于高剂量组、正常血清+细胞因子组及单纯细胞因子组。高剂量组CD1a的表达明显低于中、低剂量组可能与CD1a对中药复方有较低的浓度依赖有关,抑或与样本量较少有一定的关系。含药血清组与正常血清+细胞因子组、单纯细胞因子组相比能更好地诱导DC成熟,考虑与含药血清的有效成分能调节机体内环境,从而改变DC所处微环境中的相关细胞因子含量有关。以上提示加味青蒿鳖甲汤能促进AML-CR患者CD34+细胞向DC转化。
细胞因子具有广泛的生物学活性,在机体的自稳、防卫和免疫调控等方面扮演着重要角色。细胞因子网络失衡会使机体内环境发生紊乱,影响DC的分化成熟,从而不能有效地发挥抗原提呈功能,使得肿瘤细胞逃避免疫监视,并导致肿瘤的发生及发展。成熟的DC能分泌IL-1、IL-6、IL-12、TNF-α、IFN-α等细胞因子及多种趋化因子。IL-6作为众多细胞因子中的一员,能促进细胞增殖、分化。在诱导DC的第0、6、9天通过ELISA法对IL-6的含量进行检测发现,IL-6的含量随着时间的递增而逐渐增多,各含药血清组均较对照组明显升高,表明加味青蒿鳖甲汤含药血清在诱导CD34+源DC成熟过程中可能促进了DC分泌IL-6。其机制可能是加味青蒿鳖甲汤能直接调节机体内环境,改善细胞因子网络失衡状态,从而促进DC分泌IL-6。有研究[4]发现IL-6能让单核细胞来源的DC上MHC-Ⅱ类分子及CD86的表达明显提高。Saijo Y等[5]发现IL-6能刺激肿瘤细胞表达抗原,并且能诱导DC分化,刺激细胞毒性T淋巴细胞增殖而杀伤肿瘤细胞。故推测加味青蒿鳖甲汤含药血清在诱导CD34+源DC成熟过程中分泌IL-6的同时,IL-6又能以正反馈的方式促进DC的分化成熟。研究证实IL-6有广泛的生物学作用,其能加强B细胞的增殖、分化,并可分泌抗体,参与炎症反应及抗瘤效应,并能增强细胞毒性T细胞及自然杀伤细胞的抗肿瘤活性。前期实验发现该方含药血清对K562细胞的杀伤作用较细胞因子组大,并能更好地促进DC提呈抗原,更明显地刺激细胞毒性T细胞活化、增殖,并高效、特异地杀伤靶细胞[6]。加味青蒿鳖甲汤刺激细胞毒性T细胞活化、增殖及对靶细胞的特异性杀伤,是否通过增加IL-6的含量而发挥其作用是值得进一步思考的问题。

