蚌埠地区3408例女性宫颈HPV感染状况及基因亚型分布
王中安 郭清江 乔林爽 郭鹏飞
宫颈癌是女性好发恶性肿瘤之一,发病率及病死率分列女性肿瘤第二位,是当今女性健康的重大威胁[1⁃2]。研究表明,宫颈癌的发生与发展和人乳头瘤病毒(human papillomavirus,HPV)的持续感染密切相关,且因所感染HPV 基因亚型的不同而存在一定差异[3]。近年来随着HPV⁃DNA 分型检测的逐渐普及,越来越多的研究表明,女性HPV感染率及亚型分布情况因经济水平和生活方式的不同而呈现出区域性差异的特征[4],因此进行区域性女性HPV 感染情况研究,对于该地区宫颈癌的早期筛查及疫苗接种具有十分重要的指导意义[5⁃6]。本研究对蚌埠地区女性宫颈HPV 感染状况及亚型分布情况进行分析,以期了解该地区HPV 感染状况及亚型分布特征,为该地区疫苗接种、宫颈癌早期防治提供数据参考。
1 材料与方法
1.1 一般资料
选取2016年7月1日至2019年12月31日在蚌埠市第一人民医院及周边社区医院进行HPV检测的门诊、住院患者及健康体检女性,去除重复患者仅统计初次检测结果,共计3 408 例,年龄17~80 岁,将受检者年龄分为17~岁、20~岁、30~岁、40~岁、50~岁、≥60 岁共6 个年龄段,平均年龄(38.8±9.1)岁。纳入标准:提前告知检测项目并自愿参检;有既往性生活史;非月经期间;非妊娠期间。排除标准:无既往性生活史;采样检测时处于月经或妊娠期间;有既往子宫切除史。本研究经医院医学伦理委员会批准。
1.2 仪器与试剂
ABI 7500 Real Time PCR 仪购自美国Thermo Fisher 公司,HybriMax 医用核酸分子快速杂交仪、HPV21 种分型检测试剂盒(PCR⁃膜杂交法)(包含HPV⁃DNA 提取试剂、PCR 反应试剂、核酸杂交试剂)以及配套的样本采集器均购自潮州凯普生物化学有限公司。
1.3 方法
1.3.1 样本采集
使用棉拭子将宫颈口分泌物擦拭干净,将宫颈脱落细胞采取器的刷头置于宫颈口,顺时针旋转5 周,取出宫颈刷,将其头部放入标有病人编号的取样管中,拧紧瓶盖迅速送检。
1.3.2 HPV⁃DNA 的提取
充分洗脱宫颈刷,取500 μL 洗脱液14 000 r/min 离心1 min 收集沉淀,加入400 μL 裂解液混匀后100℃加热15 min,然后再加入400 μL 异丙醇混匀,14 000 r/min 离心5 min 收集沉淀,加入60 μL灭菌注射用水备用。1.3.3 PCR 扩增
反应条件如下:95℃9 min;95℃20 s,55℃30 s,72℃30 s,共40 个循环;72℃5 min。
1.3.4 膜杂交反应
利用HybriMax 医用核酸分子快速杂交仪和凯普核酸杂交试剂盒,按照预杂交、杂交、封闭、酶标、显色的步骤,对PCR 扩增产物进行分型检测,每批实验均设有阴、阳性对照,每个样本检测单元均设有生物素(Biotin)和内参(IC)对照。该试剂盒共可检测21 种HPV 基因亚型,包括15 种高 危亚型:HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV53、HPV56、HPV58、HPV59、HPV66、HPV68;6 种低危亚型:HPV6、HPV11、HPV42、HPV43、HPV44、HPVCP8304。
1.4 统计学处理
采用SPSS 19.0 软件进行统计分析,计数资料以率n(%)表示,采用χ2检验,以χ2<0.05 为差异有统计学意义。
2 结果
2.1 PCR⁃膜杂交法实验结果
HPV⁃DNA 扩增产物经过膜杂交实验后,结果符合试剂盒判定标准,实验对照及阴、阳性标本均有检出。如图1所示,A、B、C、D 四个实验结果分别提示样本为阴性、单一感染、双重感染和三重感染。

图1 HPV⁃DNA 膜杂交实验结果Figure 1 Results of HPV⁃DNA membrane hybridization
2.2 HPV 感染检出情况
3 408 例样本中,共检测出HPV 感染阳性患者810 例,总检出率为23.77%(810/3 408),2016-2019四年中检出率呈现小幅上升趋势。见表1。
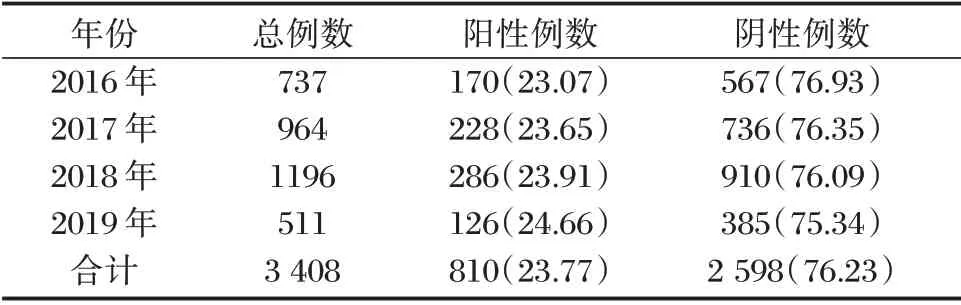
表1 2016-2019年蚌埠地区HPV 检出率[n(%)]Table 1 Detection rate of HPV in Bengbu area from 2016 to 2019[n(%)]
2.3 HPV 感染模式检出情况
对810 例HPV 感染阳性患者的感染模式分析后发现,单一感染模式人数最多,主要亚型为HPV16 型。多重感染模式中,以二重感染人数居首,主要亚型组合为HPV16 型+HPV52 型。多重感染模式中最多检出8 种亚型同时感染。见表2。
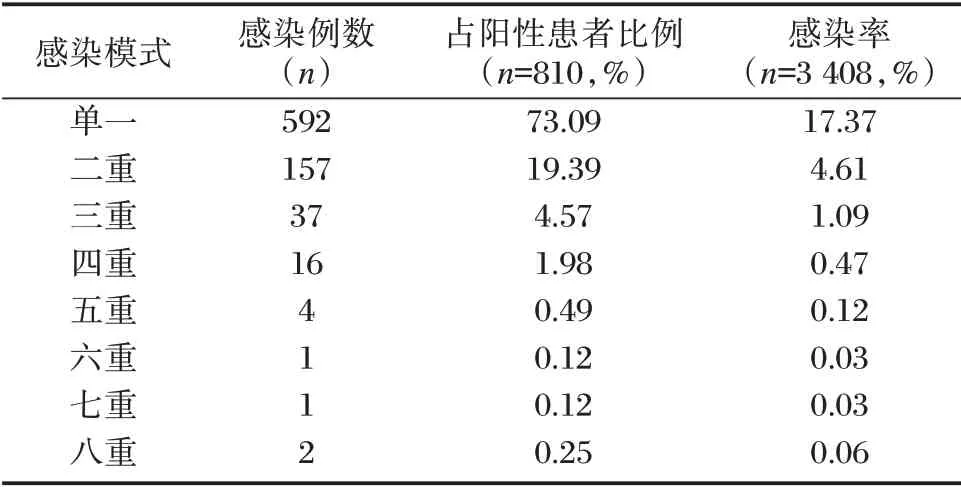
表2 蚌埠地区HPV 感染模式检出情况Table 2 Detection of HPV infection mode in Bengbu area
2.4 不同年龄段HPV 感染分布情况
各年龄段分组中,30~岁年龄段参检人数最多,但感染率却为所有年龄段最低,为22.38%(254/1 135);17~岁年龄段参检人数最少,但感染率居首,为44.44%(12/27)。各年龄段间HPV 感染率比较差异具有统计学意义(χ2=1.712,P<0.05)。见表3。

表3 蚌埠地区不同年龄段HPV 检出情况[n(%)]Table 3 Detection of HPV in different age groups in Bengbu area[n(%)]
2.5 HPV 感染患者中基因亚型分布情况
该款分型试剂盒所能检测的21 种HPV 基因亚型在本次研究中均有检出,共检出各种亚型1 130 次,其中高危型占85.31%(964/1 130),低危型占14.69%(166/1 130)。高危型中HPV16(4.67%)、HPV52(3.55%)、HPV58(2.88%)位列前三,低危型中HPV6(1.41%)、HPV11(1.32%)、HPVCP8304(1.17%)位列前三。在所有21 种亚型中,检出率最高的为HPV16,最低的为HPV43。见表4。
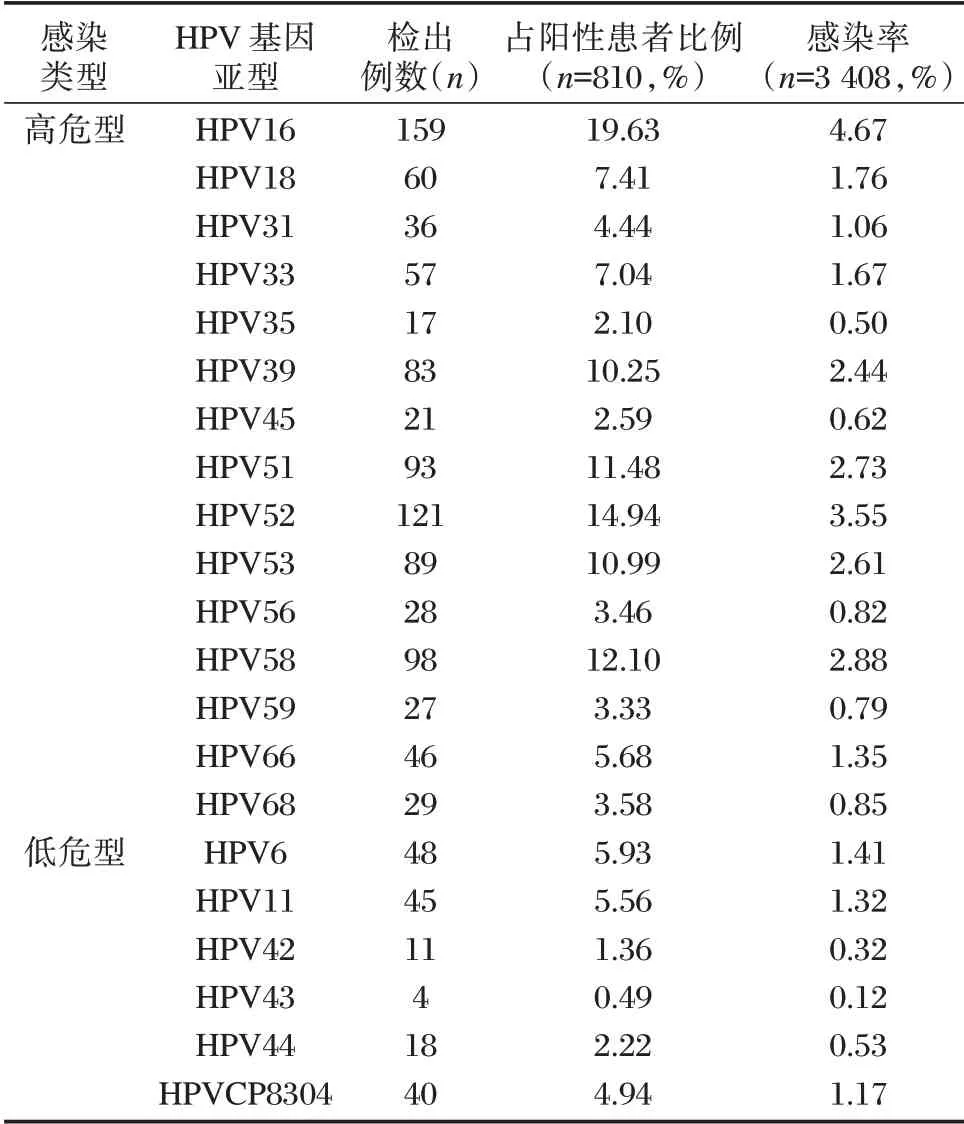
表4 蚌埠地区HPV 感染患者亚型分布检出情况Table 4 Detection of HPV gene subtypes distribution in Bengbu area
3 讨论
人乳头瘤病毒属于乳多空病毒科的乳头瘤空泡病毒A 属,是一种球形DNA 病毒,能引起人体皮肤黏膜的鳞状上皮增殖,目前已分离出130 多种,不同的型别可引起不同的临床表现[1]。HPV感染所诱发的女性宫颈癌变,发病率和致死率均位列目前女性肿瘤疾病的前列,成为危害女性健康和生命的重大威胁,近年来越来越引起临床医疗的高度关注[3]。不同的区域、种族以及不同年龄段的女性感染的HPV 亚型分布及各种亚型的感染率是有差异性的[7⁃12]。本研究对蚌埠地区2016-2019年的HPV 感染情况分析后发现,四年间HPV 感染率均维持在24%上下,整体呈现一种缓慢上升趋势,需要引起该地区卫生防疫系统的重视。
本研究在蚌埠地区选取检测的3408 例标本中,共检测出HPV 感染阳性患者810 例,总检出率为23.77%,与罗仲秋等[4]报道的成都地区HPV 感染率(23.28%)基本相同,高于吴丹丹等[8]报道的合肥地区HPV 感染率(15.52%),但低于张亚丽等[9]报道的郑州地区HPV 感染率(33.38%)。不同地区报道的样本中感染率的差异可能与地理位置、经济水平、筛查技术以及取样手段有关。本地区检测方法不同于发达地区的自动化平台,目前手工化程度较高,民众对于HPV 的知晓度和关注度也较低,生活习惯亦与其他地区存在一定差异,这些原因均可引起疾病检出率的不同。
本研究中所用分型试剂盒所能检测的21 种HPV 基因亚型在蚌埠地区均有检出,亚型分布丰富且以高危险为主。其中位列前三位的高危亚型与吴丹丹等[8]报道的合肥地区检出情况相同,均为HPV16、HPV52、HPV58 型。单个亚型感染率最高的为HPV16 型,感染率为4.67%,应当引起足够的重视,同为高致癌率基因亚型的HPV18 型感染率相对较低,为1.76%。虽然不同地区感染的顺序有些许差别,但各地区的高危亚型的总体分布趋于一致,均为HPV52、HPV16、HPV58 型,符合我国的分布特点[13⁃15]。不过蚌埠地区目前主要提供针对16 和18 亚型的二价疫苗接种服务,尚不能满足民众需求。
蚌埠地区不同年龄段直接HPV 检出率存在一定差异。其中20 岁以下年龄段检出率较高,可能与健康意识薄弱、年轻女性宫颈发育不成熟、免疫系统未被致敏,易受HPV 感染有关等因素相关[11]。30~49 岁年龄段检出率较低,可能因性伴侣较为固定,对于健康问题较为重视,并有一定的经济能力及时应对,HPV 感染率较其他年龄组低[10]。50~岁年龄段和>60 岁年龄段的患者感染率较高,可能与绝经后雌激素下降、阴道皱襞消失、自身清除病毒能力降低等原因关系密切。胥莎莎等[14]研究发现HPV 感染患者的病毒清除速率与年龄呈负相关,50 岁以上年龄段女性的病毒清除时间显著长于年轻女性,与本研究结果相符,而且清除较慢的多为高危亚型,需要引起高龄女性的重视[15]。
综上所述,本研究为蚌埠地区女性后续HPV感染的诊断与治疗、HPV 接种以及为临床宫颈癌的防治工作提供了重要的参考依据。建议将HPV分型检测纳入到该地区妇女宫颈疾病普查项目,做到早筛查、早诊断、早干预、早治疗,从而降低本地区女性宫颈癌的发病率。

