仙鹤草不同提取部位抗肝纤维化作用的研究
李麟 饶春燕 雷青松 黄祎 刘华宝 张长江


中圖分类号 R285.5 文献标志码 A 文章编号 1001-0408(2022)03-0313-06
DOI 10.6039/j.issn.1001-0408.2022.03.10
摘 要 目的 研究仙鹤草不同提取部位的抗肝纤维化作用。方法 以大鼠肝星状细胞HSC-T6为研究对象,检测不同质量浓度(0.5、5、50、500、5 000 μg/mL,均以生药量计)的仙鹤草不同提取部位(总提取物、乙酸乙酯部位、石油醚部位和正丁醇部位)对该细胞增殖的影响(作用24、48、72 h后),并计算半数抑制浓度(IC50)。采用血小板衍生生长因子(PDGF-BB)刺激HSC-T6细胞以复制肝纤维化细胞模型,采用流式细胞仪检测仙鹤草不同提取部位对HSC-T6细胞凋亡的影响,采用酶联免疫吸附试验检测细胞培养上清液中Ⅰ型胶原蛋白(Col-Ⅰ)表达水平,采用Western blot法检测细胞中α-平滑肌肌动蛋白(α-SMA)、Col-Ⅰ、B细胞淋巴瘤2(Bcl-2)、Bcl-2相关X蛋白(Bax)、胱天蛋白酶3(caspase-3)的表达水平。结果 仙鹤草总提取物、乙酸乙酯部位、石油醚部位和正丁醇部位均可显著升高HSC-T6细胞凋亡率(P<0.01);作用24 h时,上述各部位的IC50分别为50.17、20.75、5.82、4.09 μg/mL。经PDGF-BB干预后,HSC-T6细胞培养上清液中Col-Ⅰ和细胞中Col-Ⅰ、α-SMA、Bcl-2、Bax、caspase-3蛋白表达水平均显著升高(P<0.01);经仙鹤草不同提取部位干预后,HSC-T6细胞培养上清液或细胞中上述蛋白表达水平大部分均较PDGF-BB组显著逆转(P<0.05或P<0.01),其中仙鹤草正丁醇部位干预作用最为显著。结论 仙鹤草不同提取部位均可抑制HSC-T6细胞增殖,并诱导其凋亡;正丁醇部位可能是仙鹤草发挥抗肝纤维化作用的有效部位。
关键词 仙鹤草;肝纤维化;细胞凋亡;有效部位
Study on the different extraction fractions of Agrimonia pilosa against hepatic fibrosis
LI Lin1,RAO Chunyan1,LEI Qingsong2,HUANG Yi1,LIU Huabao1,ZHANG Changjiang1(1. Dept. of Hepatic Diseases, Chongqing Traditional Chinese Medicine Hospital, Chongqing 400021, China; 2. Oncology Radiotherapy Center, Chongqing University Cancer Hospital, Chongqing 400030, China)
ABSTRACT OBJECTIVE To study different extraction fractions of Agrimonia pilosa against hepatic fibrosis. METHODS Using hepatic stellate cells HSC-T6 of rats as objects, the effects of different extraction fractions (total extract, ethyl acetate fraction, petroleum ether fraction and n-butanol fraction) with different concentrations (0.5, 5, 50, 500, 5 000 μg/mL, calculated by raw drug) of A. pilosa on the proliferation of HSC-T6 cells were detected (after treated for 24, 48, 72 h); median inhibition concentration (IC50) was also caculated. Platelet-derived growth factor (PDGF-BB) was used to induce the activation of HSC-T6 cells to establish hepatic fibrosis cell model. Flow cytometry was used to detect the effects of different extraction fractions of A. pilosa on apoptosis of HSC-T6 cells. The expression of collagen Ⅰ (Col-Ⅰ) in the supernatant was detected by enzyme linked immunosorbent assay. The expressions of α-smooth muscle actin (α-SMA), Col-Ⅰ, B-cell lymphoma-2 (Bcl-2), Bcl-2-associated X protein (Bax) and caspase-3 were detected by Western blot assay. RESULTS Total extract, ethyl acetate fraction, petroleum ether fraction and n-butanol fraction of A. pilosa could significantly increase the apoptotic rate of HSC-T6 cells (P<0.01). After treated for 24 h, IC50 of above fractions were 50.17, 20.75, 5.82, 4.09 μg/mL, respectively. After intervened with PDGF-BB, the expression of Col-Ⅰ in supernatant of HSC-T6 cells as well as protein expression of Col-Ⅰ, α-SMA, Bcl-2, Bax and caspase-3 in HSC-T6 cells were increased significantly (P<0.01). After intervened with different extraction fractions of A. pilosa, most of the expressions of above proteins in HSC-T6 cell culture supernatant or cells were significantly reversed compared with PDGF-BB group (P<0.05 or P<0.01), and the intervention effect of n-butanol fraction of A. pilosa was the most significant. CONCLUSIONS Different extraction fractions of A. pilosa can inhibite the proliferation of HSC-T6 cells and induce their apoptosis; n-butanol fraction from A. pilosa may be an effective fraction to exert the effect of anti-hepatic fibrosis.
KEYWORDS Agrimonia pilosa; hepatic fibrosis; cell apoptosis; effective fraction
肝纤维化是指由各种致病因子所致肝内结缔组织异常增生,导致肝内弥漫性细胞外基质过度沉淀的病理过程,表现为肝功能减退、门静脉高压等,可导致肝硬化、肝癌等严重后果[1]。目前,肝纤维化的治疗策略主要是抗病毒,但存在一定局限性,不能完全抑制肝纤维化的形成和进展,临床上仍缺乏针对纤维组织增生和降解的治疗措施[2]。因此,开发能够阻止甚至逆转肝纤维化的藥物对治疗慢性肝病、防治肝硬化具有重要意义。
仙鹤草为蔷薇科多年生草本植物龙芽草Agrimonia pilosa Ledeb.的全草,又名脱力草、龙牙草、马鞭草、石打穿等,最早见于《淮南草本》。仙鹤草味苦、涩、平,归肺、肝、脾经,主要用于治疗各种出血证、痢疾、虚痨等病[3]。仙鹤草的主要成分有酚类、黄酮类、多糖类、三萜类、鞣质以及微量元素等[4]。现代药理学研究表明,仙鹤草具有抑制细胞增殖、诱导细胞凋亡、抗氧化的活性[5-7]。本课题组前期通过临床观察及实验研究发现,仙鹤草具有减轻肝纤维化的作用,但具体药效成分以及作用机制尚不明确。基于此,本研究拟探讨仙鹤草不同极性部位对大鼠肝星状细胞(hepatic stellate cell,HSCs)增殖及凋亡的影响,以期为仙鹤草抗肝纤维化的药效成分开发提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有Vortex-5型涡旋振荡仪(海门市其林贝尔仪器制造有限公司),CCT-3320A型超纯水机(重庆力德高端水处理设备研发有限公司),YP202N型电子天平(上海舜宇恒平科学仪器有限公司),HH-601型恒温水浴箱(江苏金坛市华欧实验仪器厂),MCO-15AC-SC型二氧化碳培养箱(日本Sanyo公司),Mini-PROTEAN Tetra 1658001型垂直电泳装置、CFX96型凝胶成像系统(美国Bio-Rad公司),TS-2000A型脱色摇床(海门市麒麟医用仪器厂),ELX800型酶标仪(美国Bio-Tek公司),TG16-WS型高速台式离心机(湖南湘仪实验室仪器开发有限公司),DW-86L388J型 -80 ℃超低温冰箱(海尔生物医疗股份有限公司)。
1.2 主要药品与试剂
仙鹤草(批号210300451)购自康美药业股份有限公司,由重庆市中医院药剂科王琴主任中药师鉴定为龙牙草A. pilosa Ledeb.的干燥地上部分。DMEM培养基(批号SH30809.01)购自美国HyClone公司;优级胎牛血清(批号st30-3302p)购自德国PAN Biotech公司;蛋白提取试剂盒(批号p0013B)、二甲基亚砜(DMSO,批号ST038)购自上海碧云天生物技术有限公司;兔抗鼠α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)单克隆抗体、兔抗鼠B细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)单克隆抗体、兔抗鼠Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)单克隆抗体、兔抗鼠胱天蛋白酶3(caspase-3)单克隆抗体、兔抗鼠β-肌动蛋白(β-actin)单克隆抗体(批号分别为19245T、3498、2772T、14220T、3700S)均购自美国Cell Signaling公司;兔抗鼠Ⅰ型胶原蛋白(collagen Ⅰ,Col-Ⅰ)多克隆抗体(批号bs-7158R)购自北京博奥森生物技术有限公司;辣根过氧化物酶标记的山羊抗兔免疫球蛋白G二抗(批号70-GRT007)购自杭州联科生物技术股份有限公司;ECL发光试剂盒(批号SB-WB012)购自上海圣尔生物科技有限公司;Col-Ⅰ酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(批号xl-Eh0746)购自北京丽科创欣生物科技有限公司;CCK8试剂盒(批号CK04)购自日本Dojindo公司;Annexin Ⅴ-PE/7-AAD流式试剂盒(批号WE0328)购自北京百奥莱博科技有限公司;血小板衍生生长因子BB(platelet derived growth factor BB,PDGF-BB,批号315-18)购自美国PeproTech公司;其余试剂为实验室常用规格,水为纯净水。
1.3 细胞
本研究所用大鼠肝星状细胞HSC-T6由重庆医科大学附属第二医院病毒性肝炎研究所彭明利教授惠赠。
2 方法
2.1 细胞培养
将HSC-T6细胞培养于含10%胎牛血清和1%青霉素-链霉素双抗的DMEM培养基(以下简称“培养基”)中,置于37 ℃、5%CO2培养箱中培养,待细胞生长至对数期时,进行后续实验。
2.2 仙鹤草不同提取部位的制备
称取2.5 kg粉碎后的仙鹤草放入渗漉筒中,加入5倍量(L/kg)95%乙醇浸泡,使用脱脂棉进行过滤,重复操作3次;合并滤液,使用旋转蒸发仪减压回收乙醇,得到总粗提物126 g。取部分总粗提物以温水溶解使之充分混悬分散,然后依次以石油醚、乙酸乙酯和正丁醇分别萃取3~5次,合并各萃取液并分别减压浓缩、回收溶剂,得到石油醚部位2.031 g、乙酸乙酯部位1.895 g、正丁醇部位2.244 g。各萃取物以DMSO溶解备用。
2.3 HSC-T6细胞增殖活性的检测
采用CCK8法进行检测。取对数生长期的HSC-T6细胞(密度为2×104 mL-1)接种于96孔板中,然后分为对照组、仙鹤草总提取物不同浓度组、仙鹤草乙酸乙酯部位不同浓度组、仙鹤草石油醚部位不同浓度组、仙鹤草正丁醇部位不同浓度组。对照组加入培养基,各给药组加入相应含药培养基(药物质量浓度均分别为0.5、5、50、500、5 000 μg/mL,均以生药量计,根据本课题组前期预实验结果设置),另设不加药物和细胞的空白组,培养24、48、72 h后,每组取9孔细胞加入5 g/L CCK8溶液10 μL;继续培养4 h后弃去上清液,加入DMSO 100 μL,振荡10 min;采用酶标仪于450 nm波长下检测每孔光密度(optical density,OD)值,并计算细胞增殖抑制率和半数抑制浓度(half inhibitory concentration,IC50)。其中,细胞增殖抑制率=1-(给药组平均OD值-空白组平均OD值)/(对照组平均OD值-空白组平均OD值)×100%。
2.4 HSC-T6细胞凋亡的检测
采用流式细胞仪进行检测。取对数生长期的HSC-T6细胞(密度为5×104 mL-1)接种于6孔板中,然后分为对照组、PDGF-BB组、仙鹤草总提取物组(25.00 μg/mL,质量浓度根据“2.3”项下结果设置,其他部位给药组同法设置)、仙鹤草乙酸乙酯部位组(10.00 μg/mL)、仙鹤草石油醚部位组(3.00 μg/mL)、仙鹤草正丁醇部位组(2.00 μg/mL),每组设3个复孔。待细胞貼壁后,各组加入PDGF-BB(10 ng/mL)刺激细胞以复制肝纤维化细胞模型[8],培养1 h后,再加入相应药物,继续培养24 h后收集细胞,按照Annexin Ⅴ-PE/7-AAD流式试剂盒说明书方法操作,采用流式细胞仪检测细胞的凋亡情况。
2.5 HSC-T6细胞培养上清液中Col-Ⅰ表达水平的检测
采用ELISA法进行检测。取对数生长期的HSC-T6细胞(密度为5×104 mL-1)接种于6孔板中,按“2.4”项下方法分组与给药。培养结束后,收集各组细胞培养上清液,然后按照ELISA试剂盒说明书方法操作,采用酶标仪检测培养上清液中Col-Ⅰ的表达水平。
2.6 HSC-T6细胞中肝纤维化及凋亡相关蛋白表达水平的检测
采用Western blot法进行检测。取对数生长期的HSC-T6细胞(密度为2×105 mL-1)接种于培养瓶中,按“2.4”项下方法分组与给药。培养结束后,收集各组细胞的总蛋白;然后将总蛋白与上样缓冲液混匀、水浴加热5 min后,冷却备用。取变性后的蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、转膜,以1%脱脂牛奶封闭;加入α-SMA、Col-Ⅰ、Bcl-2、Bax、caspase-3一抗(稀释度均为1 ∶ 500)以及β-actin一抗(稀释度为1 ∶ 1 000),于4 ℃孵育过夜;以TBST缓冲液洗膜3次、每次5 min,然后加入相应二抗(稀释度为1 ∶ 1 000),于室温孵育60 min;经ECL化学发光试剂显色后,置于凝胶自动成像仪中显影,记录各条带灰度值。采用软件Image Lab 3.0进行分析,以目的蛋白与内参β-actin蛋白的灰度值比值表示目的蛋白表达水平。
2.7 统计学分析
采用GraphPad Prism 8.0.2统计软件处理数据,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 仙鹤草不同提取部位对HSC-T6细胞增殖的影响
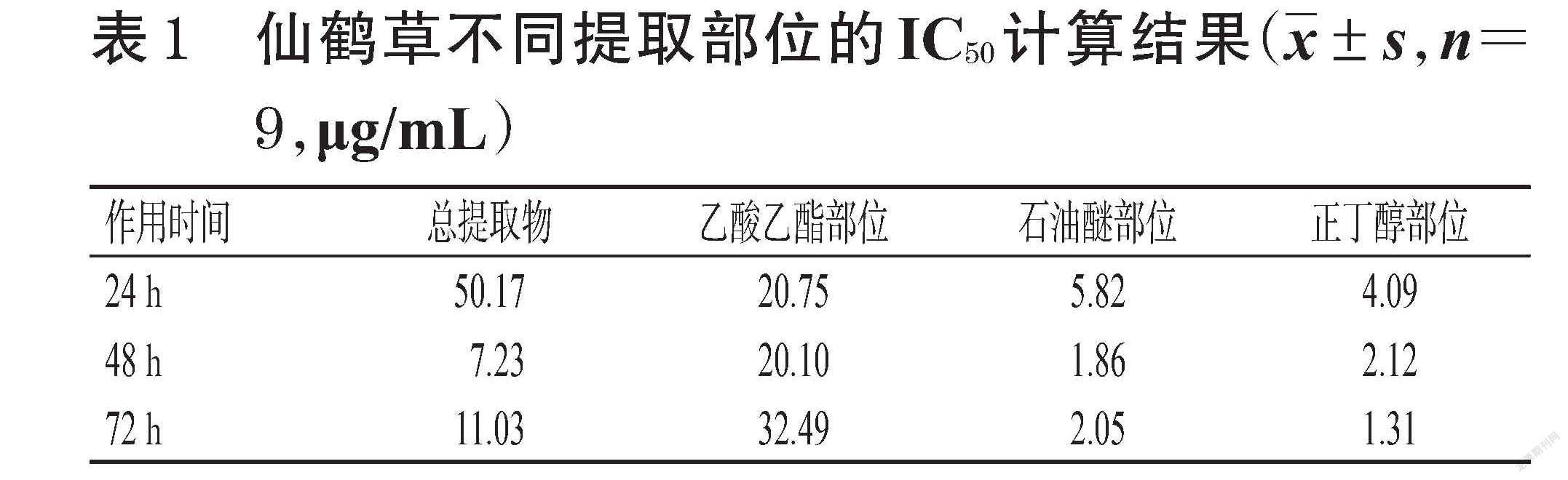
仙鹤草不同提取部位对HSC-T6细胞增殖均有不同程度的抑制作用,随着提取部位质量浓度和作用时间的增加,HSC-T6细胞增殖活性的受抑制作用越明显,详见图1。
给药作用24 h时,仙鹤草总提取物的IC50为50.17 μg/mL,乙酸乙酯部位的IC50为20.75 μg/mL,石油醚部位的IC50为5.82 μg/mL,正丁醇部位的IC50为4.09 μg/mL,详见表1。由此可知,仙鹤草正丁醇部位对HSC-T6细胞增殖的抑制作用最明显。基于此,选择各组药物约1/2倍 IC50作为后续实验浓度,即仙鹤草总提取物25.00 μg/mL、乙酸乙酯部位10.00 μg/mL、石油醚部位3.00 μg/mL、正丁醇部位2.00 μg/mL。
3.2 仙鹤草不同提取部位对HSC-T6细胞凋亡的影响
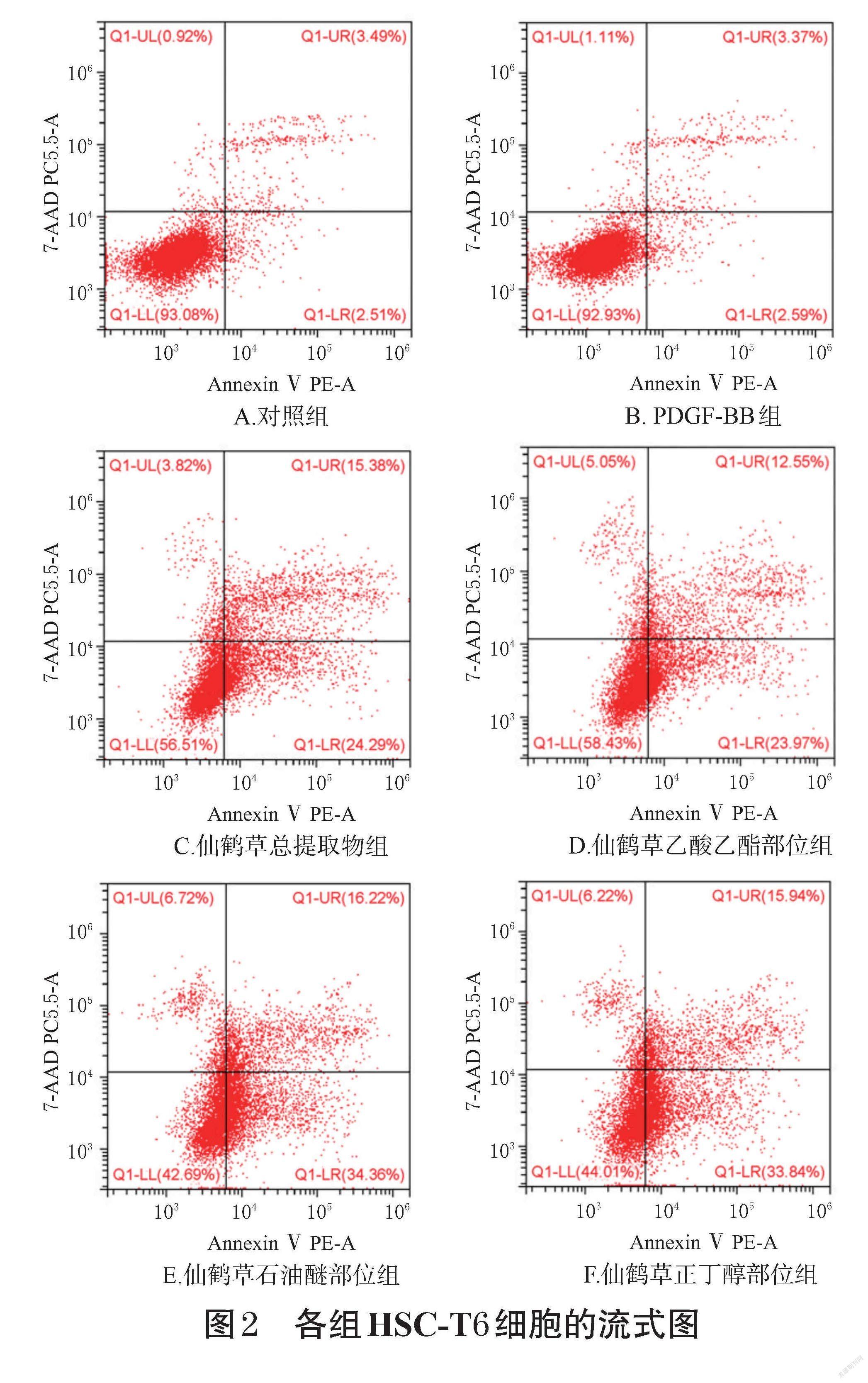
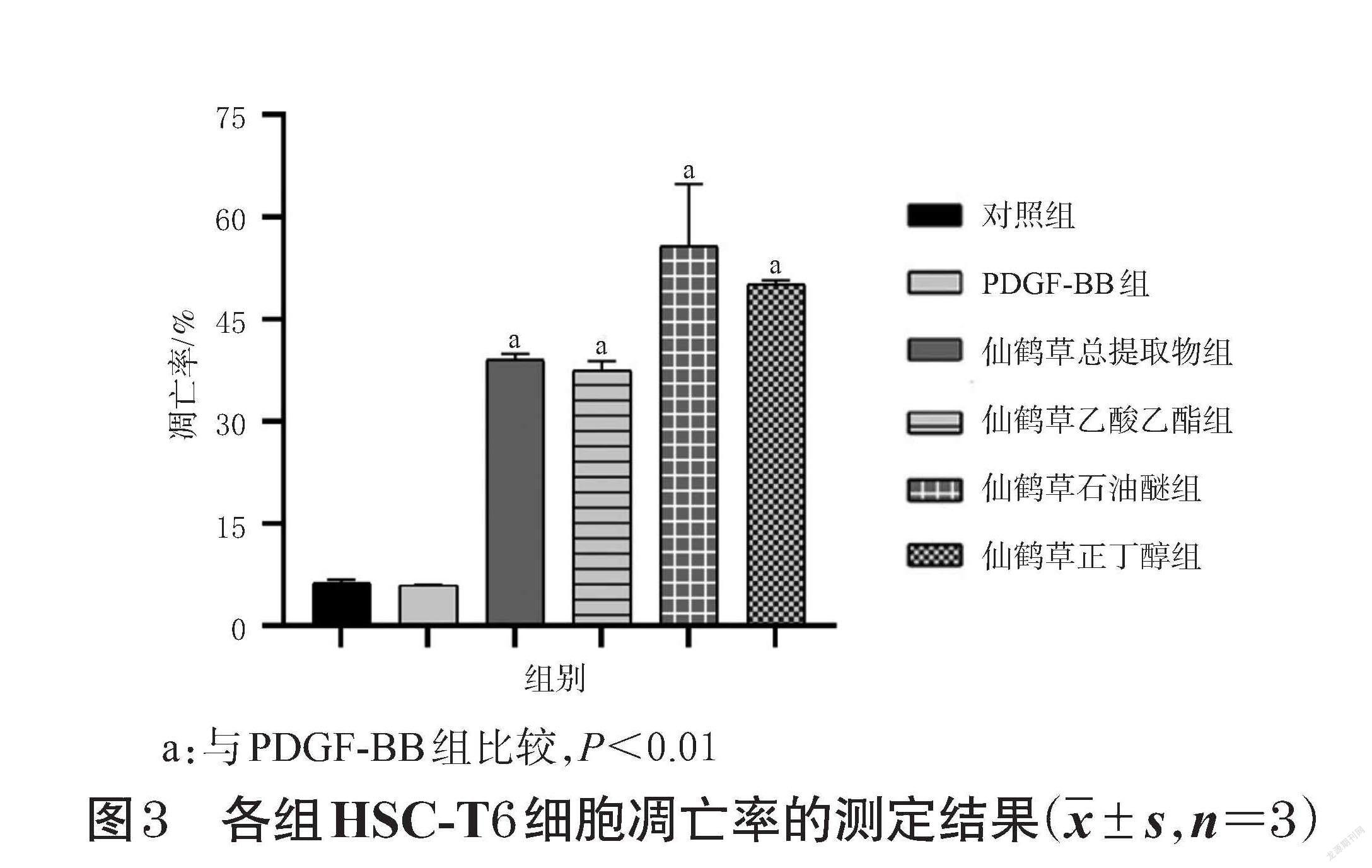
与对照组比较,PDGF-BB组HSC-T6细胞凋亡率差异无统计学意义;经仙鹤草不同提取部位干预后,HSC-T6细胞凋亡率均显著升高(P<0.01),各提取部位对细胞凋亡率影响大小顺序为石油醚部位>正丁醇部位>总提取物>乙酸乙酯部位。结果见图2、图3。由此可知,仙鹤草石油醚部位和正丁醇部位可能是其发挥抗肝纤维化作用的有效部位。
3.3 仙鹤草不同提取部位对HSC-T6细胞内Col-Ⅰ蛋白表达的影响
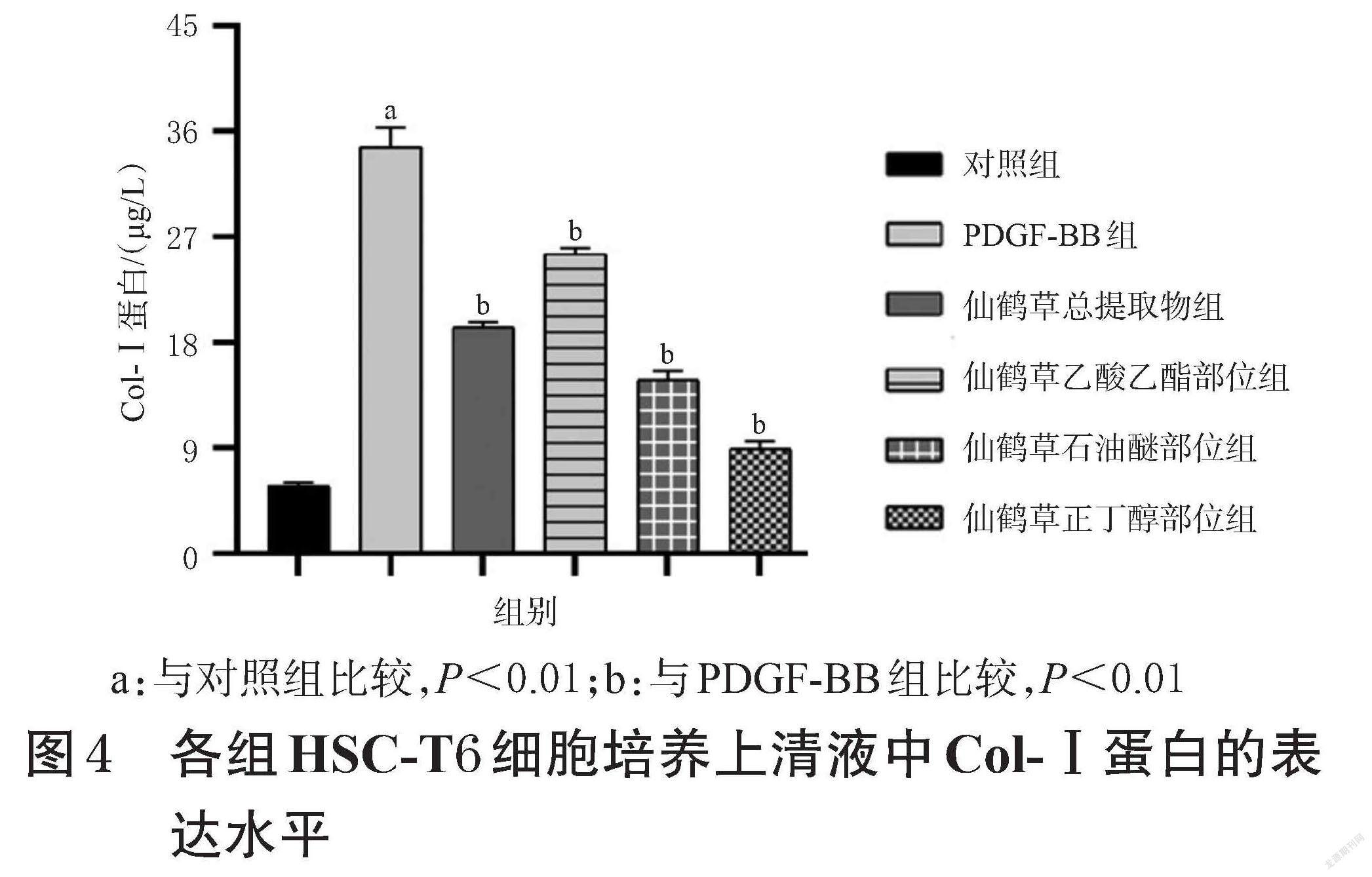
ELISA和Western blot检测结果显示,与对照组比较,PDGF-BB组HSC-T6细胞培养上清液中和细胞中Col-Ⅰ蛋白表达水平均显著升高(P<0.01);与PDGF-BB组比较,仙鹤草不同提取部位组HSC-T6细胞培养上清液中和细胞中Col-Ⅰ蛋白表达水平均显著降低(P<0.05或P<0.01)。结果见图4、图5。
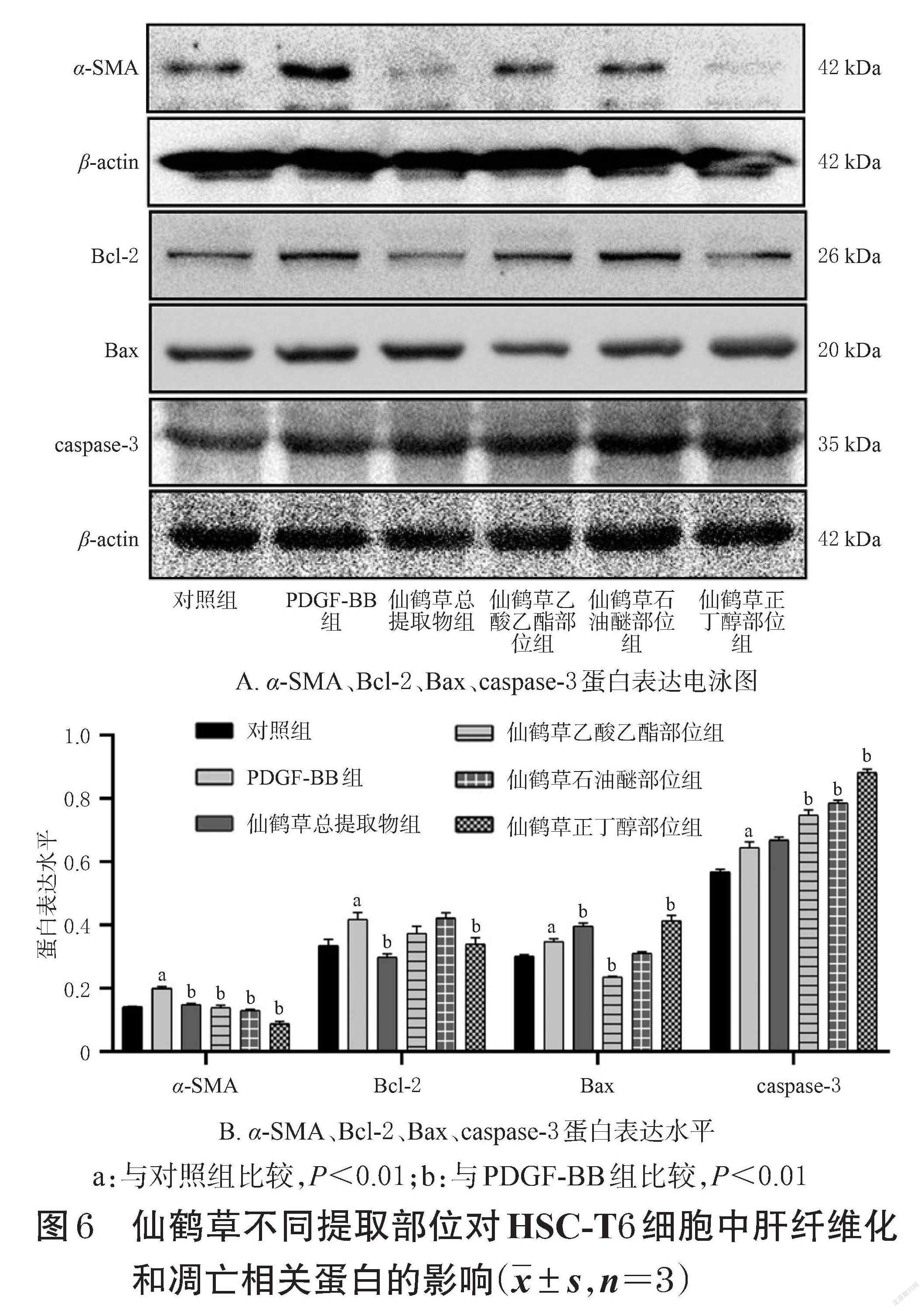
3.4 仙鹤草不同提取部位对HSC-T6细胞中肝纤维化和凋亡相关蛋白的影响
与对照组比较,PDGF-BB组HSC-T6细胞中α-SMA、Bcl-2、Bax、caspase-3蛋白的表达水平均显著升高(P<0.01);与PDGF-BB组比较,仙鹤草不同提取部位组HSC-T6细胞中上述蛋白表达水平大部分显著逆转(P<0.01)。其中,仙鹤草正丁醇部位的干预作用最为显著。结果见图6。
4 讨论
肝纤维化是多种慢性肝病过程中的主要病理变化,具有可逆性,但若刺激因素持续存在,则可进展至不可逆的肝硬化阶段,最终引起肝癌、肝衰竭等严重后果。肝纤维化的病理机制较复杂,单一靶点的药物无法干预或逆转肝纤维化进程,目前尚无有效药物[9]。而近年研究显示,中医药在改善肝纤维化症状、恢复肝功能、改善肝内血液循环,甚至逆转肝纤维化、调节免疫等方面具有明显的优势[10-11]。
HSCs活化是肝纤维化形成的关键环节,肝脏细胞受不同病因刺激发生炎症,肝内多种细胞可通过释放细胞因子活化HSCs,活化的HSCs又分泌大量细胞外基质,进而导致肝纤维化形成[12]。因此,开发能够抑制HSCs活化及增殖、促进HSCs凋亡的药物,是研究抗肝纤维化药物的重要思路。本研究表明,仙鹤草总提取物、乙酸乙酯部位、石油醚部位和正丁醇部位对HSC-T6细胞增殖均具有不同程度的抑制作用。这提示,仙鹤草中存在具有抑制HSC-T6细胞增殖的活性物质。
活化的HSCs能够分泌大量细胞外基质,如HSCs活化的标志性蛋白α-SMA、反映肝纤维化程度的蛋白Col-Ⅰ等,这些细胞外基质是纤维间隔形成的物质基础,参与炎症和肝纤维化过程,并且是导致血流动力学变化和门静脉压力升高的病理基础[13-14]。本研究表明,仙鹤草总提取物、乙酸乙酯部位、石油醚部位和正丁醇部位均可明显抑制HSC-T6细胞培养上清液和细胞中Col-Ⅰ的表达水平,以及细胞中α-SMA蛋白表达水平。这提示,仙鹤草不同提取部位可通过抑制HSC-T6细胞中肝纤维化相关蛋白的表达,来减少细胞外基质沉积。
相关研究发现,仙鹤草水提液可显著抑制人胰腺癌细胞增殖,且呈剂量依赖性和时间依赖性[15]。仙鹤草挥发性成分及主要单体成分棕榈酸、反式角鲨烯和α-亚麻酸等不仅可显著抑制人肝癌细胞HepG2的增殖,还可显著升高细胞的早期和晚期凋亡率[16]。仙鹤草中的异香豆素类成分仙鹤草内酯可通过抑制细胞周期进展、调控促凋亡蛋白Bax和抗凋亡蛋白Bcl-2的比例、活化促凋亡蛋白caspase-3等方式诱导胃癌细胞凋亡[17]。另有研究发现,从仙鹤草干燥部位中提取的均质多糖能抑制骨肉瘤细胞增殖,并可通过caspase-3依赖的线粒体途径诱导该细胞凋亡,且这种抑制作用呈剂量依赖性[18]。还有研究发现,仙鹤草水提物可抑制HepG2细胞增殖,且呈时间依赖性和剂量依赖性,这种抑制作用可能是通过上调线粒体凋亡通路中Bax、caspase-3蛋白表达来实现的[19-20]。本研究表明,仙鹤草总提取物、乙酸乙酯部位、石油醚部位和正丁醇部位均可显著诱导HSC-T6细胞凋亡,仙鹤草总提取物和正丁醇部位可显著抑制Bcl-2蛋白表达,仙鹤草总提取物和正丁醇部位可显著促进Bax蛋白表达,仙鹤草乙酸乙酯部位、石油醚部位和正丁醇部位可显著促进caspase-3蛋白的表达。这提示,仙鹤草正丁醇部位对HSC-T6细胞具有较强的促凋亡作用,可能是仙鹤草发挥抗肝纤维化作用的有效部位。
综上所述,仙鹤草总提取物、乙酸乙酯部位、石油醚部位和正丁醇部位均可抑制HSC-T6细胞增殖,并诱导其凋亡;正丁醇部位可能是仙鹤草发挥抗肝纤维化作用的有效部位。后续笔者将进一步明确仙鹤草抗肝纤维化的具体活性成分,以期为其抗肝纤维化的药效成分开发提供参考。
参考文献
[ 1 ] 中国中西医结合学会肝病专业委员会.肝纤维化中西医结合诊疗指南:2019年版[J].中华肝脏病杂志,2019,27(7):494-504.
[ 2 ] WEISKIRCHEN R,TACKE F. Liver fibrosis:from pathogenesis to novel therapies[J]. Dig Dis,2016,34(4):410- 422.
[ 3 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:106.
[ 4 ] 黄兴,王哲,王保和.仙鹤草药理作用及临床应用研究进展[J].山东中医杂志,2017,36(2):172-176.
[ 5 ] JANG H H,BAE J H,KIM M J,et al. Agrimonia pilosa ledeb. ameliorates hyperglycemia and hepatic steatosis in ovariectomized rats fed a high-fat diet[J]. Nutrients,2020,12(6):1631.
[ 6 ] KIM D S,PARK K E,KWAK Y J,et al. Agrimonia pilosa ledeb root extract:anti-inflammatory activities of the medicinal herb in LPS-induced inflammation[J]. Am J Chin Med,2020,48(8):1875-1893.
[ 7 ] HUANG W,JIN S Y,YANG W B,et al. Agrimonia pilosa polysaccharide and its sulfate derives facilitate cell proli- feration and osteogenic differentiation of MC3T3-E1 cells by targeting miR-107[J]. Int J Biol Macromol,2020,157:616-625.
[ 8 ] 童朝刚,朱月琴,王亚男,等. Psalmotoxin-1抑制活化的肝星状细胞过程中microRNA差异表达谱的变化分析[J].南京医科大学学报(自然科学版),2019,39(4):513-519.
[ 9 ] 刘如玉,路遥,申戈,等. HBeAg阴性初治慢乙肝患者恩替卡韦4年抗病毒治疗FIB-4评分动态变化研究[J].中华实验和临床病毒学杂志,2020,34(1):51-56.
[10] 王伟,陈翰翰,王凯.中医药治疗肝纤维化研究进展[J].河南中医,2021,41(1):137-140.
[11] 吴晓明,何强,尤圣杰,等.中药复方抗肝纤维化作用机制研究概述[J].北京中医药,2021,40(6):675-680.
[12] 陶山,李倩,陈阳,等.肝巨噬细胞与肝星状细胞交互作用对肝纤维化发生与逆转的影响[J].生命科學,2021,33(3):363-373.
[13] IWAKIRI Y,TREBICKA J. Portal hypertension in cirrhosis:pathophysiological mechanisms and therapy[J]. JHEP Rep,2021,3(4):100316.
[14] HELLERBRAND C. Hepatic stellate cells:the pericytes in the liver[J]. Pflugers Arch,2013,465(6):775-778.
[15] 蔡田恬,赵敏,王建平.仙鹤草水提液对胰腺癌细胞BXPC-3和PANC-1增殖的抑制作用研究[J].中国现代应用药学,2018,35(8):1208-1211.
[16] 田露露,包永睿,王帅,等.基于人肝癌细胞HepG2的仙鹤草挥发性成分体外抗肝肿瘤活性评价研究[J].中南药学,2019,17(1):15-19.
[17] TENG H,HUANG Q,CHEN L. Inhibition of cell prolife- ration and triggering of apoptosis by agrimonolide through MAP kinase (ERK and p38) pathways in human gastric cancer AGS cells[J]. Food Funct,2016,7(11):4605- 4613.
[18] HUANG W,DENG H,JIN S Y,et al. The isolation,structural characterization and anti-osteosarcoma activity of a water soluble polysaccharide from Agrimonia pilosa[J]. Carbohydr Polym,2018,187:19-25.
[19] 张婷婷,刘文洪,周琢艳,等.基于线粒体凋亡通路探讨仙鹤草促HepG2细胞凋亡的机制[J].中药材,2018,41(9):2185-2189.
[20] 张婷婷,周琢艳,嵇丽娜,等.仙鹤草水提物对HepG2细胞凋亡的影响[J].中国临床药理学杂志,2018,34(23):2746-2749.
(收稿日期:2021-09-07 修回日期:2021-12-20)
(编辑:唐晓莲)
基金项目:重庆市自然科学基金面上项目(No.cstc2019jcyj- msxmX0049);重庆市技术创新与应用发展专项重点项目(No.cstc2019jscx-dxwtBX0023);重庆市科研机构绩效激励引导专项(No.jxyn2020-4)
主治医师,博士。研究方向:中医药防治慢性肝病。E-mail: lilin515626@126.com
通信作者:副主任醫师,硕士。研究方向:中医药防治慢性肝病。电话:023-67667190。E-mail:changjiang78@163.com

