鼎湖山季风常绿阔叶林演替系列土壤细菌群落的变化特征
杨世福 ,马玲玲 ,陈芸芝 ,唐旭利
1.中国科学院华南植物园,广东 广州 510650;2.中国科学院大学,北京 100049
随着人类对原始森林的干扰破坏,全球次生林面积不断上升,次生演替成为陆地生态系统的研究热点之一(Zhou et al.,2017)。植物群落的演替在森林生态系统中起着重要作用,了解演替的变化过程是森林生态系统恢复的重要基础(Qu et al.,2020)。森林演替是由地上和地下部分相互作用所驱动的(Chai et al.,2019),植物群落组成、多样性以及凋落物输入数量和质量的变化均可能导致土壤微生物的生物量、活性和群落结构发生变化(Banning et al.,2011;Cline et al.,2015;Smith et al.,2015)。土壤微生物多样性与森林生态系统功能多样性呈正相关关系,任何微生物多样性的损失都可能会降低森林生态系统的功能多样性(Delgado-Baquerizo et al.,2016)。Ren et al.(2019)研究发现,森林演替对微生物多样性有积极的影响,这取决于演替阶段和微生物群落的分布格局。不同演替阶段森林环境存在异质性,导致不同的微生物群落演替模式不同(Liu et al.,2020)。细菌是森林土壤中最丰富的类群,参与了碳、氮和磷等重要元素的生物化学地球循环过程(Roesch et al.,2007;Llado et al.,2017)。虽然之前的研究认为植被演替会导致土壤微生物群落发生变化(Chabrerie et al.,2003;Jia et al.,2005),但是对土壤细菌群落随演替进行的变化模式知之甚少。了解土壤细菌群落在不同演替阶段的适应策略,有助于理解土壤细菌群落在演替过程中的重要作用和预测土壤微生物对未来环境变化的响应。
鼎湖山自然保护区内分布着大面积的南亚热带地带性森林——季风常绿阔叶林及其自然演替阶段的多种森林类型。已有研究表明,植物多样性、丰富度(李林等,2006)和微生物生物量(易志刚等,2005)随演替进行逐渐增加,凋落物质量也随之发生改变(Huang et al.,2011),处于演替顶级的季风常绿阔叶林中更多的碳被分配到地下(Tang et al.,2011),植物来源碳的输入必将从“量”和“质”两个方面对土壤微生物群落产生影响。此外,环境因素(如pH、土壤养分等)在演替过程中发生了改变,那么在演替过程中土壤细菌群落组成和多样性对环境因子的变化有怎样响应?土壤细菌群落结构能够反映土壤生态功能,具有重要的指示作用(Llado et al.,2017)。通常,富营养微生物和r策略紧密相关,而寡营养微生物和k策略紧密相关,在常见的细菌类群中,酸杆菌门和放线菌门被认为是k策略细菌,变形菌门和拟杆菌门被认为是r策略细菌(Fierer et al.,2007)。有研究从门水平的角度分析了演替过程中细菌优势类群的变化,认为优势类群相对丰度的变化可以表征植被演替导致细菌群落从r策略细菌占优势转变为k策略细菌占优势(Yan et al.,2020)。然而,目前还不清楚在亚热带不同演替阶段森林中,土壤细菌群落是否存在生态策略的转变。
本研究以鼎湖山国家级自然保护区内处于不同演替阶段的3个代表性森林类型,即演替初期阶段的马尾松林、演替中期阶段的针阔叶混交林和演替顶级阶段的季风常绿阔叶林为研究对象,利用高通量测序方法,分析了季风常绿阔叶林不同演替阶段森林土壤细菌群落的组成、结构和多样性。试图回答以下2个问题:(1)季风常绿阔叶林不同演替阶段森林土壤细菌群落组成和多样性的变化规律如何?土壤细菌群落是否存在生态策略的转变?(2)土壤细菌群落变化的潜在驱动因素是什么?
1 材料与方法
1.1 研究地概况
研究地位于广东省肇庆市鼎湖山国家级自然保护区内(23°09′21″—23°11′30″N,112°30′39″—112°33′41″E),面积约为 1155 hm2,该地区属于亚热带季风湿润气候,年均降水约为1900 mm,大部分降水发生在湿季(4—9月),年均温为21.4 ℃,年均相对湿度为80%,土壤为砂页岩发育的赤红壤(Huang et al.,2013)。保护区内有代表亚热带森林演替的3种典型森林类型,分别是演替初期阶段的马尾松林、演替中期阶段的针阔叶混交林(简称混交林)以及演替顶级阶段的季风常绿阔叶林(简称阔叶林)。
本研究所选择的永久样地面积均为1 hm2,是严格遵照生态学原则设计建立的,具有相同或相似的海拔高度、土壤类型和坡向。马尾松林样地,海拔为50—200 m,坡度约25°。起源于1930—1950年间营造的马尾松人工林。乔木层主要物种为马尾松(Pinus massoniana);灌木层主要物种为桃金娘(Rhodomyryus tomentosa)、野牡丹(Melastoma candidum)和三叉苦(Evodia lepta)等;草本层以芒萁(Dicranopteris lineais)为主。针阔叶混交林样地,海拔为100—250 m,坡度约30°。起源于20世纪30年代营造的马尾松人工林,由木荷(Schima superba)和锥(Castanopsis chinensis)等阔叶树种逐渐入侵而形成。群落结构较为简单,乔木层主要物种为马尾松、锥、木荷和豺皮樟(Litsea rotundifolia)等;灌木层以桃金娘为优势种;草本层主要物种为芒萁和黑莎草(Gahnia tristis)。季风常绿阔叶林样地位于保护区的核心区内,海拔为250—300 m,坡度约30°—36°;该群落是南亚热带常绿阔叶林代表类型,目前已经有 400多年的保护历史,森林植物类型丰富,结构复杂,乔木层主要物种为华润楠(Machilus chinensis)、锥、木荷、黄果厚壳桂(Cryptocarya concina)、厚壳桂(Cryptocarya chinensis)、鼎湖钓樟(Lindera chunii)和云南银柴(Aporusa yunnanensis)等(方运霆等,2003)。
1.2 样品采集
于2020年7月采集土壤样品,在马尾松林、针阔叶混交林、季风常绿阔叶林内分别随机选取 8个10 m×10 m样方,样方间隔大于20 m。在每个样方内按照五点取样法进行采样。采集土壤样品前,先将凋落物移除,然后使用内径为5 cm的土钻取5个 0—10 cm土层的土壤样品并将其混合均匀,作为一个样品。
1.3 土壤理化性质分析
将采集到的土壤样品放入 4 ℃便携式保温箱中保存。运回实验室后,先取一部分用于立即测定土壤含水量(Soil water content,SWC)。剩下的所有土壤样品过2 mm筛,然后分为3份,一部分用于提取DNA,在DNA提取之前一直保存于−20 ℃冰箱。另一部分保存于4 ℃冰箱中,在一周内完成土壤硝态氮(Nitrate nitrogen,NO3−-N)、铵态氮(Ammonium nitrogen,NH4+-N)的测定。最后一部分样品经自然风干后,用于测定土壤pH、土壤有机碳(Soil organic carbon,SOC)、全氮(Total nitrogen,TN)、全磷(Total phosphorus,TP)和有效磷(Available phosphorus,AP)。土壤pH采用电位法测定;土壤含水量采用铝盒烘干法测定;土壤有机碳采用重铬酸钾氧化-外加热法测定;全氮采用靛酚蓝分光光度比色法测定;铵态氮和硝态氮采用氯化钾浸提-比色法测定;有效磷采用盐酸-氟化铵浸提-钼锑抗比色法测定;全磷采用硫酸消煮-钼锑抗比色法测定。土壤理化性质测定方法的详细描述见Lie et al.(2019)。
1.4 DNA抽提、PCR扩增及Illumina Miseq测序
使用 Fast DNA SPIN Kit for Soil(MP Biomedicals,Santa Ana,CA)试剂盒,根据说明书对土壤微生物群落总DNA进行抽提,然后使用1%浓度的琼脂糖凝胶电泳检测 DNA的提取质量,DNA浓度和纯度使用NanoDrop2000测定;使用细菌通用引物 338F(5′-ACTCCTACGGGAGGCAGCA G-3′)和 806R(5′-GGACTACHVGGGTWTCTAAT-3′)对土壤细菌16S rRNA基因的V3和V4可变区进行PCR扩增。关于PCR扩增过程、扩增子高通量测序文库建立和DNA序列处理过程的详细介绍见Duan et al.(2021)。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
1.5 DNA序列处理
使用 QIIME2对原始测序数据进行处理(Bolyen et al.,2019)。用 fastp(v 0.20.0)进行质控(Chen et al.,2018),用FLASH(v 1.2.7)进行拼接(Magoc et al.,2011)。根据 97%的相似度,使用UPARSE(v 7.1)软件对序列进行操作分类单元(Operational taxonomic units,OTU)聚类并剔除嵌合体(Edgar,2013)。利用 RDP classifier(v 2.2)比对Silva 16S rRNA数据库(v 138)对每条序列进行物种分类注释,置信度阈值设置为70%。为减少序列数差异对后期数据分析的影响,所有样品按最小样本序列数进行抽平,得到的标准化序列数据用于后续分析。
1.6 统计分析
使用 Shapiro-Wilk检验对数据进行正态性检验,使用Levene’s检验对数据进行方差齐性检验。采用单因素方差分析法(One-way analysis of variation)和LSD(Least significant difference)多重比较法检验不同演替阶段森林间土壤理化性质、细菌群落的α多样性指数(Shannon指数和Chao 1指数)和主要门相对丰度的差异性。基于Bray-Curtis距离算法,使用主坐标分析(Principal co-ordinates analysis,PCoA)分析不同演替阶段森林土壤细菌群落结构差异,并使用置换多元方差分析(Permutational multivariate analysis of variance,PERMANOVA)来检验不同演替阶段森林土壤细菌群落结构差异是否存在统计学上的显著性。使用冗余分析(Redundancy analysis,RDA)探究影响土壤细菌群落变化的主要因素。用Pearson相关性分析探究土壤细菌群落组成与土壤理化性质之间的相关关系。显著性水平设置为P<0.05。所有数据处理与绘图均使用R 4.0.2完成。
2 结果与分析
2.1 不同演替阶段森林土壤理化性质
不同演替阶段森林土壤理化性质如表1所示,混交林和阔叶林的土壤有机碳、全氮、全磷、有效磷含量以及土壤含水量均显著高于马尾松林(P<0.05),而混交林和阔叶林之间差异不显著。土壤铵态氮含量随演替的进行呈现逐渐增加的趋势,且演替顶级阶段的阔叶林显著高于演替初期阶段的马尾松林(P<0.05)。土壤硝态氮含量随演替的进行呈增加趋势,但差异不显著。土壤pH值随演替的进行而逐渐下降,且演替顶级阶段的阔叶林显著低于演替初期阶段的马尾松林(P<0.05)。
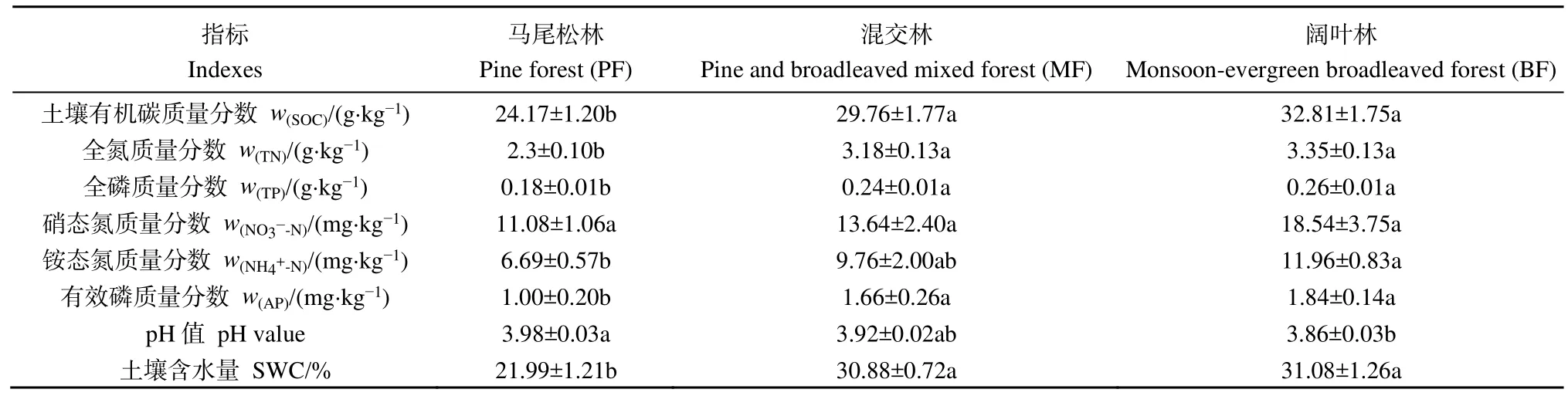
表1 鼎湖山不同演替阶段森林0—10 cm土壤理化性质Table 1 Physicochemical properties in top soil (0–10 cm in depth) of three successional forests in the Dinghushan National Nature Reserve
2.2 不同演替阶段森林土壤细菌多样性
24个土壤样品共获得1359050条有效序列,聚类得到3358个OTU。物种分类注释结果显示,鼎湖山不同演替阶段森林土壤细菌群落分属 27个门、80纲、189目、297科和492属。从图1可以看出,不同演替阶段森林土壤细菌群落共有的OTU数量为1787个,马尾松林和阔叶林特有的OTU数量较多,而混交林特有的 OTU数量最少。马尾松林和混交林共有的OTU数量为337个,混交林和阔叶林共有的OTU数量为381个,而马尾松林和阔叶林共有的OTU数量只有155个,说明相邻演替阶段土壤细菌群落可能有更高相似度。
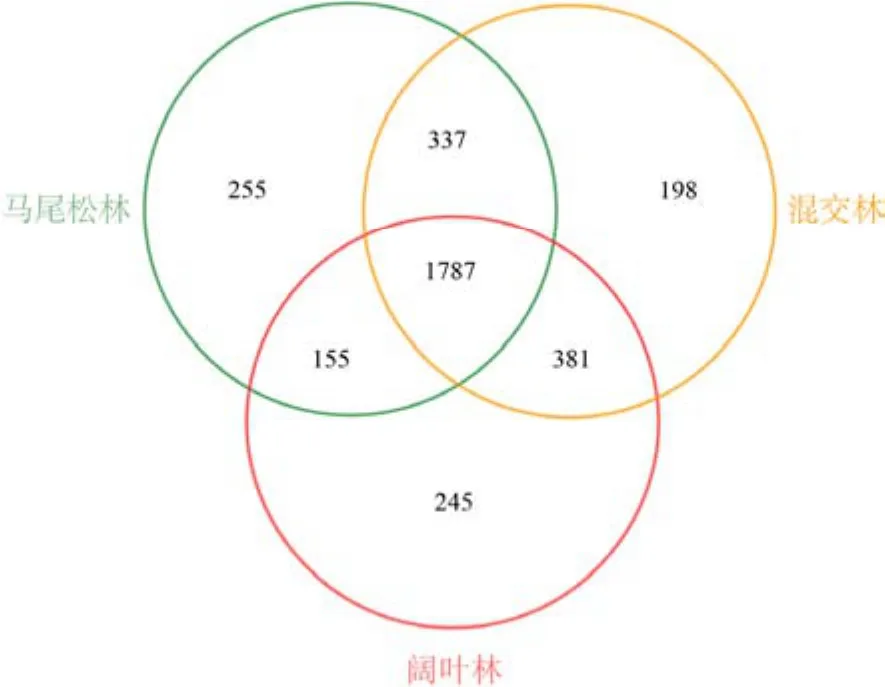
图1 不同演替阶段森林土壤细菌OTU水平韦恩图Figure 1 Venn diagrams of soil bacteria at OTU level of three successional forests in Dinghushan National Nature Reserve
土壤细菌群落的α多样性分析结果显示(图2),随着演替的进行土壤细菌群落的多样性指数(Shannon指数)呈先增加后降低的趋势(图2a),丰富度指数(Chao 1指数)呈逐渐增加的趋势(图2b),然而,不同演替阶段森林土壤细菌群落间多样性指数和丰富度指数均无显著差异。
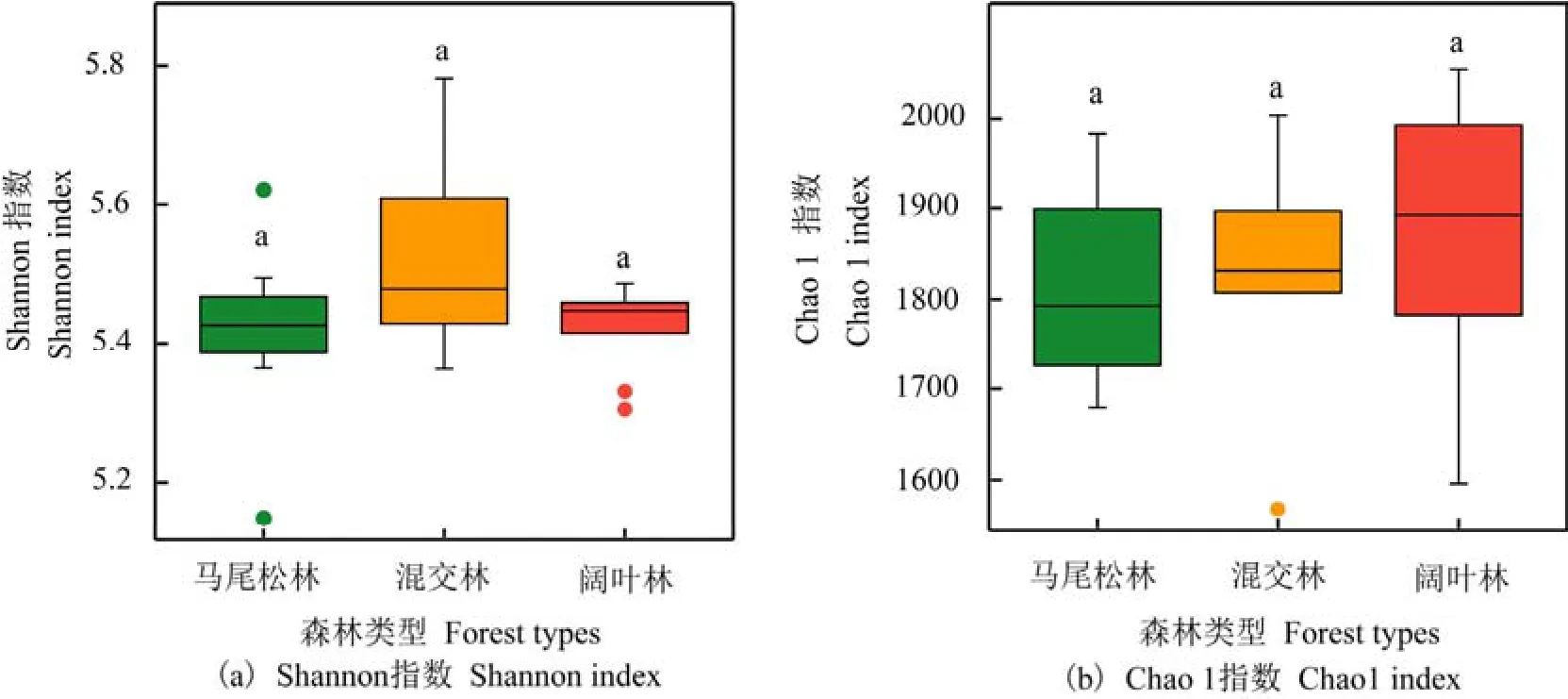
图2 鼎湖山不同演替阶段森林土壤细菌α多样性指数Figure 2 Soil bacterial alpha diversity index of three successional forests in the Dinghushan National Nature Reserve
2.3 不同演替阶段森林土壤细菌群落结构和组成
由图 3可以看出,在门水平上,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)是鼎湖山森林演替过程中土壤细菌群落的优势门,它们在不同演替阶段森林土壤细菌群落中的占比均超过10%。变形菌门的相对丰度从演替初期阶段的马尾松林到演替顶级阶段的阔叶林呈先减少后增加的趋势。放线菌门的相对丰度从演替初期阶段的马尾松林到演替顶级阶段的阔叶林呈先减少后增加的趋势。酸杆菌门的相对丰度随着演替的进行逐渐增加,在演替中期阶段的混交林和演替顶级阶段的阔叶林中显著高于演替初期阶段的马尾松林(P<0.05)。其他非优势门的相对丰度随着演替的进行也发生变化,例如:WPS-2的相对丰度逐渐增加;绿弯菌门(Chloroflexi)的相对丰度逐渐减少;浮霉菌门(Planctomycetes)的相对丰度显著增加,且在演替顶级阶段的阔叶林显著高于演替初期阶段的马尾松林(P<0.05)。
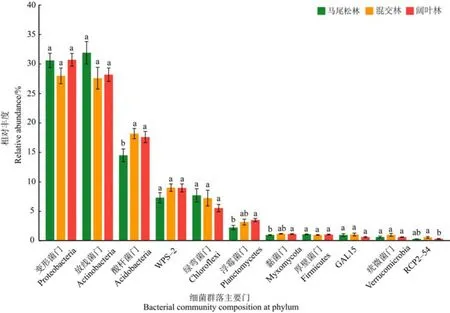
图3 鼎湖山不同演替阶段森林土壤细菌的主要门(丰度大于1%)Figure 3 Bacterial community composition at phylum level (with relative abundance >1%)of three successional forests in the Dinghushan National Nature Reserve
PCoA分析结果表明,3个不同演替阶段森林土壤细菌群落结构存在显著的差异(PERMANOVA,P<0.05),且在第一轴上明显分开(图4)。
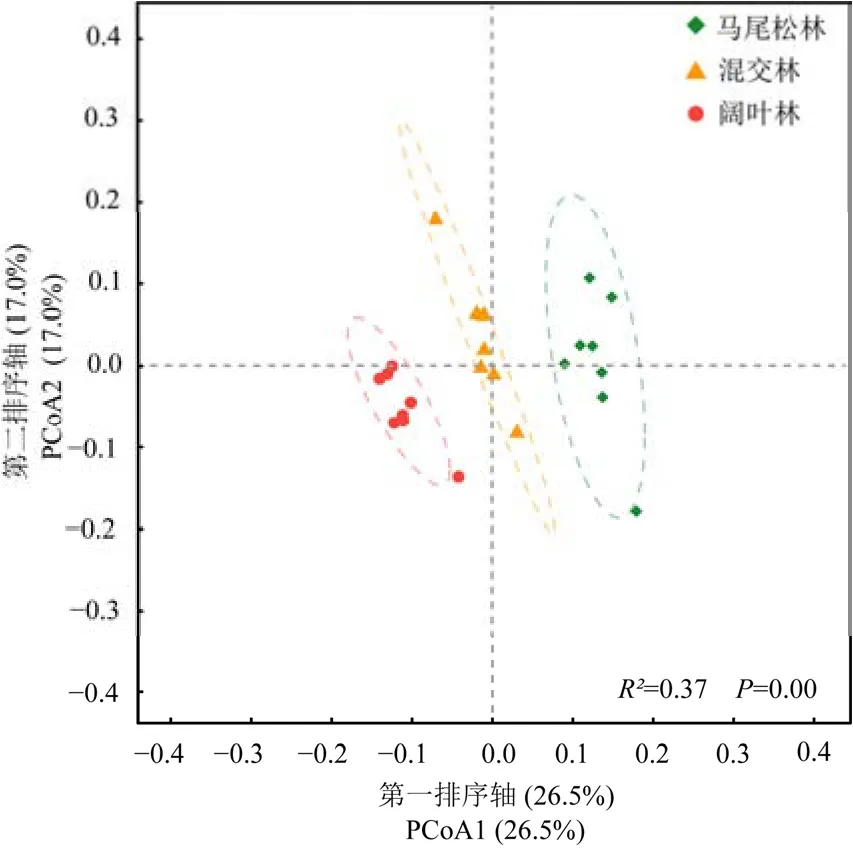
图4 鼎湖山不同演替阶段森林土壤细菌群落PCoA分析Figure 4 Principal coordinates analysis (PCoA) of bacterial composition based of three successional forests in the Dinghushan National Nature Reserve
2.4 土壤细菌群落与土壤理化性质之间的关系
RDA分析表明,第一轴和第二轴共解释了33.3%的土壤细菌群落变异(图 5)。土壤有机碳(R2=0.67,P<0.001)、全氮(R2=0.59,P<0.001)、含水量(R2=0.44,P<0.01)、pH(R2=0.38,P<0.05)以及硝态氮(R2=0.32,P<0.05)是影响土壤细菌群落结构变化的主要因素。相关性分析结果表明(图6),土壤细菌群落的Shannon指数和Chao 1指数与pH呈显著正相关关系;变形菌门和放线菌门的相对丰度与pH呈显著负相关关系;酸杆菌门的相对丰度与硝态氮和全氮呈显著正相关关系;绿弯菌门的相对丰度与pH呈极显著正相关关系,而与土壤有机碳和全氮呈极显著负相关关系。
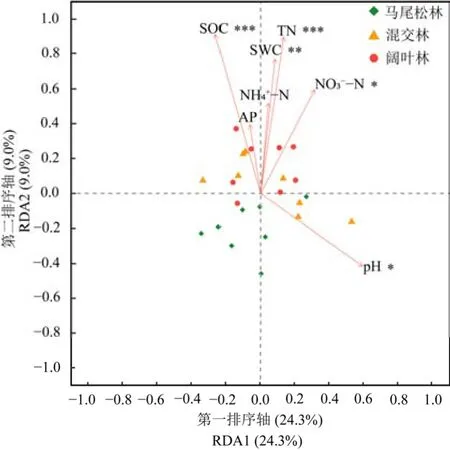
图5 土壤理化性质与土壤细菌群落的RDA分析Figure 5 Redundancy analysis (RDA) of soil physicochemical properties and soil bacterial community
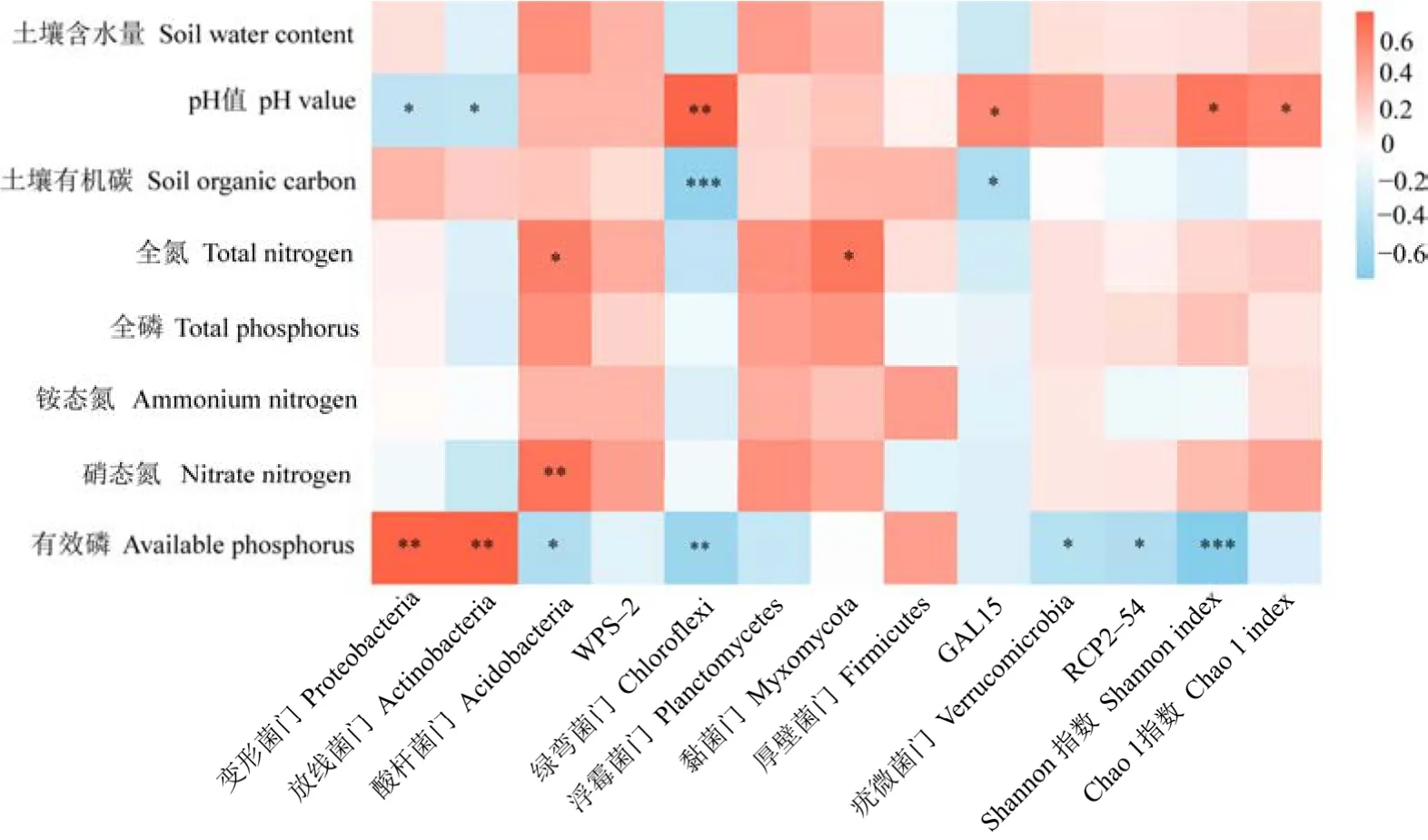
图6 土壤细菌主要门、多样性与土壤理化性质的Pearson相关性分析Figure 6 Pearson correlation analysis of soil bacterial community, diversity and soil physicochemical properties
3 讨论
变形菌门、放线菌门和酸杆菌门是鼎湖山不同演替阶段森林土壤细菌群落优势门,这一结果与前人在其他森林中的研究结果类似(Fierer et al.,2007;Liu et al.,2020)。本研究中,随着演替的进行,酸杆菌门的相对丰度显著增加(图 3),可能是对演替过程中土壤自然酸化程度增加的适应。有研究表明,酸杆菌门细菌适宜于酸性土壤中繁殖生长,并且其相对丰度随土壤pH值降低而增加(Xiang et al.,2014)。鼎湖山森林土壤为典型的赤红壤,土壤pH值较低,0—10 cm土壤pH值随演替的进行逐渐降低(表1),说明混交林和阔叶林中较酸的土壤环境为酸杆菌门细菌提供了相对适宜的条件,使其相对丰度增加。酸杆菌门细菌主要利用和分解难降解有机质,是 k策略细菌的典型代表之一(Morrissey et al.,2017)。Huang et al.(2011)的研究表明,鼎湖山处于演替顶级阶段的季风阔叶林中凋落物的C/N显著高于演替初期阶段的马尾松林,说明阔叶林中凋落物相对难分解。酸杆菌门的相对丰度的增加可能提高了阔叶林中土壤细菌群落分解和利用难降解碳的能力。放线菌门也是常见的 k策略细菌,在土壤有机质的分解中起着重要作用(Deng et al.,2018;Guo et al.,2018),研究指出放线菌门在有氧环境中生活(Liu et al.,2020)。随着演替的进行,放线菌门的相对丰度呈降低的趋势(图3),与Zeng et al.(2017)的研究结果一致,这可能是随着演替的进行,凋落物的积累使得表层土壤氧的含量降低(Liu et al.,2020),从而影响了放线菌门的丰度。变形菌门属于典型的r策略细菌(Fierer et al.,2007),土壤中易分解有机质(如根系分泌物)的增加能够促进r策略细菌的快速增长,从而加快土壤有机质的分解(Morrissey et al.,2017)。本研究发现,随着演替的进行,变形菌门的相对丰度未发生显著变化(图 3),与前人的研究结果不同(Zhang et al.,2016;Jiang et al.,2021)。北方森林土壤中变形菌门的相对丰度随森林演替的进行而逐渐降低(Jiang et al.,2021),农田土壤中变形菌门的相对丰度随农田次生演替而逐渐增加(Zhang et al.,2016)。本研究中不同次生演替阶段森林土壤中变形菌门的丰度没有呈现明显的增加或减少趋势,可能与土壤养分状况均较好有关(邓娇娇等,2019)。此外,有研究表明,绿弯菌门能够水解纤维素、木聚糖和几丁质等多糖,在降解植物残体的过程中具有重要作用(Yabe et al.,2010)。随着演替的进行,绿弯菌门的相对丰度逐渐降低,说明绿弯菌门对植物残体分解的贡献可能降低。这一趋势在一定程度上可以增加植物残体碳向土壤转移,从而促进土壤有机碳的积累(Cao et al.,2020)。
土壤微生物多样性与森林生态系统功能多样性呈正相关关系,土壤微生物多样性的降低可能会降低森林生态系统的功能多样性(Delgado-Baquerizo et al.,2016)。本研究发现,鼎湖山不同演替阶段森林间土壤细菌群落 Shannon指数和Chao 1指数均无显著差异(图2a和b),说明鼎湖山3个不同演替阶段森林均能维持较高的森林生态系统的功能多样性,与前人的研究结果一致(Zeng et al.,2007;Jiang et al.,2021)。虽然不同演替阶段森林的土壤细菌群落α多样性无显著差异,但土壤细菌群落结构差异显著(图4)。这可能是随着演替的进行,土壤有机碳、全氮和全磷等养分的含量逐渐增加(表1),为土壤细菌群落生长繁殖提供了充足的碳源和氮源(Cleveland et al.,2007)。土壤养分(Zhang et al.,2015;Xu et al.,2021)和酸碱性(Rousk et al.,2010)是影响土壤细菌群落的主要因素。鼎湖山季风常绿阔叶林及其演替系列森林中,土壤有机碳、全氮、含水量、硝态氮和pH是影响土壤细菌群落变化的主要因素(图5)。比较3个演替阶段的森林可以看出,随着土壤pH降低(表1),酸杆菌门的相对丰度逐渐增加,绿弯菌门的相对丰度逐渐减少;随着土壤有机碳、全氮、硝态氮和含水量的增加(表1),酸杆菌门和浮霉菌门的相对丰度逐渐增加。
4 结论
随着演替的进行,土壤细菌群落的α多样性没有发生显著变化,但结构发生显著改变。土壤细菌群落的多样性指数(Shannon指数)随演替的进行呈先增加后降低的趋势,而细菌群落的丰富度指数(Chao 1指数)则呈逐渐增加的趋势。在门水平上,土壤细菌群落的优势类群没有发生显著变化,但组成发生显著变化。与演替初期阶段的马尾松林相比,在演替顶级阶段的阔叶林中,酸杆菌门的相对丰度显著增加,而放线菌门、变形菌门的相对丰度未发生显著变化,说明土壤细菌群落由r策略细菌占优势地位转变为k策略细菌占优势地位。土壤有机碳、全氮、含水量、pH以及硝态氮共同驱动了鼎湖山不同演替阶段森林土壤细菌群落的变化。

