白果内酯对早产仔鼠WMI的改善作用及其机制*
姚 娟,赵 旸,李 娜,秦 霞,赵 剡
(1.湖北医药学院附属十堰市人民医院新生儿科,湖北十堰 442000;2.湖北医药学院附属十堰市人民医院儿科,湖北十堰 442000;3.武汉大学中南医院急诊科,武汉 430071)
随着早产儿成活率的上升,幸存的早产儿脑损伤问题日益突出。脑室周围白质损伤(white matter injury,WMI)是最主要脑损伤,不但会增加早期病死率,还可诱发诸多后遗症,已成为新的公共卫生与社会问题[1]。据报道[2],WMI可影响少突胶质细胞的正常分化、成熟,致大脑发育不良,是早产儿神经功能发育障碍的主要病因。目前国内外尚缺乏早产儿WMI的有效防治策略,故探讨早产儿WMI的发生机制,寻找神经保护药物尤为迫切。白果内酯是银杏叶提取物中唯一一种倍半萜内酯化合物,具有抗氧化应激、保护线粒体功能、抗兴奋性毒性等作用,被广泛应用于缺血性脑中风、阿尔兹海默症等脑神经损伤疾病治疗。关婷等[3]证明以白果内酯为主要成分的中成药可用于改善神经功能缺损。但白果内酯在早产儿WMI治疗中的作用及其机制尚不清楚,故本研究制作早产仔鼠WMI模型,观察白果内酯对仔鼠WMI的改善作用及其可能机制,为临床治疗早产儿WMI提供新的途径。
1 材料与方法
1.1 材料
1.1.1实验动物
7周龄SPF级Wistar大鼠购自北京斯贝福生物技术有限公司,雌性18只,体重(230±10)g,雄性6只,体重(210±10)g,生产许可证号SCXK(京)2019-0010。实验开展前适应性饲养1周,饲养室温(23±2)℃,相对湿度40%~60%,12 h自然光照,自由摄食饮水。本实验操作符合一般动物实验伦理学原则。
1.1.2主要试剂和仪器
白果内酯(HPLC≥98%,成都格利普生物科技有限公司)。O4抗体免疫组化试剂盒(上海赫澎生物科技有限公司,生产批号:20190506),兔抗大鼠Ras同源基因家族成员A(RhoA)、磷酸化RhoA(p-RhoA)、Rho相关卷曲螺旋形成蛋白激酶(ROCK)、重组人轻链Ventricular肌球蛋白2(MLC2)、磷酸化MLC2(p-MLC2)、β-actin一抗(上海钰博生物科技有限公司),辣根过氧化物酶标记的羊抗兔二抗(上海碧云天生物技术有限公司)。GE ImageQuant LAS 500-生物分子成像仪(美国Thermo Fisher公司)。
1.2 方法
1.2.1造模及分组
适应性饲养结束后,将3只雌性大鼠与1只雄性大鼠同笼饲养,每天早上检查雌性大鼠阴栓,从孕鼠中取12只建立WMI模型[4]:在雌性大鼠出现阴道栓后第16、17天注射脂多糖350 μg/kg,每天1次,同时取6只孕鼠注射等体积生理盐水。将造模孕鼠孕期≤21 d分娩的仔鼠定义为早产WMI,分为模型组、白果内酯组、激动剂组,每组12只。将6只孕鼠足月(22~23 d)分娩的仔鼠作为对照组(10只)。4组仔鼠均与雌鼠同笼饲养,仔鼠出生3 d后开始干预,白果内酯组、激动剂组分别腹腔注射白果内酯3.5 mg/kg、Rho/ROCK通路激动剂LPA 50 μg/mL+白果内酯3.5 mg/kg干预,模型组、对照组腹腔注射等体积生理盐水,连续干预2周。
1.2.2仔鼠神经行为学测定
仔鼠干预2周后,采取悬吊实验、斜坡实验、旷场实验检测仔鼠神经行为学。悬吊实验:让仔鼠前腿抓住一根水平玻璃棒(直径0.5 cm),离开桌面45 cm,记录仔鼠掉下时间,计分标准:<10 s计1分,10~30 s计2分,>30 s~2 min计3分,>2~5 min计4分,>5 min计5分。斜坡实验:仔鼠头朝下倒置45°斜面上,记录其转位为头朝上角度>135°的时间。旷场实验:用装置为36 cm×36 cm×36 cm的纸箱,无顶,箱底以墨线分成9个等面积小方格,将仔鼠置于中间方格上,观察其15 s内活动情况,从所在方格中进入相邻方格计1分,累计仔鼠15 s进入方格数并记录总分。
1.2.3HE染色观察仔鼠侧脑室面积及脑白质病理学
干预2周后,麻醉断头处死并取出全脑组织,一部分冻存于-80 ℃待Western blot检测,另一部分石蜡包埋,制作6 μm厚的冠状脑片。HE染色:脱蜡水化后,切片浸入苏木素液中染色细胞核,分化返蓝后,浸入伊红液中染色细胞质,梯度乙醇脱水,中性树胶封片。显微镜观察脑组织形态,Image J软件量化全脑及左、右脑室面积,侧脑室指数(%)=左右脑室面积之和/全脑面积×100%。
1.2.4免疫组化法检测仔鼠少突胶质细胞凋亡情况
冠状脑片脱蜡水化,参考O4抗体免疫组化试剂盒说明书操作:用3%过氧化氢溶液置于玻片上进行热修复抗原,封闭玻片后,加兔抗仔鼠O4抗体(1∶500稀释),37 ℃孵育1 h,加生物素标记的山羊抗兔IgG二抗,室温孵育0.5 h,DAB显色,显微镜下随机选取3个视野,用Image J软件观察阳性信号。
1.2.5Western blot检测仔鼠脑组织Rho/ROCK通路相关蛋白表达
取仔鼠脑组织用RIPA裂解液裂解,BCA法定量蛋白浓度,上样后沸水浴变性,取等量蛋白进行SDS-PAGE分离,将目的蛋白转移到PVDF膜。将PVDF膜置入10%脱脂奶粉中封闭2 h,加入兔抗仔鼠RhoA(1∶500稀释)、p-RhoA(1∶500稀释)、ROCK2(1∶500稀释)、MLC2(1∶500稀释)、p-MLC2(1∶500稀释)、β-actin(1∶500稀释)一抗,4 ℃孵育过夜。次日取出PVDF膜,加入辣根过氧化物酶标记的羊抗兔二抗(1∶1 000稀释),避光反应1 h,加入ECL发光底物显色。Image Quant LAS 4000 mini显影分析目的蛋白相对表达量。
1.3 统计学处理
2 结 果
2.1 仔鼠神经行为学评分
与对照组比较,模型组、激动剂组、白果内酯组仔鼠悬吊实验评分减少、斜坡实验时间增加、旷场实验评分减少(P<0.05);与模型组比较,激动剂组、白果内酯组悬吊实验评分增加、斜坡实验时间减少、旷场实验评分增加(P<0.05);与激动剂组比较,白果内酯组悬吊实验评分增加、斜坡实验时间减少、旷场实验评分增加(P<0.05),见表1。

表1 仔鼠神经行为学评分
2.2 仔鼠侧脑室指数
HE染色结果显示:与对照组比较,模型组仔鼠侧脑室面积增大,侧脑室指数升高(P<0.05);与模型组比较,激动剂组、白果内酯组侧脑室面积减小,侧脑室指数下降(P<0.05);与激动剂组比较,白果内酯组侧脑室面积减小,侧脑室指数下降(P<0.05),见图1。
2.3 仔鼠脑白质病理学
对照组仔鼠脑白质染色清晰,结构正常,细胞排列正常,核大而深染;与对照组比较,模型组脑白质染色淡,结构稀疏,细胞排列紊乱,核固缩;激动剂组、白果内酯组脑白质染色、结构、细胞排列等均明显改善,见图2。
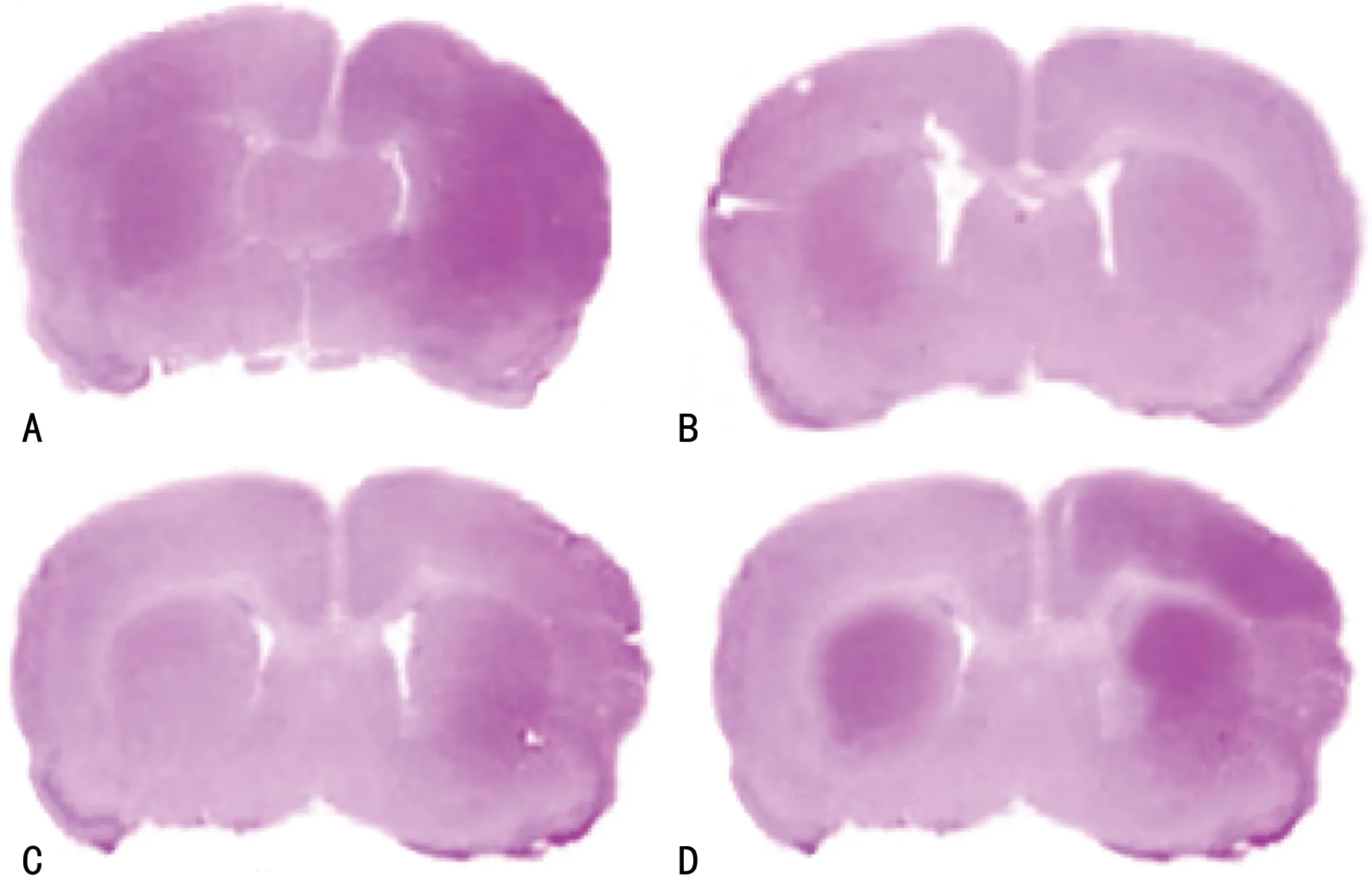
A:对照组;B:模型组;C:激动剂组;D:白果内酯组。图1 HE染色观察仔鼠侧脑室扩张情况(×400)
2.4 仔鼠少突胶质细胞凋亡情况
免疫组化染色显示,对照组仔鼠胼胝体、扣带回处O4表达丰富,阳性细胞数多;与对照组比较,模型组仔鼠O4阳性细胞数明显减少;与模型组比较,激动剂组与白果内酯组O4阳性细胞数有所增加,见图3。
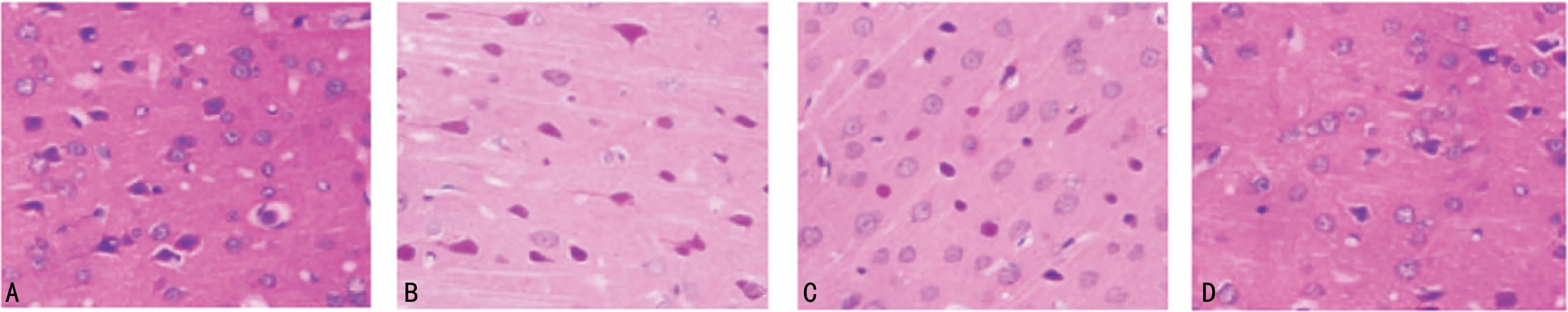
A:对照组;B:模型组;C:激动剂组;D:白果内酯组。图2 仔鼠脑白质HE染色(×400)
2.5 仔鼠脑组织Rho/ROCK通路相关蛋白表达
各组仔鼠脑组织RhoA、MLC2蛋白表达比较差异无统计学意义(P>0.05),p-RhoA、ROCK2、p-MLC2蛋白表达比较差异有统计学意义(P<0.05)。与对照组比较,模型组、激动剂组、白果内酯组p-RhoA、ROCK2、p-MLC2蛋白表达升高(P<0.05);与模型组比较,激动剂组、白果内酯组p-RhoA、ROCK2、p-MLC2蛋白表达降低(P<0.05);与激动剂组比较,白果内酯组p-RhoA、ROCK2、p-MLC2蛋白表达降低(P<0.05),见表2、图4。
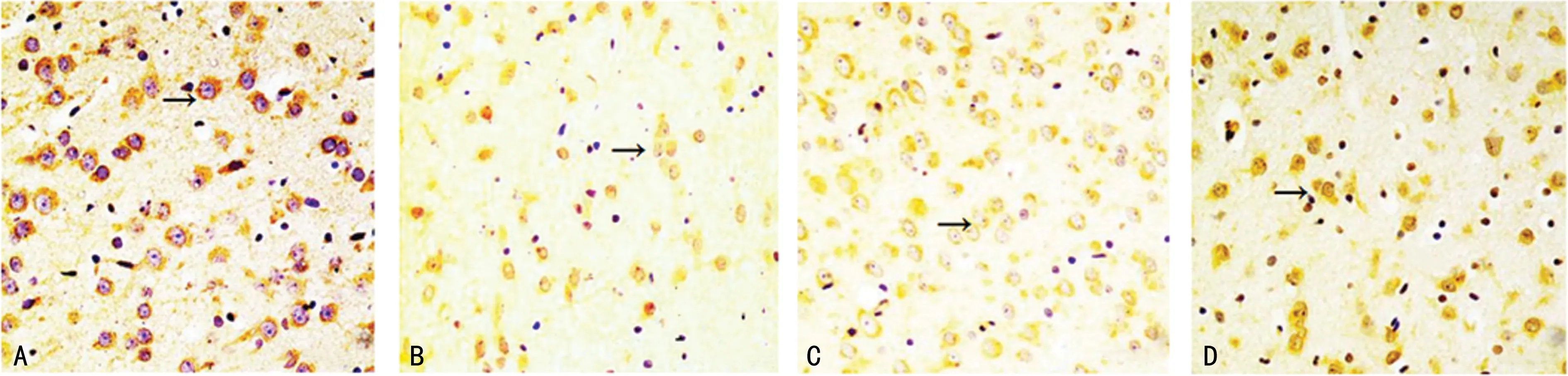
A:对照组;B:模型组;C:激动剂组;D:白果内酯组;→:O4阳性细胞。图3 仔鼠少突胶质细胞凋亡免疫组化(×400)

表2 仔鼠Rho/ROCK通路相关蛋白表达
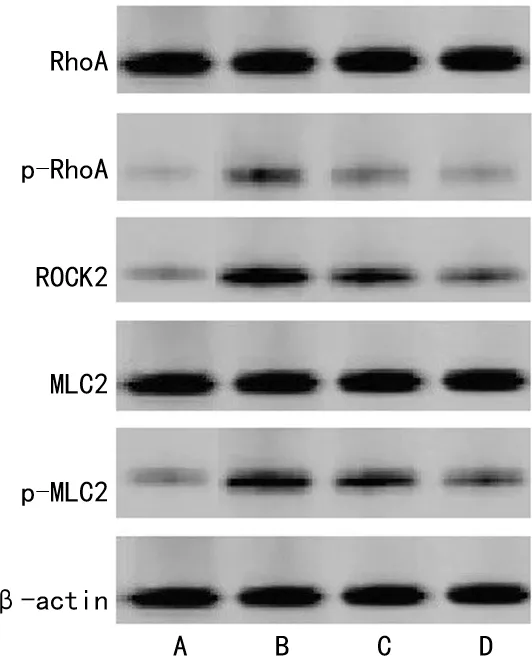
A:对照组;B:模型组;C:激动剂组;D:白果内酯组。图4 各组仔鼠Rho/ROCK通路相关蛋白电泳图
3 讨 论
WMI为早产儿脑病主要表现形式,对早产儿神经系统正常发育造成极大影响,往往遗留脑瘫、认知及视听功能障碍等后遗症[5]。目前,关于早产儿WMI的发生机制尚不清楚,ALTENDAHL等[6]认为围生期子宫炎症改变了脑白质发育过程,为诱发早产儿WMI的主要因素,故本研究采用腹腔注射脂多糖致子宫炎症的方法。目前国内外对早产儿WMI尚无统一特效治疗标准,探索新的神经保护药物是治疗该病的关键方向。白果是一种药用价值显著的天然植物,药用历史悠久,白果内酯为其主要药效成分,有抗炎、抗血小板聚集等作用,长期用于增强免疫力、防治心脑血管疾病治疗[7-8]。白果内酯已经进入神经系统疾病相关的临床实验研究中,但对早产WMI动物模型研究的数据鲜见。本研究主要从早产仔鼠WMI侧脑室及脑白质病理损伤、少突胶质细胞特殊标记物表达角度,初步探讨白果内酯对早产仔鼠WMI的神经保护作用,为今后临床防治早产儿WMI提供参考。
悬吊实验、斜坡实验、旷场实验为公认的神经行为学检测方法,指标可观,可快速获得数据。悬吊实验可评估仔鼠随意运动能力,斜坡实验评估躯体协调与平衡能力,旷场实验评估仔鼠运动活力。本研究结果显示:与模型组比较,白果内酯组悬吊实验评分增加、斜坡实验时间减少、旷场实验评分增加,提示白果内酯可改善早产仔鼠WMI的神经行为学。侧脑室扩张是WMI主要症状表现,经HE染色观察仔鼠侧脑室与脑白质病理学发现,与模型组比较,白果内酯组侧脑室面积减小,侧脑室指数下降,脑白质结构、染色、细胞核变化等均明显改善,提示白果内酯可抑制WMI症状,减轻WMI。少突胶质细胞是脑白质的主要成分,为轴突提供营养支持与能量,参与维持神经元轴突信号传递与神经功能[9]。CHAVALI等[10]报道,少突胶质细胞凋亡参与了WMI。宫内感染激活胎儿小胶质细胞,介导了细胞因子、补体、白细胞等参与的免疫性炎症,损伤少突胶质细胞前体细胞,抑制了髓鞘形成,从而出现严重WMI。O4为少突胶质细胞前体细胞的生物标记物,在细胞膜上呈阳性表达,早产儿发生WMI时,少突胶质细胞分化过程受阻,可导致O4表达水平下降[11]。本研究通过免疫组化染色检测O4表达水平,评估少突胶质细胞分化程度,结果显示:与模型组比较,白果内酯组仔鼠脑白质O4阳性细胞数增加,提示白果内酯可抑制少突胶质细胞凋亡,可能与其抗炎作用有关。
Rho蛋白是小分子G蛋白,RhoA为Rho家族成员之一[12]。研究表明脑白质髓鞘抑制因子是通过活化RhoA这一共同分子开关信号通路,诱发一系列反应,影响轴突再生,最终损伤脑白质。RhoA为ROCK最早发现的Rho效应物,可能是脑白质轴突生长的抑制性蛋白发挥作用的焦点[13]。ROCK是丝氨酸/苏氨酸蛋白激酶家族成员,为RhoA下游靶效应分子,根据基因编码不同分为ROCK1和ROCK2两种亚型[14]。其中,ROCK2主要表达于大脑皮层、海马椎体神经元,据报道ROCK2在小鼠出生后大脑发育阶段的表达上调[15]。Rho受外界刺激活化后,将活化信号传递到下游靶分子——ROCK后,作用于其底物MLC,直接使其磷酸化,从而调控细胞动态变化。据报道[16],Rho/ROCK通路异常激活与WMI相关,但多数报道集中于缺血性动物模型中。本研究结果显示:与模型组比较,激动剂组、白果内酯组p-RhoA、ROCK2、p-MLC2蛋白表达降低,其中以白果内酯组上述蛋白表达最低,提示白果内酯可能通过下调Rho/ROCK通路改善早产仔鼠WMI。
综上所述,白果内酯可能通过下调Rho/ROCK通路,抑制少突胶质细胞凋亡,从而减轻早产仔鼠WMI。

