143例Citrin缺陷导致新生儿肝内胆汁淤积症患儿的血浆氨基酸谱分析*
梅慧芬,蔡燕娜,彭敏芝,卢致琨,林云婷,江敏妍,盛慧英,李秀珍,张 文
广东省广州市妇女儿童医疗中心遗传与内分泌科,广东广州 510623
Citrin是线粒体内钙结合天冬氨酸/谷氨酸的载体亚型2蛋白,主要功能是将线粒体内的天冬氨酸转运至胞质,参与尿素循环。Citrin缺陷会导致患儿在婴儿期出现新生儿肝内胆汁淤积症(NICCD),为常染色体隐性遗传疾病,致病基因为SLC25A13[1]。该病首先在日本被发现,在日本、中国、韩国等亚洲国家及欧洲部分国家均有报道,东亚人群发病率较高,其中中国发病率为1/65,日本发病率为1/69,韩国发病率为1/112[2]。研究显示NICCD在我国是各种伴氨基酸血症的婴儿肝内胆汁淤积症的重要病因[3]。Citrin缺陷所致的NICCD患儿主要临床表现为持续性黄疸、肝脾肿大、生长迟缓、低血糖、肝功能异常、凝血功能障碍、低蛋白血症等。大多数患儿在1岁左右其临床症状会消失,但是有近20%的患儿可逐渐进展为致命性的成人Ⅱ型瓜氨酸血症(CTLN2)[4]。因此,NICCD患儿的早诊断,早治疗对预防CTLN2意义重大。
NICCD患儿在发病期常会检测到血浆氨基酸水平异常,表现为血浆瓜氨酸、鸟氨酸、蛋氨酸、苯丙氨酸、酪氨酸、苏氨酸水平升高。目前国内外大多采用干血滤纸片-串联质谱法对11种氨基酸水平进行半定量分析,该法在筛查和诊断NICCD的准确性及可靠性上有待进一步评估[5-6]。有报道指出新生儿进行NICCD筛查时的检出率低于40%[5]。如此低的检出率与标本采集时间有关:NICCD患儿大多在1~4月龄才因黄疸被注意到,出生后3 d采集的标本可能检测不到氨基酸谱的改变。目前NICCD的临床诊断标准尚未确定,确诊依赖于SLC25A13基因检测。为了提高NICCD诊断的速度和灵敏度,本研究分析NICCD患儿与健康婴幼儿、不明原因肝内胆汁淤积症(INH)儿童血浆氨基酸谱改变特点,氨基酸水平与年龄、基因型的关系,旨在为临床早期诊断NICCD提供依据。
1 资料与方法
1.1一般资料 选取2004—2019年在本院因婴儿肝炎综合征或胆汁淤积症就诊的143例NICCD患儿作为NICCD组。所有患儿均经SLC25A13基因测序,确定患儿存在纯合或复合杂合致病突变。143例NICCD患儿发病年龄在3天至1岁,平均年龄(3.56±0.17)个月;男性患儿74例,占51.7%;女性患儿69例,占48.3%。随机选取同期56例年龄、性别相匹配的健康婴幼儿作为对照组,年龄在1个月至1岁,经体格检查、血常规、尿常规、大便常规、谷氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰转移酶(γ-GGT)、总胆红素(TBil),直接胆红素(DBil)、间接胆红素(TBil)水平检测结果均正常。选取同期49例年龄、性别相匹配的INH患儿作为INH组,排除先天性胆道闭锁、中毒、感染和其他已知遗传代谢性疾病(如进行性家族性肝内胆汁淤积症等),并经基因测序排除SLC25A13基因突变。本研究经本院医学伦理委员会的批准,征得患儿法定监护人同意。
1.2仪器与试剂 高效液相色谱仪(美国安捷伦公司1200系列,四元高压泵,荧光检测器),氮吹仪(天津奥德赛恩斯仪器公司,MTN2800D-24),流动相A为磷酸盐缓冲液(美国安捷伦公司),流动相B为甲醇、乙腈、水(美国西格玛公司,HPLC级),氨基酸混合标准品(美国西格玛公司),邻苯二甲醛/9-氯甲酸芴甲酯(美国安捷伦公司),Lab-Aid 820核酸提取试剂盒(厦门致善生物科技股份有限公司),SLC25A13基因引物(北京六合华大基因科技有限公司),TaKaRa Ex Taq®试剂盒[宝日医生物技术(北京)有限公司]。
1.3方法
1.3.1血浆氨基酸水平分析 清晨空腹采集受试者外周静脉血2 mL,采用乙二胺四乙酸二钠抗凝,采集后2 h内冷藏送检,常温下3 000 r/min离心5 min,吸取血浆于-20 ℃冰箱保存待测。甲醇去蛋白,取上清液,氮气吹干,水复溶后上机检测。校准曲线采用氨基酸混合标准品进行校准,采用邻苯二甲醛/9-氯甲酸芴甲酯对血浆标本进行柱前衍生化,用C18反相氨基酸柱对血浆标本进行梯度洗脱和22种氨基酸水平分析[7]。
1.3.2SLC25A13基因突变 抽取患儿静脉全血2 mL,置于乙二胺四乙酸二钠抗凝管中,轻轻摇匀后-80 ℃冰箱冻存备用。采用核酸提取试剂盒提取患儿外周血基因组DNA,采用TaKaRa Ex Taq®试剂盒进行PCR扩增,反应体系为10×Ex Taq Buffer(Mg2+plus)2.5 μL,dNTP Mixture 2 μL,Ex Taq酶0.125 μL,加双蒸水至总体积25 μL。扩增条件为95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸50 s,循环35次;72 ℃延伸10 min。取5 μL扩增产物用20 g/L琼脂糖凝胶电泳鉴定条带,确定为目的条带后,产物送至北京六合华大基因科技有限公司进行Sanger直接测序,方法参考文献[8]。
1.3.3各组氨基酸水平比较 比较各氨基酸在NICCD组、对照组、INH组间的水平差异。将所有受试者按年龄分为<6个月,6个月至1岁这两个年龄段,比较不同年龄段各组氨基酸的水平差异,分析氨基酸与年龄的相关性;按突变类型分为纯合突变组和复合杂合突变组,比较各氨基酸水平在两组间的差异。
1.4统计学处理 采用SPSS20.0软件对数据进行处理和分析。不呈正态分布的资料以M(P25,P75)表示,组间比较采用秩和检验,以P<0.05为差异有统计学意义。对明显升高或降低的氨基酸及比值进一步采用受试者工作特征(ROC)曲线分析。采用Pearson相关分析研究患者年龄与氨基酸谱水平的关系。
2 结 果
2.1143例NICCD患儿基因型结果 通过SLC25A13基因检测发现68.5%(98/143)的患儿携带纯合突变,31.5%(45/143)的患儿携带复合杂合突变。共检出SLC25A13基因突变中有15种已知致病突变,其中c.851_854del、c.851_854del/c.1638_1660dup、c.851_854del/IVS6+5G>A为热点突变,携带率分别为65.0%、11.9%、11.2%。见表1。

表1 143例NICCD患儿基因型结果[ n(%)]
2.2对照组、INH组、NICCD组22种氨基酸水平比较 与对照组、INH组比较,NICCD组患儿血浆中天冬酰胺、组氨酸、瓜氨酸、蛋氨酸、苏氨酸、酪氨酸、天冬氨酸、鸟氨酸、赖氨酸、精氨酸、丝氨酸水平均升高(P<0.05),瓜氨酸水平升高尤其明显;谷氨酰胺和色氨酸水平均明显降低(P<0.05)。见表2。
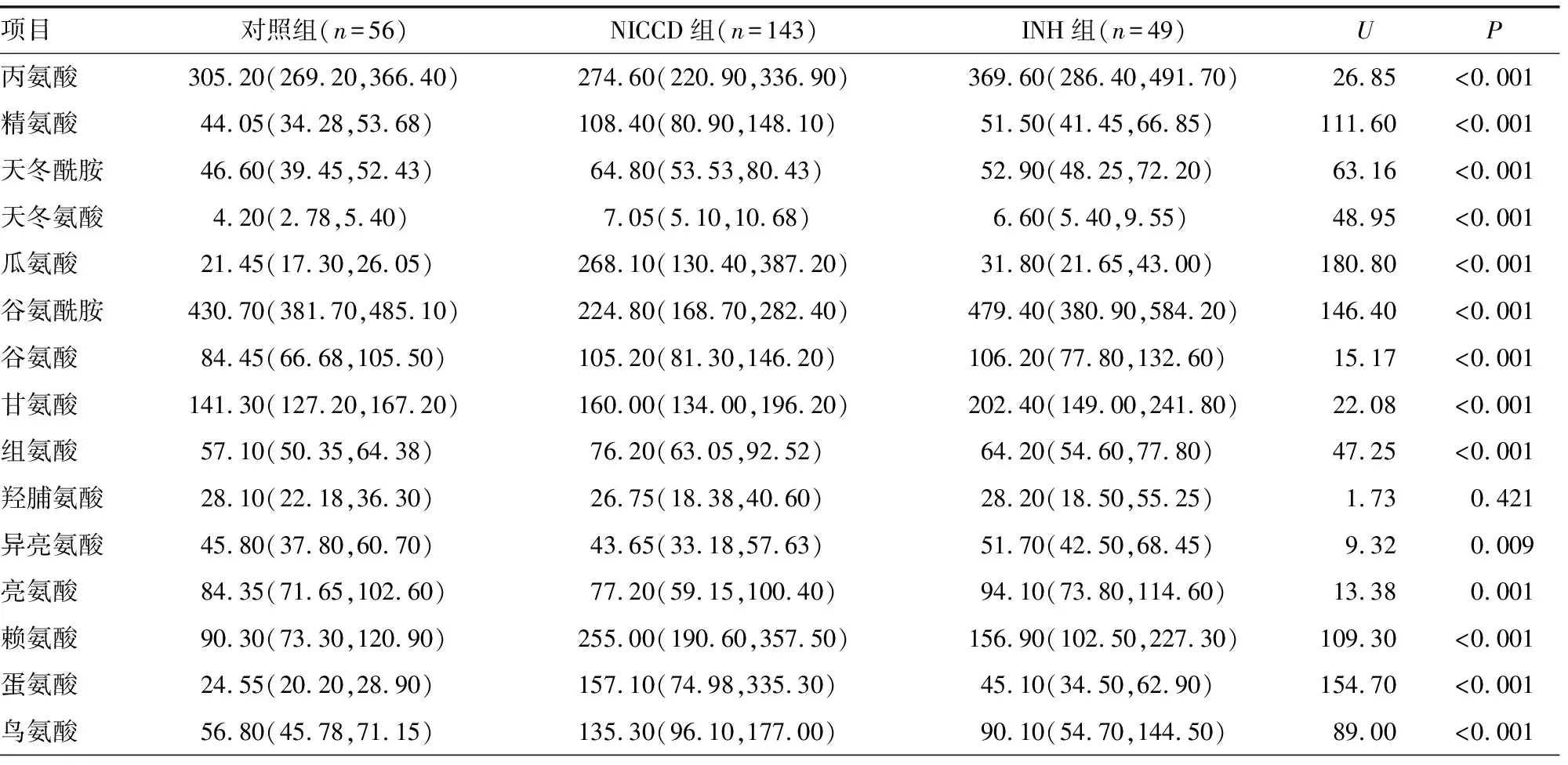
表2 对照组、INH组、NICCD组22种氨基酸水平比较[ M(P25,P75),μmol/L]
2.3对照组、INH组、NICCD组4种氨基酸比值比较 与对照组、INH组比较,NICCD组患儿血浆中瓜氨酸/丝氨酸、瓜氨酸/(亮氨酸+异亮氨酸)、苏氨酸/丝氨酸明显升高(P<0.05),见表3。
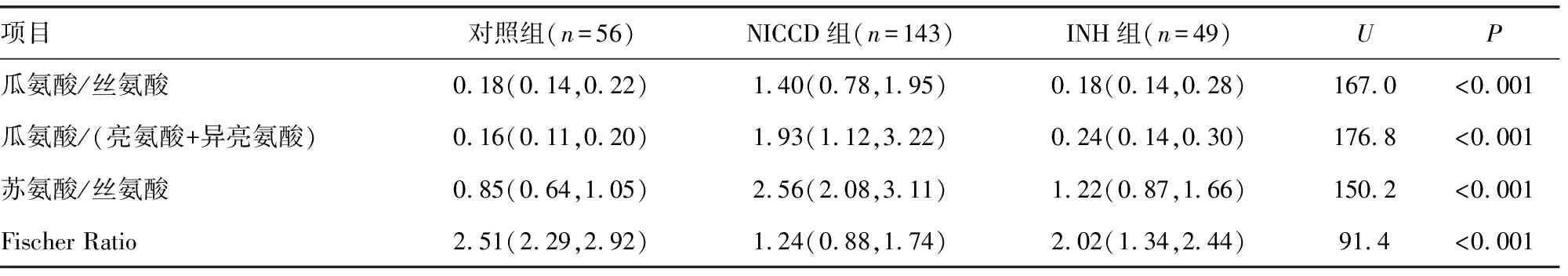
表3 对照组、INH组、NICCD组4种氨基酸比值比较[ M(P25,P75)]
2.4<6个月、6个月至1岁部分氨基酸水平比较 与<6个月的NICCD患儿比较,6个月至1岁的NICCD患儿瓜氨酸、苏氨酸、亮氨酸、异亮氨酸水平降低(P<0.05);蛋氨酸、组氨酸水平升高(P<0.05)。见图1。
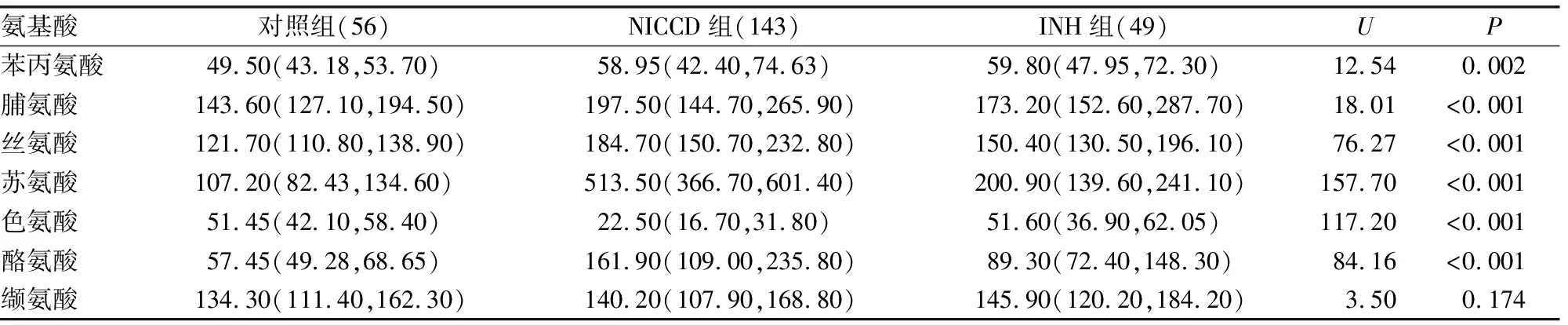
续表2 对照组、INH组、NICCD组22种氨基酸水平比较[ M(P25,P75),μmol/L]
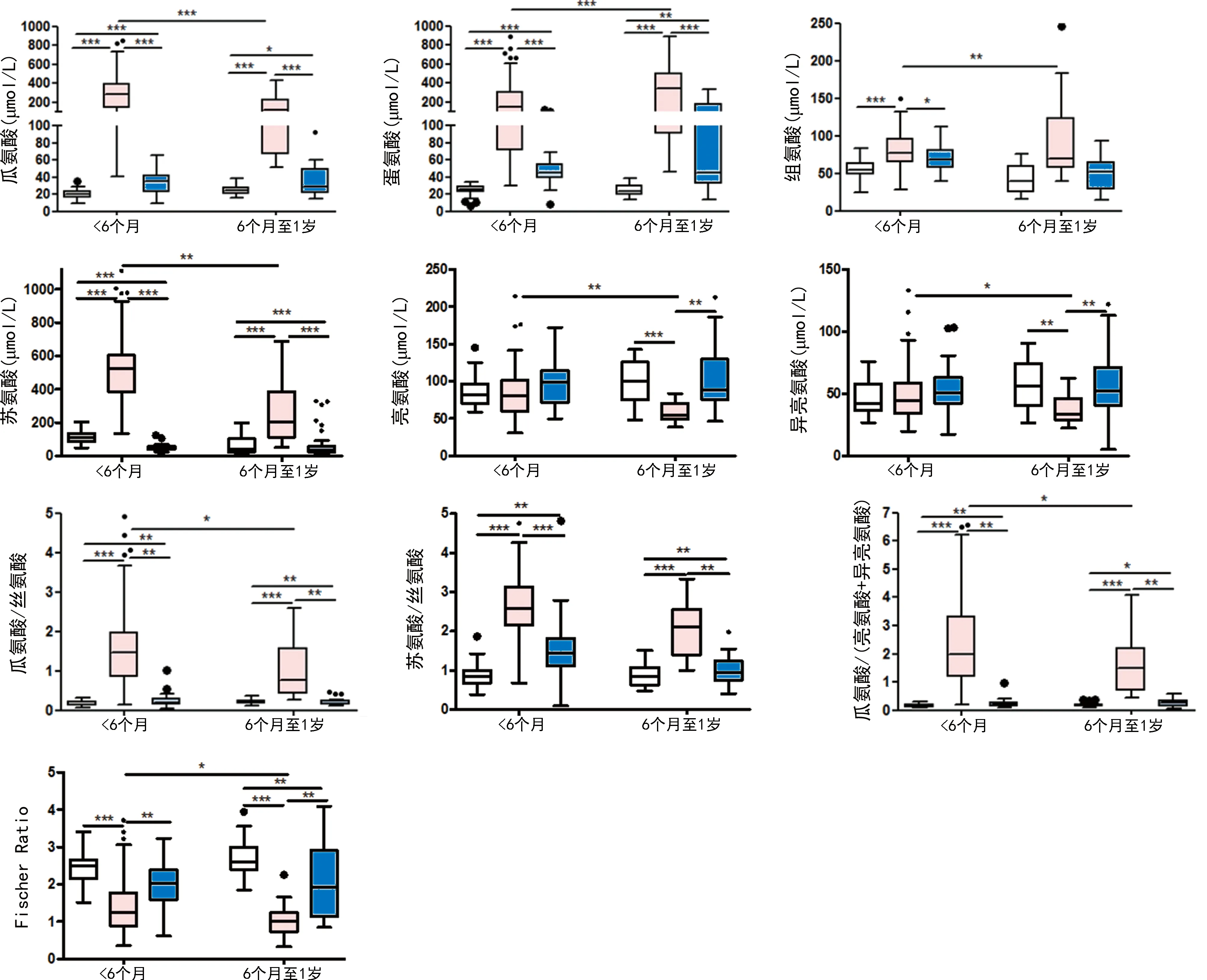
注:Fischer Ratio为(缬氨酸+异亮氨酸+亮氨酸)/(酪氨酸+苯丙氨酸);*为P<0.05;**为P<0.01;***为P<0.001;·为极端值;各年龄段从左至右依次为对照组、NICCD组、INH组。
2.5瓜氨酸与年龄的相关性 结果显示瓜氨酸与年龄呈负相关(r=-0.31,P<0.01)。
2.6部分氨基酸及比值用于NICCD诊断的ROC曲线分析 对瓜氨酸、蛋氨酸、苏氨酸、酪氨酸用于NICCD诊断的ROC曲线分析,曲线下面积(AUC)分别为0.986(95%CI0.974~0.998)、0.850(95%CI0.786~0.915)、0.899(95%CI0.849~0.949)、0.700(95%CI0.620~0.781);最佳临界值分别为66.40、70.75、329.55、111.00 μmol/L;灵敏度分别为91.0%、77.1%、82.6%、75.0%;特异度分别为98.0%、83.7%、87.8%、67.3%,见图2A。对瓜氨酸/丝氨酸、瓜氨酸/(亮氨酸+异亮氨酸)、苏氨酸/丝氨酸用于NICCD诊断进行ROC曲线分析,AUC分别为0.968(95%CI0.946~0.991)、0.984(95%CI0.970~0.998))、0.896(95%CI0.833~0.960);最佳临界值分别为0.415、0.465、1.785;灵敏度分别为91.0%、95.1%、88.9%;特异度分别为93.9%、95.9%、83.7%。Fischer Ratio的AUC为0.262(95%CI0.182~0.342);灵敏度和特异度分别为44.4%、24.5%。见图2B。
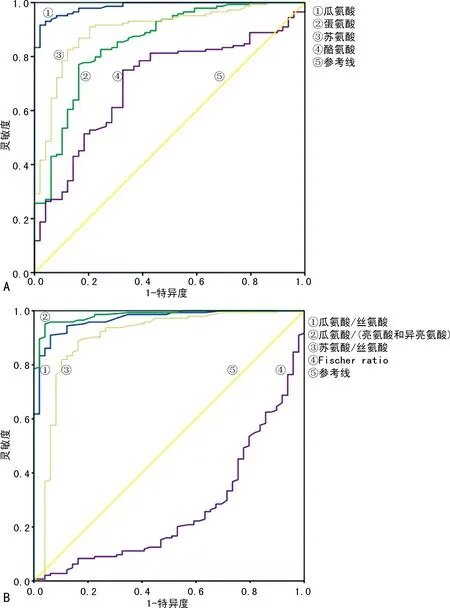
注:A为部分氨基酸用于NICCD诊断的ROC曲线分析;B为部分氨基酸比值用于NICCD诊断的ROC曲线分析。
2.7NICCD患儿纯合突变组和复合杂合突变组天冬氨酸、谷氨酸水平比较 NICCD患儿纯合突变组的天冬氨酸、谷氨酸水平比复合杂合突变组高(P<0.05),见表4。
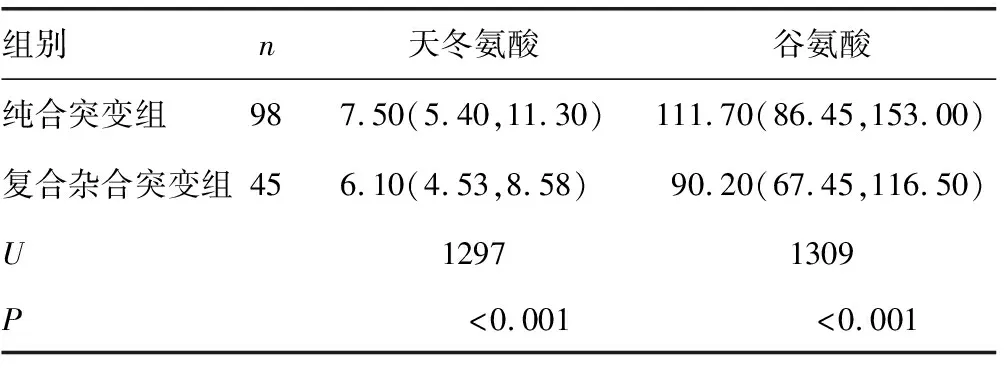
表4 NICCD患儿纯合突变组和复合杂合突变组天冬氨酸、谷氨酸水平比较[ M(P25,P75),μmol/L]
3 讨 论
有研究发现NICCD患儿血浆多种氨基酸水平异常,包括瓜氨酸水平异常升高,可作为诊断NICCD的重要线索之一[1]。但是其他原因引起的肝病也可造成继发性血浆氨基酸谱异常,因此要制订NICCD氨基酸谱的诊断标准。本研究显示与正常对照组、INH组比较,NICCD组患儿与尿素循环有关的氨基酸,包括鸟氨酸、瓜氨酸、精氨酸、天冬酰胺,天冬氨酸水平均明显升高,谷氨酰胺水平降低(P<0.05),与相关研究相符[6,9]。有研究表明,谷氨酸、谷氨酰胺水平降低与谷氨酸在三羧酸循环中的柠檬酸前体利用有关[10]。与对照组、INH组比较,NICCD组患儿生糖氨基酸,包括丝氨酸、苏氨酸、组氨酸、蛋氨酸水平均明显升高(P<0.05),与相关研究相符[6,9]。NICCD组患儿甘氨酸、丙氨酸水平较INH组降低,可能与NADH大量堆积可抑制乳酸等还原物质的糖异生过程有关,也可能与柠檬酸缺乏时丙氨酸代谢成丙酮酸,从而导致NICCD患儿低血糖有关[11-12]。与对照组、INH组比较,NICCD组患儿生酮氨基酸包括赖氨酸、酪氨酸水平升高(P<0.05),与相关研究相符[6];与对照组比较,NICCD组患儿苯丙氨酸水平升高,但与INH组比较,NICCD组患儿苯丙氨酸水平无明显变化,但NICCD组患儿色氨酸水平降低,可能与丙氨酸水平降低,需要色氨酸代谢补偿作用有关[10]。
缬氨酸、异亮氨酸、亮氨酸这些支链氨基酸降解为琥珀酰辅酶A和(或)乙酰辅酶A,主要在骨骼肌中产生能量。SAHEKI等[12]报道NICCD患儿支链氨基酸水平降低。本研究中与对照组比较,NICCD组患儿缬氨酸、亮氨酸、异亮氨酸水平无明显变化,可能与研究对象大部分年龄<6个月,处于疾病早期有关,未出现支链氨基酸分解代谢。NICCD患儿的异亮氨酸、亮氨酸、缬氨酸水平较INH组明显降低,提示NICCD患儿支链氨基水平的特征性变化可能与患儿长期低血糖出现代谢补偿作用有关[12]。本研究的NICCD患儿瓜氨酸水平与年龄呈负相关,与SAHEKI等[12]研究相符。但本研究NICCD患儿苏氨酸水平在6个月至1岁较<6个月水平降低,而蛋氨酸水平在6个月至1岁较<6个月升高。CHEW等[13]研究发现,有部分患儿分别在14个月、16个月甚至在22个月蛋氨酸水平才出现缓解。因此,在分析氨基酸谱时,若瓜氨酸水平没明显升高,但蛋氨酸、苏氨酸水平出现明显变化仍需结合年龄考虑NICCD的可能,进一步行SLC25A13基因分析。
本研究显示瓜氨酸、蛋氨酸、苏氨酸、酪氨酸具有较好的诊断价值,能区分NICCD和其他疾病因引起的婴儿胆汁淤积症,与相关研究相符[9]。其中以瓜氨酸诊断价值最高,瓜氨酸水平为66.40 μmol/L时,灵敏度和特异度分别为91.0%、98.0%。TAMAMORI等[14]发现在进行新生儿筛查时瓜氨酸/丝氨酸、瓜氨酸/(亮氨酸+异亮氨酸)有更好的诊断价值。而本研究也发现瓜氨酸/(亮氨酸+异亮氨酸)的诊断价值较高。由此可见,氨基酸比值可提高诊断灵敏度和特异度。本研究共检出SLC25A13基因突变15种,其中c.851_854del占比为65.0%,该突变目前在我国南方是SLC25A13突变携带者最常见的突变类型[2]。纯合突变组的NICCD患儿天冬氨酸、谷氨酸水平较复合杂合突变组高(P<0.05),其原因可能为不同的SLC25A13基因突变对Citrin蛋白功能造成的影响不同,下一步需从蛋白水平证实以上假设。
综上所述,血浆氨基酸谱分析是筛查和诊断NICCD的一种灵敏、快速的方法,其中较为灵敏的诊断指标为瓜氨酸和瓜氨酸/(亮氨酸+异亮氨酸);NICCD患儿瓜氨酸水平变化与年龄有关。

