一株产细菌素植物乳杆菌的筛选及其所产细菌素特性研究*
崔子杭,孙 昊,唐海峰,刘 欢,盘赛昆,杨 杰
(江苏海洋大学 食品科学与工程学院,江苏 连云港 222005)
近年来,群体性食品微生物中毒事件屡屡发生[1],越来越多的消费者开始注重天然、绿色环保的生物保藏食品[2],这改变了以往食品防腐剂以化学抗菌剂为主的格局。探索天然安全的抗菌物质作为食品防腐剂越来越为人们所重视,生物食品抗菌剂代替化学食品抗菌剂逐渐成为研究热点。
作为一种生物安全菌株,乳酸菌因可以产生有机酸、细菌素等具有抑菌活性的物质[3]而在食品保藏领域受到极大关注,其产生的细菌素是由核糖体合成的、有抗菌活性的小分子多肽[4],具有良好的热稳定性。将细菌素添加到食品保藏中,不仅不会对食品产生不良影响,还能够延缓食品变质或病原体生长,同时改善传统保存方法存在的营养成分流失、致癌终产物形成和食品风味改变等问题[5]。大多数细菌素的分子量小于10 kDa,对同种或近源的其他食品致病菌具有抗菌活性[6]。研究表明,几乎所有乳酸菌都能产生细菌素,其中乳酸链球菌素Nisin已被应用于食品生产。
植物乳杆菌(Lactiplantibacillusplantarum)是自然界广泛分布的一种乳酸菌,目前已应用于食品保健等领域。与其他种类的乳酸菌相比,植物乳杆菌在发酵过程中能产生多种细菌素,对胃肠道应激以及其他各种应激具有良好的耐受性。植物乳杆菌细菌素因具有广谱的抑菌活性和安全降解性而成为新型生物防腐剂研究的重点[7]。然而,植物乳杆菌细菌素的分离纯化难度较大,所以需要在前期筛菌时投入大量资源和精力[8]。本研究从家庭自制泡菜卤水中分离出可拮抗致病菌的乳酸菌,以求得到一株天然拮抗菌株,拟通过醇沉法、有机溶剂萃取法、凝胶过柱和反向高效液相色谱法等对植物乳杆菌所产生的拮抗物质进行分离纯化,并通过研究所产拮抗物质的性质,为新型食品防腐剂的开发奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 样品 样品取自贵州省黔东南苗族侗族自治州农家自制泡菜卤水,无菌环境下取样。
1.1.2 指示菌 金黄色葡萄球菌(Staphylococcusaureus)CICC 23656,腐败希瓦氏菌(Shewanella)ATCC 49138,大肠杆菌(Escherichiacoli)CICC 10003,蜡样芽孢杆菌(Bacilluscereus)CICC 23828。
1.1.3 培养基和试剂 乳酸菌专用培养基MRS培养基、LB培养基。
硫酸铵,无水乙醇,pH 6.0磷酸缓冲液,乙酸乙酯,色谱级甲醇,Sephadex G50,Sephadex LH-20,1 mol/L盐酸,1 mol/L氢氧化钠,均为国产分析纯。过氧化氢酶200 000 U/mg,蛋白酶K 30 U/mg,胰蛋白酶250 U/mg,胃蛋白酶3 000 U/g,购自阿拉丁生化科技股份有限公司。乳酸菌生理生化鉴定试剂盒购自海博生物技术有限公司。
1.1.4 仪器和设备 YXQ-LS-50SI立式压力蒸汽灭菌器,上海讯博实业有限公司医疗设备厂;DK-S24型电热恒温水浴锅,上海精宏实验设备有限公司;DHG-9240A电热恒温鼓风干燥箱,上海一恒科技有限公司;DNP-9126型电热恒温培养箱,上海精宏实验设备有限公司;PHS-3CW Microprocessor pH/mV Merer,上海理大智能电子有限公司;SBS-160数控计滴自动部分收集器,上海沪西分析仪器厂有限公司;DNL-N电脑数显定时恒流泵,上海沪西分析仪器厂有限公司;D-37520高速冷冻离心机,美国赛默飞世尔科技有限公司;3730XL测序仪,美国ABI;SH2-D(Ⅲ)循环水式真空泵,上海越众仪器设备有限公司;RE52-AA旋转蒸发仪,上海亚荣生化仪器厂。
1.2 方法
1.2.1 具有拮抗作用的乳酸菌的分离筛选与鉴定
(1)植物乳杆菌的分离与筛选。将卤水样品滤液以体积分数1%的接种量接种到MRS液体培养基中,37 ℃富集培养24 h。将样品分别稀释至10-4,10-5,10-6,10-7,10-8,涂布于MRS固体培养基平板,37 ℃培养12 h。挑取表面光滑圆润的单菌落接种到MRS液体培养基中发酵48 h,4 ℃条件下8 000 r/min离心20 min得到无细胞上清液[9]。根据抑菌试验筛选出抑菌效果较强的乳酸菌。
(2)具有拮抗作用的植物乳杆菌发酵液抑菌活性的测定。采用打孔法[10]进行抑菌实验。菌株接种前,用无菌生理盐水调整菌体浓度至OD600 nm=0.5。以大肠杆菌、蜡样芽孢杆菌、金黄色葡萄球菌和腐败希瓦氏菌为指示菌(指示菌在活化时,需在LB固体培养基上划线,并传代至5 mL LB液体培养基中),在37 ℃,180 r/min条件下培养12 h,取1 mL接种到100 mL LB液体培养基中,后取100 μL涂布到LB固体培养基上,待菌液晾干后,用打孔器打孔,向孔中加入发酵上清液原液,用量80 μL/孔,设3组平行试验[11],37 ℃条件下培养 12 h。抑菌活性以抑菌圈直径大小为参照[12]。获得的具有抑菌活性的菌株保存于40%甘油管中,-80 ℃冰箱可长期保存[13]。
(3)具有拮抗作用的植物乳杆菌的形态学和生理生化鉴定。通过革兰氏染色对分离的菌株进行初步鉴定,根据《伯杰氏细菌鉴定手册》对筛选出的菌株进行形态观察,并采用生理生化试剂盒对菌株进行生理生化鉴定[14]。
(4)具有拮抗作用的植物乳杆菌的16S rDNA鉴定。利用细菌基因组快速提取试剂盒提取菌株的基因组DNA,运用通用引物进行16S rDNA扩增[15]。聚合酶链反应(PCR)通用引物为27F和1 492R。PCR扩增方法采用常规法,反应程序为:94 ℃预变性5 min;94 ℃变性30 s;54 ℃退火30 s;72 ℃延长90 s和35个循环;72 ℃最终扩展5 min。PCR产物用1%琼脂糖凝胶进行电泳[16],观察结果并拍照。将PCR扩增的目的基因片段送至南京斯普林食品有限公司进行序列检测。将序列与GENBANK数据库中的序列进行比较,并用MEGA 7.0软件对16S rDNA序列进行比较分析,构建系统发育树[17]。
(5)具有拮抗作用的植物乳杆菌的生长曲线及pH测定。菌株接种前,用无菌生理盐水调整菌体浓度至OD600 nm=0.5。以体积分数1%的接种量接种在MRS液体培养基中,37 ℃培养72 h,每隔2 h取样。以空白MRS液体培养基为对照,在波长600 nm下测定吸光度,同步测定pH。
(6)不同浓度NaCl对植物乳杆菌生长的影响。将菌株以体积分数1%接种量分别接种到NaCl质量分数为0,4%,8%,12%,16%的MRS液体培养基中[13],于37 ℃培养箱培养,分别在4,8,12,24,36,48 h取样,用紫外分光光度计在600 nm波长下测定生长情况。
1.2.2 植物乳杆菌活性成分的分离纯化
(1)醇沉法。取甘油管中保藏的菌株进行三区划线活化,挑选单菌落转入MRS液体培养基中,37 ℃培养12 h后以体积分数1%接种量接入到1 L的MRS液体培养基中。37 ℃培养箱中发酵48 h,8 500 r/min离心20 min,得无细胞上清液[18]。旋蒸上清液至原体积的1/10,加入无水乙醇,使无水乙醇体积分数为75%,充分搅拌均匀。于4 ℃条件下静置过夜,8 500 r/min离心20 min,继续浓缩上清液至1/5体积,去除大量乙醇浓缩至原发酵液体积,所得旋蒸液中的乙醇回收。选择未处理的浓缩发酵液为对照,以醇沉后的浓缩上清液和醇沉后的沉淀为待测样品,以蜡样芽孢杆菌、金黄色葡萄球菌、大肠杆菌作为指示菌,采取打孔法测其活性。每组样品参考3个平行试验,经醇沉水提得到的粗提液约100 mL,置于冰箱4 ℃储存备用。
(2)有机溶剂萃取法。加入醇沉上清液两倍体积的乙酸乙酯,充分摇匀后转至分液漏斗静置4 h,将有机相旋蒸干后用pH 6.0磷酸缓冲液复溶,所得旋蒸液中的乙酸乙酯回收利用。重复以上步骤萃取6次,合并萃取所得有机相,用0.22 μm有机系滤膜过滤,获得粗提液放置于冰箱4 ℃保存备用。
(3)Sephadex G50凝胶层析柱纯化。将乙酸乙酯萃取液用葡聚糖凝胶Sephadex G50层析柱(直径2.0 cm×柱高80 cm)对有机溶剂萃取后的粗提液进一步分离纯化,洗脱液选用蒸馏水洗脱,流速0.5 mL/min。使用自动收集器收集馏分,设置每管5 min,使用打孔法测定每组馏分的抑菌活性,将有活性的组分收集浓缩,用0.22 μm有机系滤膜过滤,获得粗提液放置冰箱4 ℃保存备用。
(4)Sephadex LH-20凝胶层析柱纯化。经Sephadex G50层析后的样品再用葡聚糖凝胶Sephadex LH-20层析柱(直径2.0 cm×柱高80 cm)进行层析纯化,洗脱液选用80%色谱级甲醇进行洗脱,流速0.5 mL/min。通过打孔法测定每个组分的抑菌活性。将显示有抑菌活性的部分汇集并进行浓缩,使用0.22 μm有机系滤膜过滤,进一步采用反相高效液相色谱(RP-HPLC)纯化。
(5)RP-HPLC纯化。将20 μL样品注入配备有分析柱的RP-HPLC来测试植物乳杆菌活性成分纯度[19]。使用分析柱对样品进行分析后改用制备柱收集样品。色谱柱:Agilent C18柱(5 μm,250 mm×4.6 mm);洗脱条件:线性双相梯度洗脱(A:超纯水,B:甲醇);洗脱梯度为A:90%—5%,B:10%—95%;洗脱时间:35 min;流速:0.5 mL/min;检测器:光电二极管分离阵列检测器;检测波长:280 nm;进样量:100 μL[20]。收集每个峰进行活性检测,确定有活性的峰。以活性物质发酵上清液为对照,用打孔法检测抑菌活性。
1.2.3 植物乳杆菌活性成分的理化性质研究
(1)排除乳酸对植物乳杆菌的影响研究。取植物乳杆菌粗提液1 mL至10 mL离心管中,用1 mol/L的NaOH分别调节pH至4.5,5.0,5.5,6.0,6.5,7.0[21],以未调节pH的粗提液作为对照,使用打孔法检测抑菌活性。
(2)植物乳杆菌蛋白酶的稳定性研究。取植物乳杆菌粗提液1 mL至10 mL离心管中,分别配置蛋白酶K、胃蛋白酶、胰蛋白酶的酶溶液,质量浓度为5 mg/mL[19]。将粗提液的pH调至各酶最适合生长的pH范围内(蛋白酶K:7.5~8.0,胰蛋白酶:8.0~8.5,胃蛋白酶:1.5~2.0)。取酶溶液0.1 mL混匀至0.4 mL的粗提液中,水浴4 h后将其调回初始pH,以未进行处理的粗提液作为对照,使用打孔法检测抑菌活性。
(3)植物乳杆菌的热稳定性研究。取植物乳杆菌粗提液1 mL至10 mL离心管中,分别在60 ℃,80 ℃,121 ℃温度下处理30 min[22]。取出冷却至室温,以未进行加热的粗提液作为对照[23],使用打孔法检测抑菌活性。
1.2.4 统计分析 所有试验均设3次重复。采用SPSS 20统计学进行显著性分析,利用Tukey法进行单因素方差分析(ANOVA),显著性差异在P<0.05水平上。采用Origin 2021绘图,所有数据结果均以平均值±标准差表示。
2 结果与分析
2.1 农家发酵食品中具有抑菌活性的乳酸菌的分离与筛选
从贵州省农家发酵泡菜卤水中分离纯化获得108株分离物,经初筛复筛后得到3株抑菌活性较强的乳酸菌,分别编号为L17,C19和MMB-08。以腐败希瓦氏菌、金黄色葡萄球菌、大肠杆菌和蜡样芽孢杆菌为指示菌进行抑菌实验,结果见表1。

表1 菌株L17,C19和MMB-08对4种指示菌抑菌活性测定
MMB-08菌株对4种指示菌的抑菌圈直径分别为(11.75±0.35)mm,(10.3±0.71)mm,(10.2±0.42)mm,(8.3±0.28)mm,与其他菌株相比,MMB-08对4种指示菌的抑制活性较显著。因此,选择MMB-08作为目的菌株进行后续试验。
2.2 菌株MMB-08的形态学鉴定
如图1所示,菌株MMB-08在MRS平板上培养24 h后,菌落形态为乳白色,不透明,边缘规则,表面光滑。经革兰氏染色观察,菌株呈短杆状或弯曲杆状,无孢子和鞭毛,呈紫色,表明该菌株为革兰氏阳性菌[24]。

注:A为菌落形态;B为革兰氏染色结果;C为蜡样芽孢杆菌阳性对照;D为大肠杆菌阴性对照。
2.3 菌株MMB-08的生理生化鉴定
菌株MMB-08的生理生化鉴定结果见表2。明胶液化试验结果呈阴性,可发酵棉子糖、甘露糖、海藻糖等多种糖。根据《伯杰氏细菌鉴定手册》,可初步鉴定该菌株为植物乳杆菌属。

表2 菌株MMB-08的生理生化鉴定结果
2.4 菌株MMB-08的16S rDNA序列分析与系统发育树构建
如图2所示,菌株MMB-08的16S rDNA在约1 500 bp处出现明亮条带,测序结果为1 463 bp。通过BLAST程序建立发育树对比显示,该菌株序列与植物乳杆菌(Lactiplantibacillusplantarum)序列相似性为100%,初步认为筛选得到的MMB-08菌株为植物乳杆菌(Lactiplantibacillusplantarum),命名为L.plantarumMMB-08。系统发育树如图3所示,显示菌株MMB-08与植物乳杆菌在同一分支,证明该菌株为植物乳杆菌(Lactiplantibacillusplantarum)。

图2 菌株MMB-08电泳图
2.5 L. plantarum MMB-08生长曲线及生长过程中pH的变化
植物乳杆菌L.plantarumMMB-08的生长状况以及pH变化如图4所示,从延滞期到衰亡期,pH从6.0降至4.0,说明其发酵过程中不断产酸,到达稳定期后产酸基本保持不变。4~10 h菌株进入对数生长前期,10~12 h进入对数生长后期,20 h以后进入稳定生长期,生长速度逐渐缓慢,48 h后菌株进入衰败期,pH逐渐趋于平稳,发酵结束pH为4.0±0.14,表明菌株在发酵期间能够达到快速生长并产酸,使pH降低。
2.6 L. plantarum MMB-08耐盐性研究
具备良好耐盐性的菌株对食品防腐等有重要作用,在食品行业中可以应用于高盐食品的生产[25]。L.plantarumMMB-08耐盐性如图5所示,随着NaCl质量分数的增加,OD值随之降低,生长繁殖受到抑制,在NaCl质量分数为4%和8%时生长较好,在质量分数12%和16%下OD值有所降低,较高浓度的NaCl抑制了乳酸菌的生长。
2.7 L. plantarum MMB-08活性物质的分离纯化
使用醇沉法对L.plantarumMMB-08分离纯化,结果见表3。醇沉得到的上清液粗提物具备明显抑菌活性,其沉淀无活性,说明醇沉法适用于分离纯化前期的粗提。
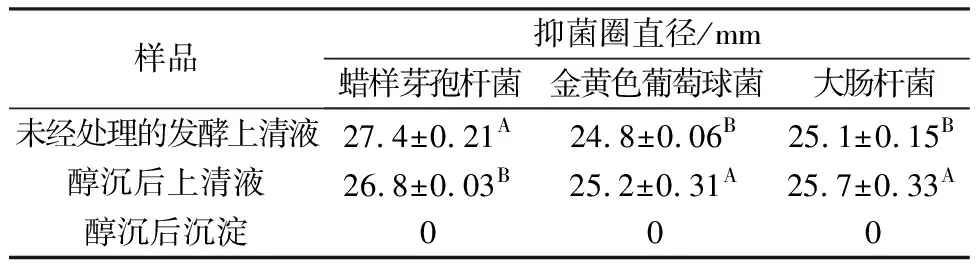
表3 L. plantarum MMB-08醇沉粗提物质抑菌活性
2.7.1 有机溶剂萃取分离活性物质 用乙酸乙酯萃取法对活性物质进一步分离提纯,结果见表4。对醇沉液重复萃取6次后,水相对蜡样芽孢杆菌的抑菌活性逐渐降低,直到第5次萃取后,水相中残留活性物质不再发生变化,即确定萃取次数为6次。
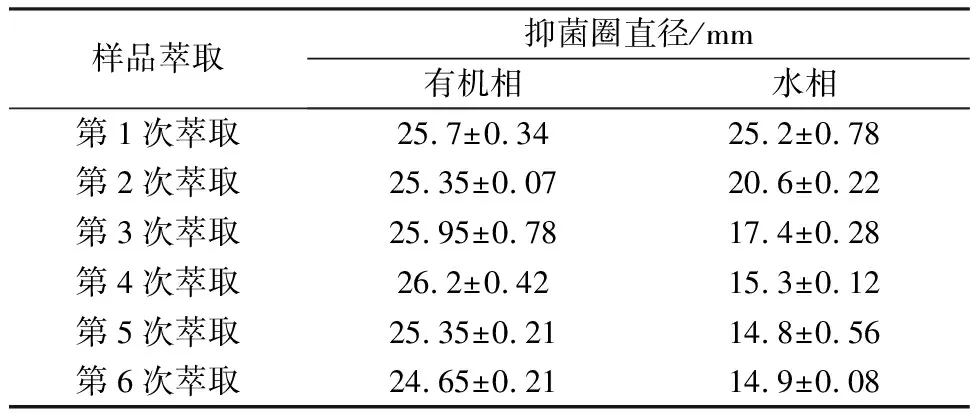
表4 乙酸乙酯萃取L. plantarum MMB-08的抑菌活性
2.7.2 凝胶层析柱纯化 发酵上清液经乙酸乙酯萃取后,经Sephadex G50凝胶层析得到的馏分采取打孔法测其活性。15到25管馏分具备明显抑菌活性(见图6a),将这些活性物质收集合并,再经Sephadex LH-20凝胶层析,检测到65到81管馏分具备明显抑菌活性(见图6b)。该抑菌活性馏分在波长280 nm下有明显的紫外吸收峰,所以选用280 nm作为高效液相色谱仪的检测波长。

a Sephadex G-50
2.7.3 RP-HPLC纯化 将层析柱纯化后的活性物质使用RP-HPLC进行全波长分析,结果如图7所示。在280 nm下共检测到7个单峰,将各峰的馏分分离收集,其中,峰3具备显著活性,保留时间为24.824 min。L.plantarumMMB-08的发酵上清液分别经醇沉,乙酸乙酯萃取,Sephadex G-50,Sephadex LH-20层析和RP-HPLC纯化,得到有抑菌活性的细菌素MMB-08。
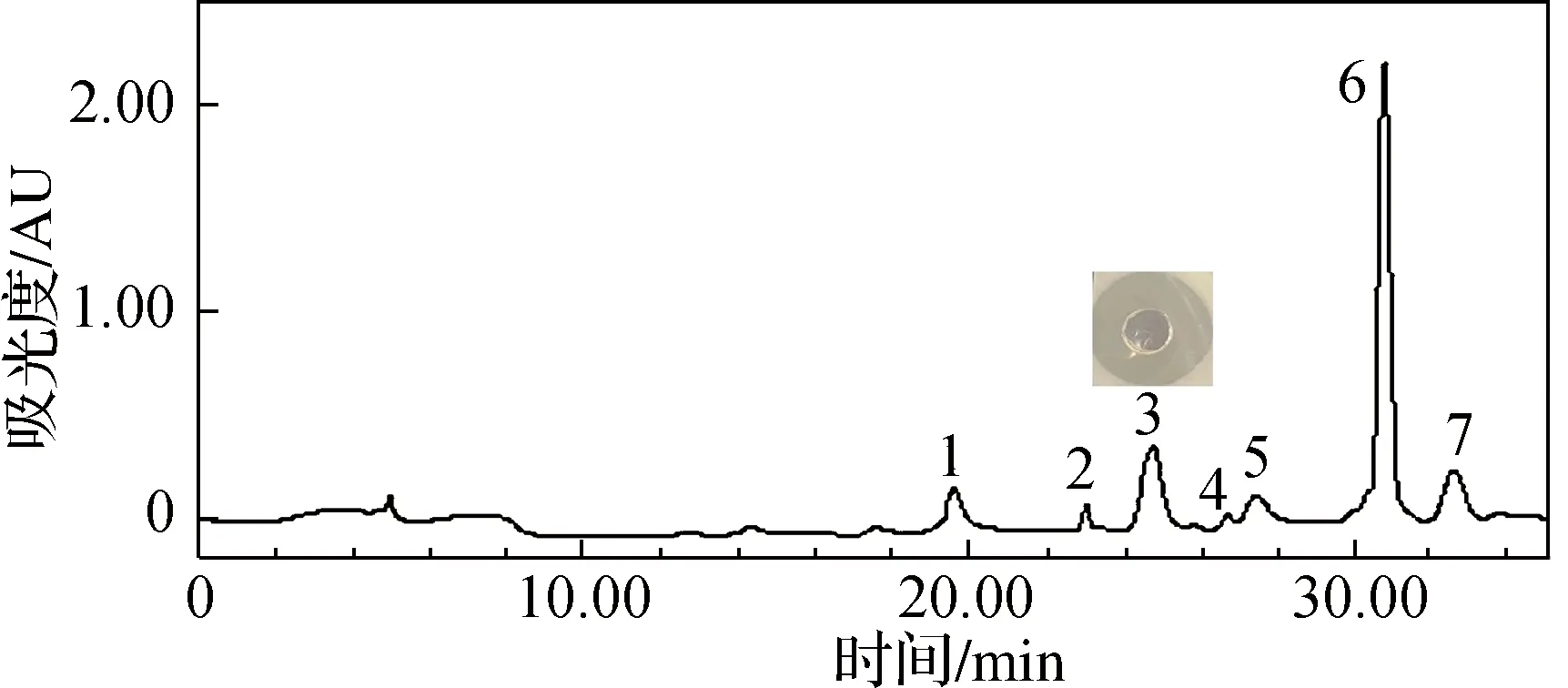
图7 L. plantarum MMB-08 HPLC洗脱峰的活性检测
2.8 细菌素MMB-08的性质研究
2.8.1 排除乳酸对细菌素MMB-08 的影响 对细菌素MMB-08的乳酸排除结果如图8所示,乳酸在pH=6.0时失去活性。为了排除酸性物质的干扰,将pH调至7.0检测抑菌活性,结果表明此时抑菌活性依然存在,说明发酵上清液中不仅含有乳酸,还有细菌素等。

注:小写字母表示组内显著性差异(P<0.05)。
2.8.2 细菌素MMB-08的蛋白酶稳定性 细菌素MMB-08的蛋白酶稳定性测定结果如图9所示。与对照相比,细菌素MMB-08经胰蛋白酶、胃蛋白酶、蛋白酶K处理过后活性降低,分别降低28.5%,38.4%,36.4%,说明抗菌物质能够被蛋白酶降解而不会残留在人体内,是一种安全可降解的抗菌物质。

图9 细菌素MMB-08的蛋白酶稳定性
2.8.3 细菌素MMB-08的热稳定性 细菌素MMB-08的热稳定性测定结果如图10和图11所示。对其进行60 ℃ 30 min,80 ℃ 30 min,121 ℃ 30 min的不同处理,细菌素MMB-08在60 ℃时几乎不受影响,80 ℃处理30 min后能保留94.3%的活性,121 ℃处理30 min后仍能保留84.5%的活性,表明细菌素MMB-08具有良好的热稳定性。

图10 细菌素MMB-08的热稳定性试验结果
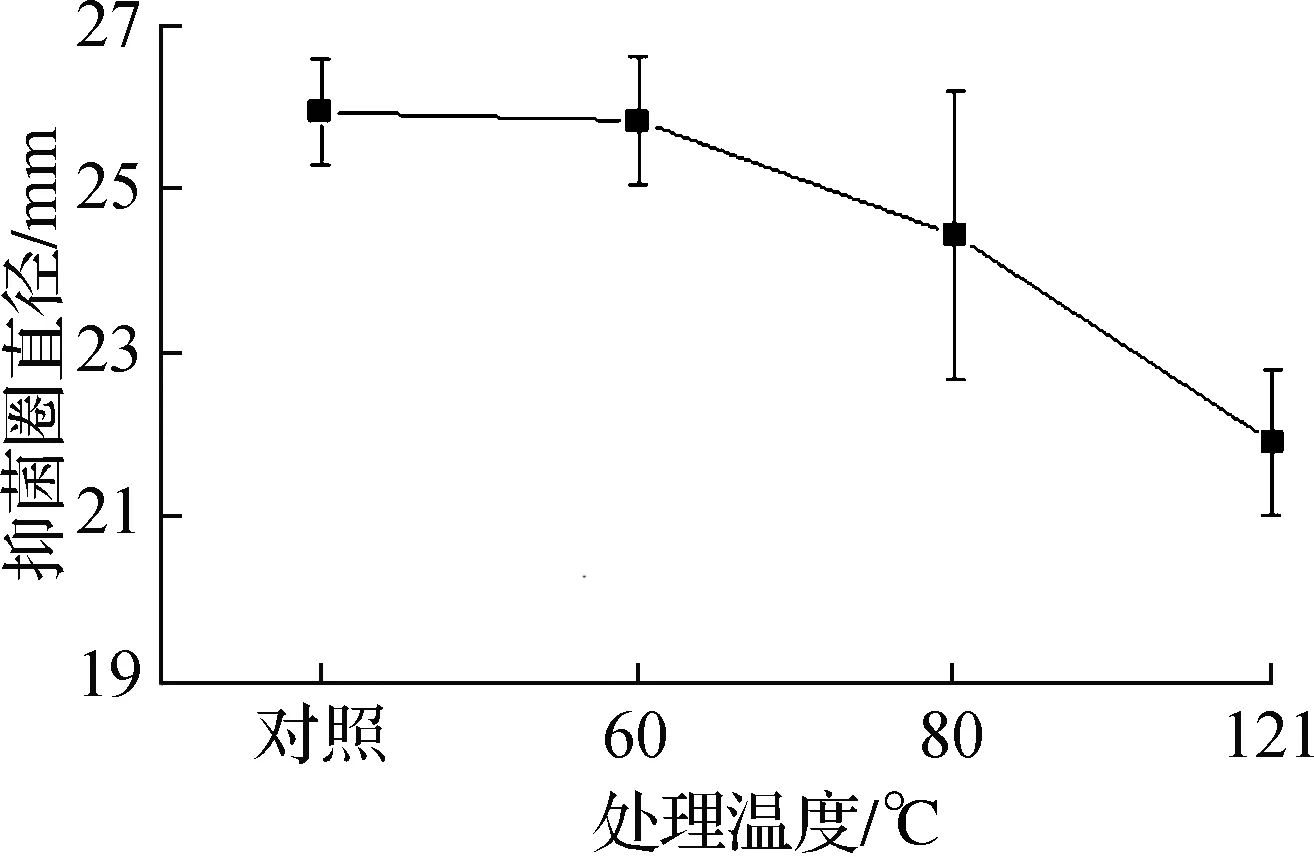
图11 细菌素MMB-08的热稳定性
3 讨论
目前乳酸链球菌素Nisin已经应用到食品行业中,但Nisin抗菌谱较窄,仅能针对革兰氏阳性菌[26],因此迫切需要开发出具有广谱抑菌效果的细菌素。本研究从贵州发酵食品中筛选到一株具有良好抑菌活性的植物乳杆菌,通过抑菌实验发现,其对常见的两种革兰氏阳性菌(金黄色葡萄球菌、蜡样芽孢杆菌)具有明显抑制效果,抑菌圈直径分别达到(10.3±0.71)mm和(8.3±0.28)mm;同时,其对两种革兰氏阴性菌(大肠杆菌、腐败希瓦氏菌)的抑制效果也同样显著,直径分别达到(11.75±0.35)mm和(10.2±0.42)mm。因此可以认为筛选得到的MMB-08菌株为植物乳杆菌(Lactiplantibacillusplantarum),命名为L.plantarumMMB-08。L.plantarumMMB-08在食品防腐和病原菌控制方面具有较大应用潜力。
细菌素的分离纯化一般采取硫酸铵沉淀、有机溶剂萃取、凝胶层析以及反向高效液相色谱法等。张漫敏等[27]通过硫酸铵沉淀、有机溶剂萃取、pH吸附解吸、凝胶层析和反向高效液相色谱法得到L.plantarumC010。Zhu等[28]通过阳离子交换色谱、凝胶色谱和反相高效液相色谱法从鲜牛奶中分离出产细菌素的植物乳杆菌L.plantarumZJ008。本文在L.plantarumMMB-08产物的提取与纯化中,使用了醇沉法、乙酸乙酯萃取法以及凝胶层析和反向高效液相色谱法。L.plantarumMMB-08发酵液中除了存在细菌素以外,还存在各种酸性物质、过氧化氢等抑菌物质[29]。为了排除酸性物质的干扰,将L.plantarumMMB-08发酵液的pH调到7.0后进行抑菌活性测定,结果表明,pH=7.0的L.plantarumMMB-08发酵液仍存在一定的抑菌效果,说明发酵上清中不仅含酸,还含有细菌素等。
相较于其他植物乳杆菌提取的抗菌物质,细菌素MMB-08的耐热性也较为突出。高鹏[30]研究的细菌素JL-A65虽具有广谱抑菌效果,但在温度达到90 ℃处理10 min后抑菌活性急剧下降,处理30 min后已无抑菌活性。而细菌素MMB-08在121 ℃30 min后仍能保留84.5%的抑菌活性,这也说明L.plantarumMMB-08所产细菌素相较于其他细菌素应用范围更广,在热加工食品的防腐保鲜领域具有较好的应用前景。
另外,本研究对细菌素的利用率较低,在1 L发酵液中最终获得细菌素提取物仅10 mL,占整体体积的1%。提取物在凝胶层析中以及高效液相色谱中都有一定程度的损失,且实验过程中仅选取抑菌活性最高的部分用于细菌素下一步分离纯化,后续研究将注重细菌素的提取率,优化分离纯化条件,为细菌素的实际生产应用奠定理论基础。
4 结论
本研究从云贵高原地区的农家发酵食品中筛选到一株具有较强抑菌活性的菌株,并对该菌株进行了生理生化鉴定及分子生物学鉴定,结果表明,该菌株为L.plantarum,将其命名为L.plantarumMMB-08。对L.plantarumMMB-08所产抑菌物质进行分离纯化,分别经醇沉、乙酸乙酯萃取、Sephadex G-25和Sephadex LH-20凝胶柱层析,最后经反相高效液相色谱分析得到一个有抑菌活性物质的单峰,名为细菌素MMB-08,保留时间在24.824 min。此外,相关的性质研究还发现,L.plantarumMMB-08所产细菌素具有较好的热稳定性,可以应用于热加工食品的防腐保鲜。

