丁苯酞与鼠神经生长因子联合双抗疗法治疗老年急性脑梗死患者的疗效及机制▲
徐 冰 焦丽强 闫致旺 常玲玲 林维龙
(1 张家口市第二医院急诊科,河北省张家口市 075000; 2 中国人民解放军陆军第81集团军医院门诊部,河北省张家口市 075001; 3 河北北方学院附属第一医院临床医学科,河北省张家口市 075006)
急性脑梗死(急性缺血性脑卒中)是一种急性血栓性疾病,是供血动脉(椎动脉和颈动脉)狭窄或闭塞后脑供血不足导致的脑组织坏死的总称。调查显示,我国急性脑梗死住院患者发病后1年的致残率和致死率分别高达33.4%~44.6%、14.4%~15.4%,老年患者预后更差[1],给家庭和社会带来沉重的负担。抗血小板治疗是急性脑梗死患者抗栓治疗的基础,目前临床上常用的抗血小板药物有阿司匹林、氯吡格雷、替格瑞洛等,其中双联抗血小板治疗(阿司匹林+氯吡格雷,以下简称双抗疗法)是当前急性脑梗死患者抗血小板治疗的首选方案[2]。
丁苯酞是一种可以改善脑部血液循环的药物,通过保护血管内皮细胞、清除氧自由基、抑制谷氨酸释放等途径,作用于脑缺血的多个病理环节,从而促进急性脑梗死患者受损神经功能的恢复,提高患者的生活自理能力[3]。鼠神经生长因子是一种神经保护剂,具有促进受损神经修复、保护神经元胞体存活、加速轴突定向再生等生物学效应,对脑血管疾病具有良好的治疗效果[4]。大量研究表明,急性脑梗死的发生、发展与患者血栓前状态指标和血清氧化型LDL(oxidized LDL,ox-LDL)、可溶性细胞间黏附分子-1(soluble intercellular adhesion molecule-1,sICAM-1)、一氧化氮的表达水平有关[5-7]。丁苯酞与鼠神经生长因子联合双抗疗法对老年急性脑梗死患者血栓前状态指标及血清ox-LDL、sICAM-1和一氧化氮水平的影响如何,目前鲜见报告。本研究采用丁苯酞与鼠神经生长因子联合双抗疗法治疗老年急性脑梗死患者,观察其临床疗效,探讨其对血栓前状态指标、ox-LDL、sICAM-1、一氧化氮表达水平的影响,旨在探寻老年急性脑梗死更佳的治疗方案。
1 资料与方法
1.1 临床资料 选取2019年1月至2021年5月张家口市第二医院收治的150例老年急性脑梗死患者作为研究对象。纳入标准:(1)满足急性脑梗死诊断标准(参照《中国急性缺血性脑卒中诊治指南2018)》[8]);(2)入院时意识清醒,5分≤美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分≤25分;(3)年龄60~80岁;(4)既往对本研究所用药物无过敏史;(5)患者及其家属知情并自愿签订知情同意书;(6)发病至入院时间≤48 h;(7)首次发病,既往无脑卒中病史。 排除标准:(1)近30 d内有任何活动性出血史的患者;(2)合并难以控制的糖尿病或高血压的患者;(3)伴有重要脏器(如心、肺、肝、肾等)功能不全的患者;(4)近2周内有手术或外伤史的患者;(5)既往有精神疾病或痴呆史的患者;(6)合并恶性肿瘤、血液系统疾病或自身免疫性疾病的患者;(7)既往有脑外伤史的患者。采用随机数字表法将150例患者分为观察组与对照组,各75例。观察组中男性41例、女性34例,患者年龄60~80(71.3±5.4)岁,吸烟史(每日吸一支及以上纸烟且持续1年)15例;合并高血压史33例,合并糖尿病史20例,合并血脂异常25例,有冠心病史13例;发病至入院时间1~45 (20.6±5.8)h。对照组中男性43例、女性32例,患者年龄60~79(70.4±5.0)岁,吸烟史13例;合并高血压史34例,合并糖尿病史18例,合并血脂异常26例,有冠心病史15例;发病至入院时间0.5~43(20.1±5.4)h。两组基线资料差异均无统计学意义(均P>0.05),具有可比性。本研究经张家口市第二医院医学伦理委员会批准。
1.2 治疗方法 所有受试者入院后均接受一般处理(包括控制血压、血糖,以及心电监测、吸氧)、特异性治疗(包括服用他汀类药物,以及抗凝血、扩充血容量和降纤维蛋白原治疗)、并发症防治和早期康复干预。在此基础上,对照组患者接受双抗疗法,具体用法用量:阿司匹林肠溶片(拜耳医药保健有限公司,产品批号:20181104、20191205、20210103;规格:100 mg/片),200 mg/次,1次/d,晨起空腹口服;硫酸氢氯吡格雷片[赛诺菲(杭州)制药有限公司,产品批号:1810051、1911047、2101146;规格:75 mg/片],75 mg/次,1次/d,早餐后口服。观察组在对照组基础上加用丁苯酞+鼠神经生长因子治疗。具体用法用量:丁苯酞软胶囊(石药集团恩必普药业有限公司,产品批号:181009、191204、210107;规格为0.1 g/粒)口服,0.2 g/次,3次/d;注射用鼠神经生长因子[武汉海特生物制药股份有限公司,产品批号:201810135、201911204、202012163;规格为20 μg(9 000 U)/瓶]肌肉注射,20 μg/次,1次/d。两组均连续治疗4周。
1.3 观察指标 (1)神经功能缺损程度:分别于治疗前、治疗4周后采用NIHSS[9]评价患者神经功能缺损程度。NIHSS涉及凝视、构音障碍、上下肢运动、语言、面瘫等神经功能障碍的内容,总分为42分,评分越高则表示受检者神经功能缺损越严重。(2)血小板最大聚集率(maximum platelet aggregation rate,MPAR):分别于治疗前、治疗4周后采用Helena Laboratories公司生产的PACKS-4型血小板聚集仪及其配套试剂盒(光学比浊法)测定患者MAR。(3)血浆D-二聚体、纤维蛋白原(fibrinogen,FIB):分别于治疗前、治疗4周后采集患者空腹肘静脉血3 mL,置入抗凝管中,轻轻颠倒混匀,以3 000 r/min离心20 min后收集上层液(血浆),使用Sysmex公司生产的CA7000型凝血分析仪检测血浆中D-二聚体、FIB水平,血浆D-二聚体、FIB分别采用免疫比浊法、凝固法测定,试剂盒均购自Dade-Behring公司(D-二聚体试剂盒批号:18B5109、19B3097、20B6085;FIB试剂盒批号:18B6094、19B5078、20B7065)。(4)ox-LDL、sICAM-1、一氧化氮水平:分别于治疗前、治疗4周后采集患者空腹肘静脉血5 mL,置于未加抗凝剂的离心管中,室温静置1 h后,以3 000 r/min离心10 min分离出血清,置于-20 ℃中保存备用。采用ELISA检测患者血清ox-LDL、sICAM-1水平,检测仪器为深圳迈瑞生物医疗电子股份有限公司生产的MR-96A型酶标仪,试剂盒均购自上海西唐生物科技有限公司(ox-LDL试剂盒批号:181115、191007、200914;sICAM-1试剂盒:180913、190718、200625);采用硝酸还原酶法检测血清一氧化氮水平,检测仪器为江苏无锡市金义博仪器科技有限公司生产的721G型分光光度计,试剂盒购自南京信帆生物技术有限公司(批号:110606、091208、071015),均按说明书进行操作。(5)预后评估:于发病3个月后,采用改良Rankin量表(modified Rankin Scale,mRS)和改良Barthel指数(modified Barthel index,mBI)评估两组患者的预后情况。其中mRS是根据患者病残程度分为0~6级,依次计0~6分,评分越高,说明病残程度越严重,mRS评分≤2分为预后良好,mRS评分>2分为预后不良[10]。mBI用于评估患者的日常生活能力,该量表包含进食、上下楼梯、控制大小便、洗澡等10项内容,满分100分,评分越高说明受试对象日常生活自理能力越强[11]。(6)不良反应:记录患者治疗过程中药物相关不良反应(包括注射部位疼痛、胃肠道反应、转氨酶升高等)的发生情况。
1.4 疗效判定标准 治疗4周后,进行疗效评价。基本痊愈:病残程度为0级,91%≤NIHSS评分较治疗前减少≤100%;显著进步:病残程度为1~3级,46%≤NIHSS评分较治疗前减少<91%;进步:18%≤NIHSS评分较治疗前减少<46%;无变化:NIHSS评分较治疗前减少或增加不足18%;恶化:NIHSS评分较治疗前增加≥18%[12]。
1.5 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用t检验;计数资料以例数(百分比)表示,组间比较采用χ2检验;等级资料的比较采用秩和检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 治疗前后两组患者NIHSS评分和血栓前状态指标水平的比较 治疗前,两组患者的NIHSS评分、MPAR、血浆D-二聚体水平、血浆FIB水平差异均无统计学意义(均P>0.05),治疗4周后,两组患者NIHSS评分、MPAR及血浆D-二聚体水平、血浆FIB水平均低于治疗前,且观察组的NIHSS评分、MPAR、血浆D-二聚体水平、血浆FIB水平均低于对照组(均P<0.05)。见表1。
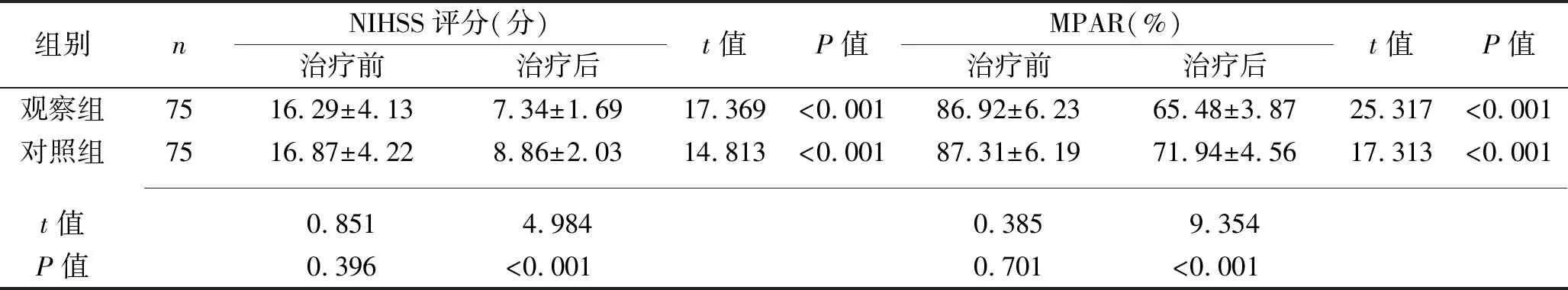
表1 治疗前后两组患者NIHSS评分和血栓前状态指标的比较(x±s)

组别nD-二聚体(mg/L)治疗前治疗后t值P值FIB(g/L)治疗前治疗后t值P值观察组751.69±0.200.35±0.0754.766<0.0014.94±1.262.67±0.5814.173<0.001对照组751.74±0.240.44±0.1043.301<0.0015.12±1.423.46±0.719.055<0.001 t值1.3866.3850.8217.463P值0.168<0.0010.413<0.001
2.2 治疗前后两组患者血清ox-LDL、sICAM-1和一氧化氮水平的比较 治疗前,两组患者血清ox-LDL、sICAM-1、一氧化氮水平差异均无统计学意义(均P>0.05),治疗4周后,两组患者血清ox-LDL、sICAM-1水平均较治疗前降低,血清一氧化氮水平较治疗前升高,且观察组血清ox-LDL、sICAM-1水平低于对照组,血清一氧化氮水平高于对照组(均P<0.05)。见表2。

表2 治疗前后两组患者血清ox-LDL、sICAM-1和一氧化氮水平的比较(x±s)
2.3 两组患者预后指标的比较 发病3个月后,观察组mRS评分低于对照组,mBI评分高于对照组(均P<0.05)。见表3。
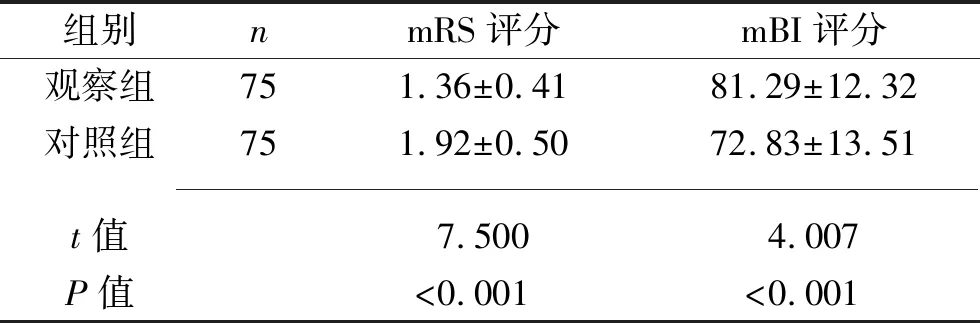
表3 两组患者预后指标比较(x±s,分)
2.4 两组不良反应发生率的比较 对照组各有1例患者发生腹痛、恶心、腹泻;观察组各有1例患者发生一过性转氨酶轻度升高、腹痛、腹泻、注射部位疼痛,有2例患者出现恶心。观察组不良反应发生率为8.0%(6/75),对照组为4.0%(3/75),两组患者不良反应发生率差异无统计学意义(χ2=0.473,P=0.492)。
2.5两组临床疗效的比较 观察组临床疗效优于对照组(z=-2.159,P=0.031)。见表4。

表4 两组临床疗效的比较(n)
3 讨 论
目前人口老龄化已成为我国重大的社会问题,最新人口普查数据显示,截至2020年11月,我国≥60岁的人口为26 401.88万人,占总人口数的18.70%[13]。随着我国人口老龄化的加剧,脑梗死等疾病的患病率明显升高。血小板活化是急性脑梗死重要的病理生理过程,因此抗血小板治疗成为治疗急性脑梗死的主要方法,其中双抗疗法是最常用的治疗方案。阿司匹林主要是通过不可逆性抑制血小板内环氧合酶的表达,来阻断血小板内花生四烯酸的代谢,以抑制血小板血栓素A2的生成,从而起到拮抗血小板聚集的作用。氯吡格雷主要是通过选择性、不可逆性地抑制二磷酸腺苷与血小板上二磷酸腺苷受体P2Y12结合,以及继发的二磷酸腺苷介导的血小板膜糖蛋白Ⅱb/Ⅲa复合物的活化途径,阻止血小板聚集;氯吡格雷还可对不依赖血栓素A2和二磷酸腺苷的第三条血小板活化途径(包括胶原、凝血酶等)产生抑制作用。既往研究显示,与单独用药相比,双抗疗法的抗血小板作用更强[14]。大量文献表明,双抗疗法能显著降低急性脑梗死患者的致残率及病死率,并减少复发的发生[15-16]。但老年脑梗死患者因机体机能较差,单用双抗疗法疗效欠佳。
丁苯酞是治疗脑血管病的Ⅰ类化学新药,具有保护神经细胞、抑制细胞内钙超载、改善脑缺血区微循环及全脑缺血后的能量代谢、提高脑血管内皮一氧化氮水平、增加缺血区脑血流、抗脑缺血后炎症、促进脑缺血区血管新生、抗氧自由基、抑制神经元凋亡、抑制血小板聚集及血栓形成、保护血脑屏障、减轻脑缺血再灌注损伤相关基因表达等诸多药理作用,能通过多途径、多环节及多靶点对缺血性脑损伤发挥治疗作用,对改善患者的神经功能和提高生活质量均有积极的效果,现已成为治疗急性脑梗死患者的早期用药[17]。一项Meta分析研究显示,丁苯酞联合阿司匹林治疗急性脑梗死患者的疗效显著,安全可靠[18]。还有研究显示,丁苯酞等神经保护药物可改善急性脑梗死患者的神经功能缺损程度及预后[19]。鼠神经生长因子属于外源性神经生长因子,主要通过提高神经细胞清除自由基的能力、维持细胞内钙离子浓度稳定、抑制神经细胞凋亡、拮抗兴奋性氨基酸的神经毒性、促进神经再生(包括促进髓鞘修复与再生、加速轴突的定向生长、促进再生神经的血管形成和促进神经愈合)等途径,参与神经保护及修复过程[20]。目前,鼠神经生长因子主要用于脑血管病、颅脑损伤等神经损伤病症的治疗,且疗效确切,无严重不良事件。本研究采用丁苯酞与鼠神经生长因子联合双抗疗法治疗老年急性脑梗死,观察其疗效。结果显示,采用丁苯酞与鼠神经生长因子联合双抗疗法治疗的观察组患者临床疗效优于单用双抗疗法治疗的对照组,治疗后的NIHSS评分更低(均P<0.05);且发病3个月后,观察组mRS评分低于对照组,mBI评分高于对照组(均P<0.05),但两组不良反应发生率差异无统计学意义(P>0.05)。这提示,与单用双抗疗法相比,丁苯酞与鼠神经生长因子联合双抗疗法治疗老年急性脑梗死患者的疗效更好,且安全可靠。
血栓前状态又称血液高凝状态,是抗凝系统失调的病理过程,急性脑梗死的发生、发展与血栓前状态密切相关[21]。血小板聚集是血栓形成的主要原因,MPAR是反映血小板聚集功能的常用指标。D-二聚体作为交联纤维蛋白的特异性降解产物,能敏感地反映体内高凝状态和继发性纤溶亢进情况。FIB即凝血因子Ⅰ,是血栓形成的重要反应底物,具有促进血小板聚集、增加血液黏滞性和诱导内皮细胞损伤等作用。本研究结果显示,治疗后,观察组MPAR、血浆D-二聚体水平、血浆FIB水平均低于对照组(均P<0.05)。这说明丁苯酞与鼠神经生长因子联合双抗疗法能更好地改善老年急性脑梗死患者的血栓前状态,原因可能与丁苯酞可以抑制血小板聚集和抗血栓形成的药理作用有关。
氧自由基、炎症递质、细胞因子等多种细胞活性分子参与的继发性脑损伤是脑缺血后神经功能受损的主要原因[22]。ox-LDL是LDL-C的氧化修饰产物,具有很强的细胞毒性,可通过趋化单核细胞至内皮下间隙、损伤内皮细胞并引起内皮功能障碍、加速凝血因子活化、刺激平滑肌细胞分泌大量炎症因子等方式,参与缺血性脑损伤病理过程。sICAM-1属于免疫球蛋白超家族黏附分子,在局部脑缺血组织中高表达,可通过介导内皮细胞与白细胞的黏附作用,造成微血管阻塞,并能促进白细胞浸润,从而加剧脑缺血后脑组织损伤。一氧化氮是一种低分子活性物质,可弥散至脑梗死后缺血半暗带组织中,抑制浸润性白细胞在半暗带区扩散及阻止血小板聚集于半暗带区,同时还能拮抗内皮素-1的缩血管效应,从而起到抑制炎症反应、扩张血管及改善脑血流灌注等脑保护效应。本研究结果显示,治疗后,观察组血清ox-LDL、sICAM-1水平低于对照组,血清一氧化氮水平高于对照组(均P<0.05)。这提示丁苯酞与鼠神经生长因子联合双抗疗法治疗老年急性脑梗死可以更好地减轻体内氧化应激及炎性损伤、增强脑保护能力。张晓璇等[23]研究发现,丁苯酞可能通过抑制脑梗死模型大鼠脑组织中核转录因子-κB p65信号通路,来降低脑组织中肿瘤坏死因子 α 、白细胞介素 6等炎症因子的水平,进而发挥脑保护作用。此外,于广石等[24]研究发现,采用鼠神经生长因子辅助治疗急性脑梗死患者可显著减轻其神经损伤程度,这可能与鼠神经生长因子能显著抑制白细胞介素1β、白细胞介素6、肿瘤坏死因子α等炎性细胞因子的表达,以及上调脑源性神经营养因子、血管内皮生长因子等生长因子的表达有关。因此我们推测,丁苯酞与鼠神经生长因子联合双抗疗法治疗老年急性脑梗死可以获得更好的疗效可能与丁苯酞、鼠神经生长因子进一步降低血清ox-LDL、sICAM-1水平及提高血清一氧化氮水平有关。
综上所述,丁苯酞与鼠神经生长因子联合双抗疗法治疗老年急性脑梗死疗效确切,安全性良好,与单纯双抗疗法相比,其可更好地减轻患者神经功能缺损,改善患者预后,其作用机制可能与更有效地纠正血栓前状态,下调血清ox-LDL、sICAM-1的表达水平和上调血清一氧化氮的表达水平有关,值得临床推广应用。

