保健保本草菁萃安全性评价及对小鼠免疫功能影响研究
宁德山,梁峰,赵宏伟,3*,程江,王磊,尹丽华,叶小敏
1.无限极(中国)有限公司,广东 广州 510520;
2.广州暨南生物医药研究开发基地有限公司,广东 广州 510632;
3.中国中药协会 药食同源物质评价和利用专业委员会,北京 100061;
4.武汉药品医疗器械检验所,湖北 武汉 430075
随着人们生活节奏的加快,多种因素导致越来越多的人处于亚健康状态[1-3],这是一种处于健康和疾病之间的一种生理状态,免疫力下降是其主要特征之一[4-6]。据世界卫生组织一项全球性的研究预测,全球有75%的人群处于亚健康状态,而中国保健学会2022 年7 月对中国16 个百万以上人口的城市居民抽样调查显示,亚健康状态的人群达总人口数的70%以上[7-8]。中医自古就有“治未病”理念,亚健康状态就处于易病未病的状态,与传统中医药的未病先防理论不谋而合。多种中草药具有免疫调节功能,其中以真菌类和补益类药食同源中药居多,成分以多糖类为主。据文献报道,枸杞子[9-10]、茯苓[11-12]、香菇[13-14]、桑 椹[15-16]、菊花[17-18]、党 参[19-20]、猴 头菇[21-22]、金 针菇[23-24]、银耳[25-26]等中草药均具有免疫调节作用,其活性成分诸如多糖、生物碱等参与机体特异性免疫和非特异性免疫过程,具有不良反应少、不易产生耐药性、多靶点作用等特点。保健保本草菁萃是以上述天然中草药为原料,经过不同的组方配比筛选出的复方保健食品,在前期的研究中,本课题组已经建立了制剂工艺和质量标准,然而其如何发挥功效尚不明确,长期使用的安全性也有待验证。本研究依据《保健食品检验与评价技术规范》(2003版)[27]有关要求,对保健保本草菁萃的安全性和增强免疫功能进行评价,以期为其应用提供可靠的数据支持。
1 材料
1.1 实验动物、菌株和细胞
无特定病原体(SPF)级昆明种小鼠20 只,体质量18~22 g,雌雄各半,由湖南斯莱克景达实验动物有限公司提供,实验动物生产许可证号:SCXK(湘)2016-0002,用于急性经口毒性实验。
SPF 级SD 大鼠88 只,体质量75~90 g,雌雄各半,由北京维通利华实验动物技术有限公司提供,实验动物生产许可证号:SCXK(京)2016-0006,用于30 d喂养实验。
SPF 级近交系雄性Balb/C 小鼠120 只,体质量18~22 g,由南方医科大学动物中心提供,实验动物生产许可证号:SCXK(粤)2016-0041,用于免疫功能评价实验。
实验动物房为屏障系统,环境温度20~25 ℃,相对湿度40%~70%,人工照明12 h 昼夜更替。实验动物使用许可证号:SYXK(鄂)2014-0077,使用证明号:00270497。动物实验经武汉药品医疗器械检验所实验动物伦理委员会审批,符合实验动物伦理学要求。
鼠伤寒沙门氏菌组氨酸缺陷型TA97、TA98、TA100、TA102,批号分别为5281D、5282D、5249D、5280D,购自上海康成生物科技有限公司,-80 ℃保存,经生物学特性鉴定合格后用于实验。
小鼠淋巴瘤细胞YAC-1 为暨南大学细胞生物学系实验室自传代,支原体检测为阴性。
1.2 试药
保健保本草菁萃由无限极(中国)有限公司提供(批号:Q1611019),为棕黄色粉剂,实验前用蒸馏水现配成各质量浓度。
敌克松(批号:SLBC6145V)、2-氨基笏(2-AF,批号:20100526)、二甲基亚砜(DMSO,批号:D8418)均购于Sigma 公司;叠氮化钠(NaN3,批号:S8200,Amresco 公司);1,8-二羟基蒽醌(批号:C1706017,Aladdin 公司);代谢活化系统用大鼠肝S9(批号:3772,Moltox公司);RPMⅠ 1640细胞培养液(批号:11875093,赛默飞世尔公司);刀豆蛋白A(ConA,批号:C8110)、4%多聚甲醛(批号:P1110)、吉姆萨染液(批号:G1015)、补体(豚鼠血清,批号:S4990)、绵羊红细胞(SRBC,批号:S9450)、鸡红细胞(批号:S9454)均购自北京索莱宝科技有限公司;2,4-二硝基氟苯(DNFB,批号:F830061,上海麦克林生化科技有限公司);乳酸脱氢酶(LDH)细胞毒性检测试剂盒(批号:C0016)、胎牛血清(批号:C0228)均购自碧云天生物技术有限公司。
1.3 仪器
PB 302 型电子天平(梅特勒-托利多公司);BS 110S 型电子天平 [赛多利斯科学仪器(北京)有限公司];SW-CJ-1F 型标准型净化工作台(苏州吴江华夏空调净化设备厂);LT-BⅠX300L 型低温生化培养箱 [立德泰勀(上海)科学仪器有限公司];H-1850R 型台式高速冷冻离心机(湖南湘仪实验仪器开发有限公司);TS-110X50 型恒温摇床(上海天呈科技有限公司);XT-2000i 型全自动动物血液细胞分析仪(希森美康公司);BS-820 型全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司);ASP200S 型真空组织脱水机、EG1150 型包埋机、EG1150C 型包埋冷冻台、RM2265 型全自动切片机、HⅠ1210 型摊片机、HⅠ1220型烤片机均购自Leica Biosystems Nussloch GmbH 公司;DM2500 型显微照相仪(Leica Microsystems 公司);Elx800 型酶标仪(Bio-Tek 公司);UV-2600 型分光光度计(Shimadzu公司);YA28X6T/8型高压灭菌锅(宁波甬安医疗器械制造有限公司);DK-24 型恒温水浴锅、DHG-9053A 型鼓风干燥箱均购自上海精宏实验设备有限公司;ECLⅠPSE-TⅠ2 型倒置显微镜(尼康仪器有限公司);PHS-3C 型pH 计(成都世纪方舟科技有限公司);ⅠM1200型全自动细胞计数仪 [艾力特生物科技(上海)有限公司]。
2 方法
2.1 保健保本草菁萃的制备
将检验合格的枸杞子、茯苓、香菇、桑椹、菊花、党参、金针菇、猴头菇和银耳药材去除杂质,按质量比10∶10∶10∶10∶5∶5∶5∶3∶2 称量并投入提取罐内,加入12 倍量的水煎煮提取2.5 h,滤过后收集滤液,滤渣重新加10 倍量的水煎煮2 h,收集滤液,合并2 次滤液,旋转蒸发浓缩至固形物质量分数为(35±5)%。浓缩液加入40 份的菊粉,搅拌均匀后投入真空带式干燥机,干燥物料经粉碎后过100目筛,即得保健保本草菁萃粉剂。
2.2 急性经口毒性实验
称取受试物25.89 g,用纯水定容至40 mL,得到能通过小鼠灌胃器的最大质量浓度0.65 g·mL-1的供试液。取SPF 级昆明种小鼠20 只,雌雄各半,适应性饲养3 d,禁食16 h后按20 mL·kg-1灌胃给予上述供试液,每日3 次(间隔4 h),1 日内总剂量为38.83 g·kg-1,相当于人摄入量的1177倍(以每日口服2 g、体质量60 kg 计,折算剂量为0.033 g·kg-1)。连续观察灌胃后4 h 内和14 d 内毒性反应、存活情况。对死亡动物作大体解剖[28]。
2.3 Ames实验(平板渗入法)
取鉴定合格的鼠伤寒沙门氏菌组氨酸缺陷型TA97、TA98、TA100、TA102 菌株,采用平板渗入法进行实验。在加和不加S9 活化系统条件下,受试物设5000、1000、200、40、8 μg/皿5个剂量组,另设二甲基亚砜(DMSO)溶剂对照、自发回变对照和阳性对照。阳性对照采用敌克松、NaN3、2-AF、1,8-二羟基蒽醌,剂量分别为50.0、2.5、10.0、50.0 μg/皿。每组3个平行,37 ℃培养48 h,计算平均回变菌落数。在加或不加S9 活化系统条件下,1株以上的菌回变菌落数≥溶剂对照组回变菌落数的2倍,并呈剂量-效应关系,或1 个以上剂量具有可重复的并具有统计学意义的阳性结果,可判断该受试物细菌回复突变实验结果阳性。阴性结果需至少做2次测试,阳性结果至少做3次测试[29]。
2.4 30 d喂养实验
取SPF级SD大鼠88只,按体质量随机分为4组,每组雌雄各11 只。受试物高、中、低剂量组灌胃剂量分别为3.30、1.65、0.83 g·kg-1·d-1,相当于人体推荐量的100、50、25倍,同时设对照组,给予等量蒸馏水。各组每天灌胃1次,连续30 d。每天观察并记录大鼠的行为、体征、呼吸、中毒症状和死亡状况;每周称1次体质量、2次食物摄入量,按照公式(1)计算每周食物利用率。实验末期,将大鼠禁食不禁水16 h,腹主动脉采血测定血液学指标及血生化指标丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、尿素氮(BUN)、肌酐(Cr)、血糖(GLU)、白蛋白(ALB)、总蛋白(TP)、总胆固醇(TCHO)、三酰甘油(TG),计算ALB/球蛋白比值(ALB/GⅠO)。然后将大鼠脱颈椎处死,大体解剖后肉眼观察有无明显病变,取肝、肾、脾、性器官等脏器进行称量,计算脏体比,并对肝、肾、脾、胃肠、性器官等脏器进行组织病理学检查[30]。

2.5 免疫功能评价实验
选用SPF 级近交系雄性Balb/C 小鼠120 只,体质量18~22 g,适应性饲养1 周,按体质量随机分为12 组,每组10 只,其中4 组用于脾淋巴细胞转化实验和自然杀伤(NK)细胞活性测定,4 组用于迟发型变态反应实验,4 组用于抗体生成细胞检测和腹腔巨噬细胞吞噬鸡红细胞实验。受试物低、中、高剂量组分别灌胃0.17、0.33、1.00 g·kg-1·d-1,相当于人体推荐量的5、10、30 倍,对照组给予等量蒸馏水。连续灌胃30 d后,各组小鼠根据检测指标方法进行相应处理取样。饲养期间自由饮食,每周称量记录体质量1次,并根据体质量变化调整给药量[27]。
2.5.1脾淋巴细胞转化实验 小鼠给予受试物30 d后,无菌取脾脏,Hank's 液中放置,用镊子将脾脏剪碎研磨,制成单个细胞悬液,过200 目筛网滤过,Hank's液清洗2 次,每次离心10 min(1000 r·min-1,离心半径6 cm),然后将细胞悬液悬浮于完全培养基,台盼蓝染色计算活细胞数后调整细胞密度为3×106个/mL。将每份细胞悬液加入24 孔培养板中,每孔1 mL,设2 个复孔,1 孔加入ConA 溶液(终质量浓度为7.5 μg·mL-1)作为实验孔,另1 孔作为空白。细胞培养箱内37 ℃孵育培养72 h。噻唑蓝(MTT)法在波长570 nm 下检测每孔的吸光度(A),用实验组A减去空白孔A代表淋巴细胞的增殖能力,受试物组细胞的增殖能力显著高于对照组,判定该项实验结果阳性。
2.5.2耳肿胀法检测迟发型变态反应(DTH)小鼠给予受试物30 d 后,腹部脱毛约3 cm×3 cm,用10 mg·mL-1DNFB 溶液50 μL 均匀涂抹致敏。5 d后,用DNFB 溶液10 μL 均匀涂抹于小鼠右耳(两面)进行攻击,攻击后24 h 颈椎脱臼处死,剪下左右耳壳,用打孔器取下直径8 mm 的耳片,称定质量。用左右耳片质量之差表示DTH 的程度,受试物组的质量差值显著高于与对照组的质量差值,可判定该项实验结果阳性。
2.5.3抗体生成细胞检测(改良法)小鼠给予受试物30 d 后,腹腔注射2%的SRBC 悬液0.2 mL 进行免疫,4 d后小鼠颈椎脱臼处死,取出脾脏,制备为5×106CFU·mL-1细胞悬液。胎牛血清经绵羊红细胞(5∶1)吸收,4 ℃,30~60 min 后加入不完全培养基RPMⅠ 1640 中,制备成含20%胎牛血清的完全培养基。将底层培养基(1.4%琼脂糖)融化后,倾入6 孔板,凝固后于37 ℃备用。将顶层培养基(0.7%琼脂糖)融化后,分装小试管,每管0.5 mL,50 ℃水浴保温,再向管内加20% SRBC 50 μL、脾细胞悬液200 μL,迅速混匀倾倒于6孔板中并铺平顶层混合液,每个样本做2个平行孔。待凝固后,放入37 ℃、5% CO2培养箱中孵育1 h,每孔加入以完全培养基稀释的补体(1∶10)500 μL,继续孵育2 h,计数1×106个脾细胞的溶血空斑数。受试物组空斑数显著高于对照组空斑数,可判定实验结果阳性。
2.5.4小鼠腹腔巨噬细胞吞噬鸡红细胞实验 小鼠给予受试物30 d后,腹腔注射2% SRBC悬液0.2 mL进行免疫,4 d后小鼠颈椎脱臼处死,腹腔注射加胎牛血清的Hank's 溶液4 mL,轻按揉腹部20 次,充分洗出腹腔巨噬细胞。腹腔壁剪开一个小口,用胶头吸管吸取腹腔洗液2 mL。用加样器吸取0.5 mL腹腔洗液加入到含1%鸡红细胞悬液0.5 mL 的试管内,混匀。吸取混合液0.5 mL 加到24 孔板,置于细胞培养箱内孵育20 min,孵育结束后迅速用0.9%氯化钠溶液将未贴壁的细胞洗掉,4%多聚甲醛溶液固定1 min,吉姆萨染色液染色15 min。冲洗,晾干,用40×显微镜计数巨噬细胞和被吞噬的鸡红细胞数,按公式(2)~(3)计算吞噬率和吞噬指数。受试物组吞噬率、吞噬指数与对照组吞噬率、吞噬指数比较,差异有统计学意义,可判定实验结果阳性。

2.5.5NK 细胞活性测定 实验前将靶细胞YAC-1进行传代培养,用RPMⅠ 1640 完全培养液调整细胞浓度为4×105个/mL,备用。小鼠给予受试物30 d后,颈椎脱臼处死,无菌取脾脏,制备2×107个/mL脾细胞悬液。取靶细胞和效应细胞各100 μL [效应细胞-靶细胞(50∶1)] 加入到96 孔培养板内,作为反应孔。靶细胞自然释放孔加靶细胞和培养液各100 μL,靶细胞最大稀释孔加靶细胞和1% NP40 各100 μL。各实验组均设3个复孔,细胞培养箱培养4 h,然后将培养板进行低速离心5 min(1000 r·min-1,离心半径6 cm),每孔吸取上清液100 μL 转至96 孔培养板内。利用LDH 检测试剂盒,490 nm 检测每孔的A。按照公式(4)计算细胞活性。受试物组的NK 细胞活性显著高于对照组的NK 细胞活性,即可判定该项实验结果阳性。

2.6 统计学分析
3 结果
3.1 急性经口毒性实验
实验观察期内大鼠行动自如、饮食正常、精神状态良好,未见明显中毒症状,也无死亡,表明保健保本草菁萃剂量在38.83 g·kg-1·d-1时无毒性。
3.2 Ames实验
4 个菌株在加和不加S9 活化系统条件下,受试物各剂量组的回变菌落数均未超过自发回变组和溶剂对照组回变菌落数的2 倍,亦无剂量-反应关系,因此判定保健保本草菁萃Ames实验结果阴性,没有致突变作用。2次重复实验结果见表1~2。
表1 保健保本草菁萃第1次Ames实验回变菌落数(,n=3)
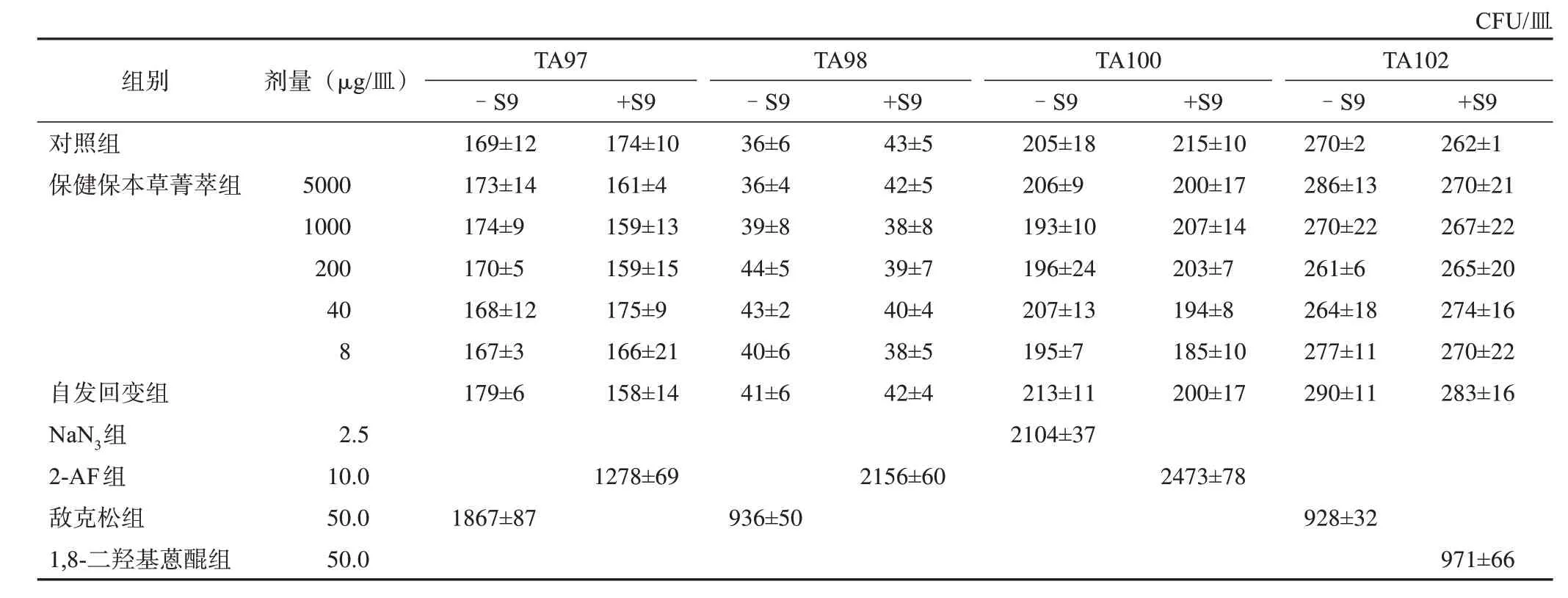
表1 保健保本草菁萃第1次Ames实验回变菌落数(,n=3)
表2 保健保本草菁萃第2次Ames实验回变菌落数(,n=3)

表2 保健保本草菁萃第2次Ames实验回变菌落数(,n=3)
3.3 30 d喂养实验
3.3.1一般状况观察 实验期内各组动物行为表现正常,无死亡和中毒症状。受试物各剂量组大鼠体质量与对照组差异无统计学意义(表3)。受试物各剂量组大鼠每周食物利用率与对照组比较,差异均无统计学意义(表4)。
表3 保健保本草菁萃对大鼠体质量的影响(,n=11)
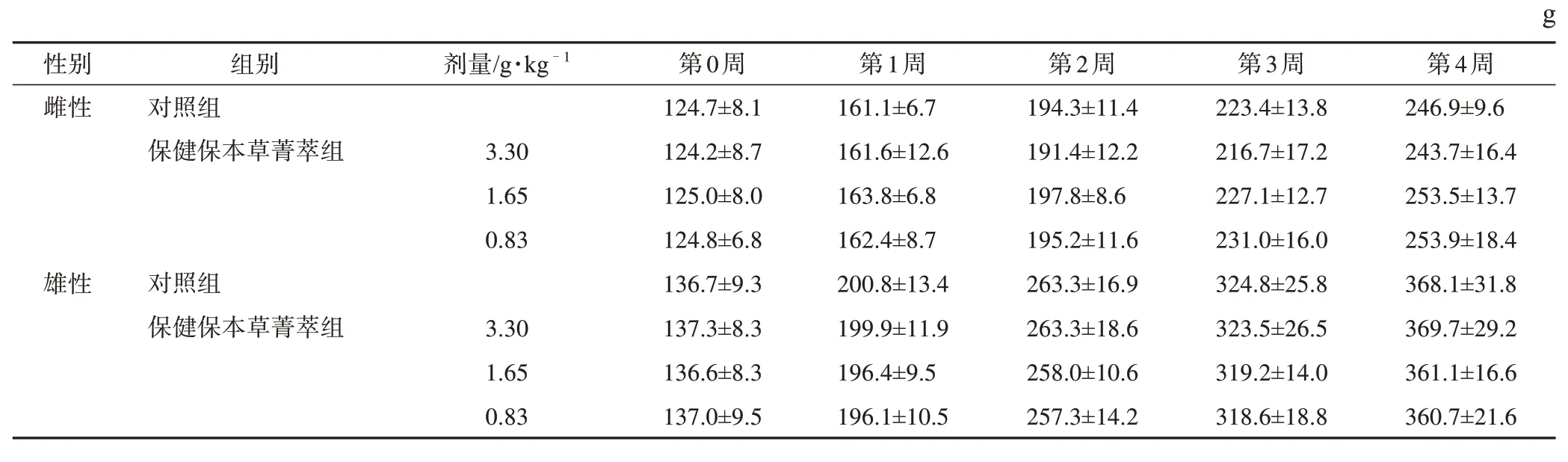
表3 保健保本草菁萃对大鼠体质量的影响(,n=11)
表4 保健保本草菁萃对大鼠食物利用率的影响(,n=11)

表4 保健保本草菁萃对大鼠食物利用率的影响(,n=11)
3.3.2血液学指标 实验末期,采血检测主要血液学指标,各项指标均在正常范围内。受试物各剂量组大鼠白细胞计数及分类、红细胞计数、血红蛋白浓度与对照组相比差异均无统计学意义,结果见表5。
表5 保健保本草菁萃对大鼠血液学指标的影响(,n=11)

表5 保健保本草菁萃对大鼠血液学指标的影响(,n=11)
3.3.3血液生化学指标 由表6 可以看出,受试物1.65、0.83 g·kg-1剂量组尿素氮水平与对照组差异有统计学意义,但这些差异的剂量效应关系不明显,属正常生理范围内的波动,无毒理学意义;其余指标差异均无统计学意义。
表6 保健保本草菁萃对大鼠血液生化学指标的影响(,n=11)

表6 保健保本草菁萃对大鼠血液生化学指标的影响(,n=11)
注:与对照组比较,*P<0.05,**P<0.01。
3.3.4脏器质量和脏体比 由表7~8 可得,受试物各剂量组大鼠肝脏、肾脏、脾脏、卵巢(雌性)、睾丸(雄性)的脏器质量和脏体比与对照组比较差异均无统计学意义。
表7 保健保本草菁萃对大鼠脏器质量的影响(,n=11)

表7 保健保本草菁萃对大鼠脏器质量的影响(,n=11)
3.3.5大体解剖及病理组织学检查 实验结束后,解剖各组大鼠,肉眼观察心脏、肝脏、脾脏、肺脏、肾脏、胃肠等主要脏器未见明显病变。取大鼠各脏器做病理组织学切片检查,结果发现对照组1 只大鼠肠黏膜轻度水肿,其他组织均未见明显病理变化;受试物3.30 g·kg-1剂量组1 只大鼠肝组织内淋巴细胞局灶性增生,肝组织轻微淤血,肝细胞轻微脂肪变性,胃黏膜局灶性变性坏死脱落,黏膜下淤血,肠黏膜上皮细胞变性坏死脱落,肠绒毛钝化缩短,其余大鼠各脏器未见明显病理变化。
表8 保健保本草菁萃对大鼠脏体比的影响(,n=11)

表8 保健保本草菁萃对大鼠脏体比的影响(,n=11)
各组均只有个别大鼠出现病理变化,且病变性质和程度无明显差异,所有病变类型在大鼠中为常见的自发性病理改变,无明显生物学意义。
3.4 免疫功能评价实验
3.4.1脾淋巴细胞转化实验 由图1 可知,经口给予小鼠不同剂量受试物30 d 后,与对照组比较,受试物低剂量组对ConA 诱导淋巴细胞转化差异无统计学意义,中、高剂量组对ConA 诱导淋巴细胞转化差异有统计学意义(P<0.01)。结果表明受试物中、高剂量能明显促进ConA诱导的淋巴细胞转化。
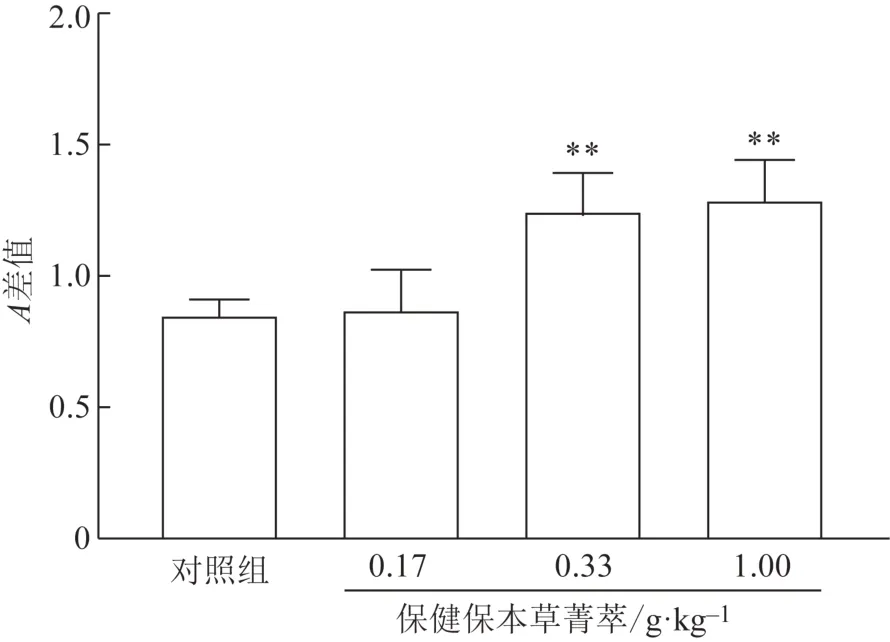
图1 保健保本草菁萃对ConA诱导淋巴细胞转化的影响(,n=10)
3.4.2迟发型变态反应 对照组、受试物各剂量(1.00、0.33、0.17 g·kg-1)组大鼠左右耳质量差分别为(17.09±3.49)、(14.54±2.11)、(14.41±2.00)、(15.65±3.81)mg,与对照组比较,受试物各剂量组大鼠左右耳质量差值差异均无统计学意义。结果表明受试物各剂量对大鼠DTH 程度没有明显影响。
3.4.3抗体生成细胞检测 由图2 可知,经口给予小鼠不同剂量受试物30 d 后,与阴性对照组相比,受试物低、中剂量组空斑数差异无统计学意义,高剂量组空斑数显著增多(P<0.01)。结果表明,受试物低、中剂量组对抗体生成细胞水平没有明显影响,高剂量组能明显提高抗体生成细胞水平。
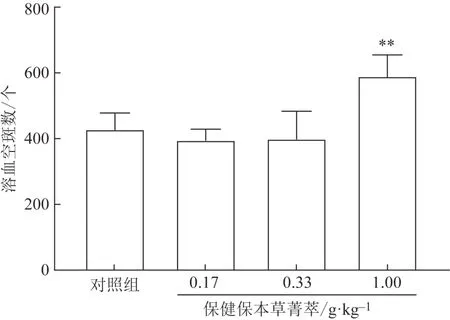
图2 保健保本草菁萃对抗体生成细胞的影响(,n=10)
3.4.4小鼠腹腔巨噬细胞吞噬鸡红细胞实验 由图3~4 可知,经口给予小鼠不同剂量受试物30 d 后,与对照组相比,受试物低、中剂量组细胞吞噬率及吞噬指数差异无统计学意义,高剂量组吞噬率和吞噬指数显著升高(P<0.01)。结果表明,受试物低、中剂量组对巨噬细胞吞噬能力没有明显影响,高剂量能明显提高巨噬细胞吞噬能力。

图3 保健保本草菁萃对小鼠腹腔巨噬细胞吞噬率的影响(,n=10)
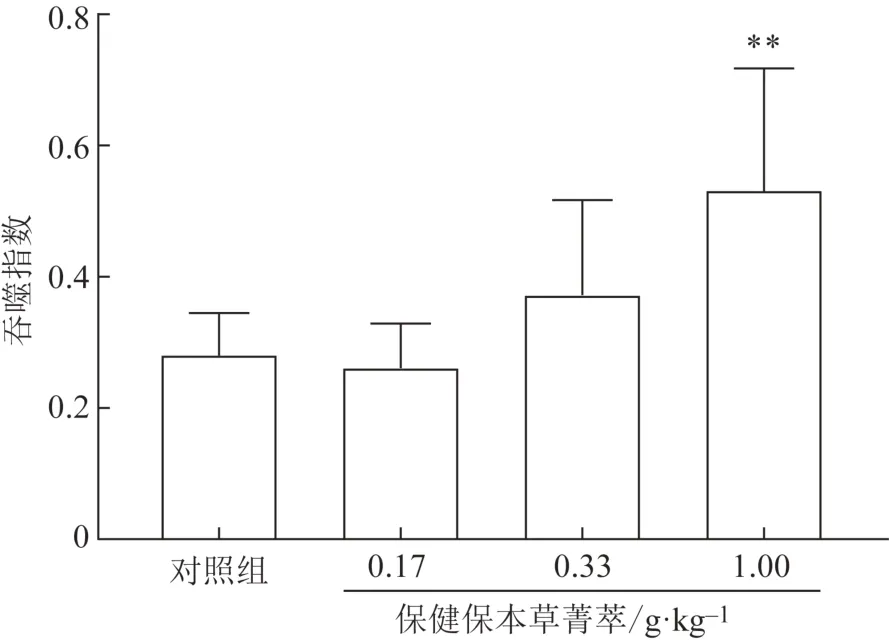
图4 保健保本草菁萃对小鼠腹腔巨噬细胞吞噬指数的影响(,n=10)
3.4.5NK 细胞活性测定 由图5 可知,经口给予小鼠不同剂量受试物30 d 后,与对照组相比,受试物低、中剂量组NK 细胞活性差异均无统计学意义,高剂量组NK 细胞活性显著升高(P<0.05)。结果表明受试物低、中剂量对NK 细胞活性没有明显影响,高剂量能明显提高NK 细胞活性。

图5 保健保本草菁萃对NK细胞活性的影响(,n=10)
4 讨论
本研究采用小鼠急性经口毒性实验、Ames实验和大鼠30 d 喂养实验对保健保本草菁萃进行毒理学安全性评价,结果表明受试物对小鼠急性经口最大耐受量(MTD)>38.83 g·kg-1,根据《保健食品检验与评价技术规范》(2003 版)急性毒性剂量分级标准得出,此受试物属于无毒物质;受试物Ames实验结果阴性,未显示出致突变作用;30 d 喂养实验中,受试物对大鼠生长发育、血液学、血液生化学、主要脏体比及组织病理学检测均未产生不良影响。由此可见,保健保本草菁萃作为食品是安全可靠的。
机体免疫系统由非特异性免疫、体液免疫和细胞免疫3 个方面组成,能够识别和清除入侵人体的抗原成分、体内的衰老细胞、凋亡细胞及异常突变细胞等,从而保持机体内环境的相对稳定[31]。本研究采用正常动物模型,从细胞免疫功能、体液免疫功能、单核-巨噬细胞功能及NK 细胞活性4 个方面综合评价保健保本草菁萃对小鼠免疫功能的影响。脾脏是机体免疫系统的主要免疫器官之一,由T 细胞和B 细胞组成。脾淋巴细胞增殖是细胞免疫功能最直接的指标。受试物中、高剂量能明显促进ConA诱导淋巴细胞的转化,能增强细胞免疫功能;外周血、肝脏、脾脏是NK 细胞常常存在的部位,NK 细胞可以清除病变细胞,延缓细胞的衰老,极大地提高机体免疫力。当机体受到感染后,NK细胞发生活化,产生细胞毒性作用。NK 细胞可以识别靶细胞,活化吞噬细胞,释放杀伤介质,从而增强机体的免疫能力。研究结果表明,受试物高剂量可增强NK细胞活性;显著提高抗体生成细胞水平,对体液免疫应答是有益的;显著提高巨噬细胞吞噬能力,单核巨噬细胞为一种机体非特异性免疫的重要细胞,其吞噬能力是可用于反映机体非特异性免疫功能。
综上所述,保健保本草菁萃可通过调节小鼠非特异性免疫、细胞免疫、体液免疫及NK 细胞活性,从而达到增强免疫力的作用;在毒性研究中未发现不良反应。

