电池级类球形碳酸锰的制备
阮 籍,农艳莉,李春流,杨茂峰,万维华,闫冠杰,廖伟峰
(南方锰业集团有限责任公司崇左分公司,广西 崇左 532200)
碳酸锰(MnCO3)在电子、陶瓷、化工和医药等行业的应用受到广泛关注[1-2];同时,锂离子电池行业对MnCO3品质也提出了更高要求[3-4]。电池级类球形MnCO3可用于制备电池级四氧化三锰、高性能锰酸锂、电池级一氧化锰、电池级三氧化二锰及磷酸铁锰锂,对提高尖晶石型锰酸锂、磷酸锰铁锂等锰系正极材料的克比容量、循环寿命、倍率等有重要影响[5-10]。
碳酸锰的制备方法主要有锰盐溶液沉淀法、含锰矿石浸出法和含锰废液、废渣回收法等,其中常用的为锰盐溶液沉淀法[11-14]。采用碳酸盐沉淀法制备类球形碳酸锰,由于碳酸锰溶度积常数较低,沉淀速度较快,容易出现碳酸锰颗粒分布范围较广且难以控制、微观形貌不规则、杂质含量高、振实密度低等问题。试验研究了以电池级硫酸锰、碳酸铵和氨水为原料,采用碳酸盐沉淀法制备类球形MnCO3颗粒,采用全自动反应釜精确控制反应温度、体系pH、硫酸锰溶液与氨水流量、搅拌速度等工艺参数,以期制备出杂质含量低、粒度分布范围窄、振实密度高的类球形MnCO3。
1 试验部分
1.1 试验试剂与仪器
试剂:电池级硫酸锰;碳酸铵、氨水,均为分析纯;去离子水。
主要设备与仪器:YZCMR-10(M)型全自动反应釜,SHZ-DⅢ型真空泵,DHG9076A型干燥箱,LA-300型激光粒度仪,FZS4-4B型振实密度测定仪,D8 ADVANCE X射线粉末衍射仪,日立3400N扫描电子显微镜,SPECTRO ARCOS Ⅱ电感耦合等离子体发射光谱仪。
1.2 试验原理与方法
以硫酸锰为锰源,碳酸铵为沉淀剂,反应式为
MnCO3↓+(NH4)2SO4。
(1)
结晶晶体粒度与晶体生成速率v1和晶体长大速率v2有关。根据Volmer理论,v1和v2可表示为[15]:
(2)
(3)
式中:K—晶核生成速率常数;Ea—分子越过晶核与母相界面活化能,J/mol;σ—表面张力,N/m;K1—玻尔兹曼常数;r临—稳定晶核尺寸,m;K2—晶体生长速率常数;σ′—单位长度台阶的棱边能,J/m;α—单个原子占据面积,m2。其中,
(4)
式中:M—晶体摩尔质量,g/mol;ρ—晶体密度,g/cm3;γ—溶液过饱和度。
从式(2)~(4)看出,晶体生成和长大主要受溶液过饱和度及反应温度的影响。因此,通过调整溶液过饱和度、反应温度等可控制类球形MnCO3的粒度指标。
配液:配制浓度2 mol/L的电池级硫酸锰溶液2 000 mL于烧杯中,再配制一定浓度碳酸铵溶液2 000 mL于烧杯中。
沉淀结晶:将适量去离子水加入到反应釜中用作底液,设置搅拌速度400~600 r/min;在60~80 ℃下,通过蠕动泵将硫酸锰溶液、碳酸铵溶液加入到反应釜中,控制硫酸锰流量为20~40 mL/min。反应过程中再通过蠕动泵并流加入15%氨水调节体系pH在6.5~8.0范围内。加完硫酸锰溶液后,停止加入碳酸铵溶液和氨水,保持温度,继续搅拌10 h。
洗涤、干燥:反应结束后,将所得固液混合物过滤,用去离子水洗涤沉淀物数次,然后放入烘箱于90 ℃下干燥10 h,得电池级类球形MnCO3。
1.3 分析方法
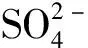
2 试验结果与讨论
2.1 体系pH对MnCO3产品指标及形貌的影响
反应温度60 ℃,硫酸锰流量30 mL/min,搅拌速度600 r/min,硫酸锰浓度2 mol/L,反应时间13 h,体系pH对MnCO3产品指标及形貌的影响试验结果见表1、图1。
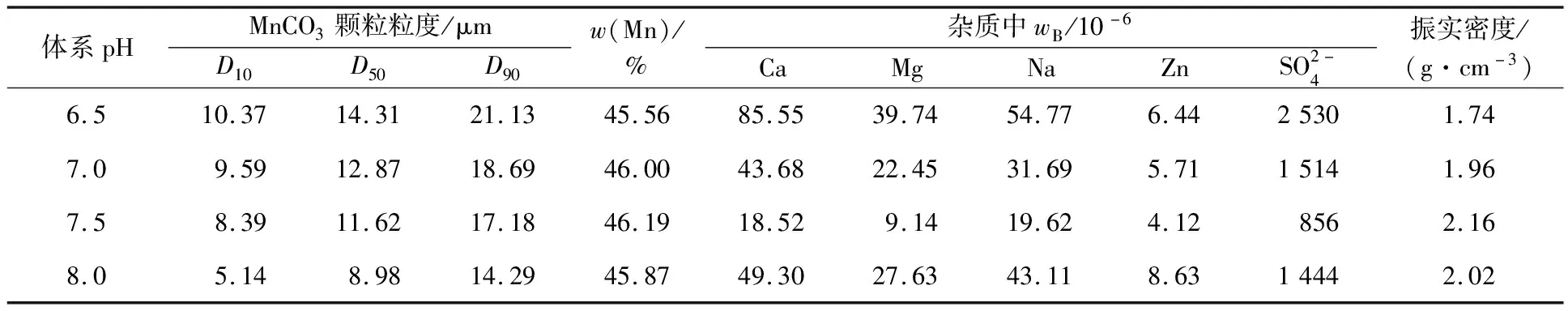
表1 体系pH对MnCO3产品指标的影响

a—pH=6.5;b—pH=7.0;c—pH=7.5;d—pH=8.0。
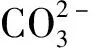
由图1看出,体系pH对MnCO3颗粒的微观形貌有显著影响:随体系pH逐步升高,颗粒结构由无定型多面体过渡到类球形再到球形,最后偏向六面体生长。原因可能是pH对晶体各晶面的生长作用不同:在体系pH=6.5左右时,颗粒形貌为无定型多面体,表面极为粗糙,晶体多以片状式生长;体系pH=7.0时,MnCO3颗粒主要以类球形为主,但仍有部分无定型小颗粒存在;体系pH=7.5时,MnCO3颗粒呈球形,微观形貌单一、粒径分布均匀;体系pH=8.0时,体系中NH3·H2O浓度较高,容易生成Mn(OH)2或碱式MnSO4,并附着于MnCO3颗粒表面,导致颗粒结构不规则、表面疏松。因此,体系pH优选7.5左右。
2.2 反应温度对MnCO3产品指标的影响
体系pH=7.5,硫酸锰流量30 mL/min,搅拌速度600 r/min,硫酸锰浓度2 mol/L,反应时间13 h,反应温度对MnCO3产品指标的影响结果见表2。
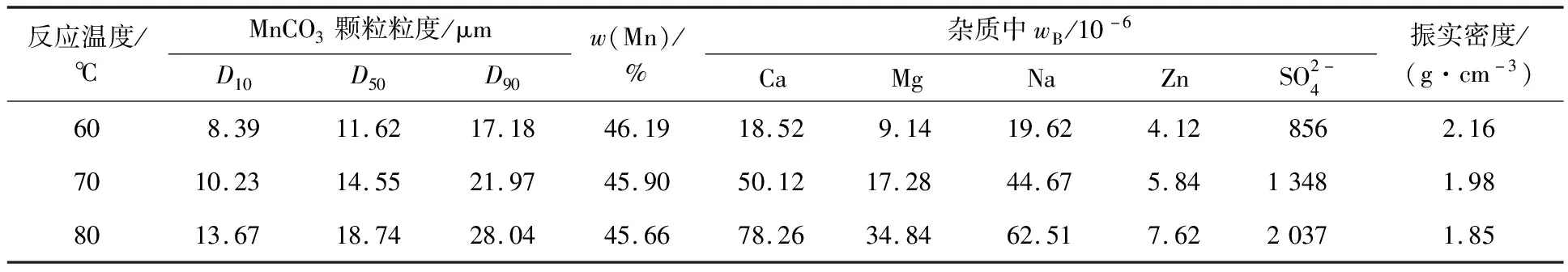
表2 反应温度对MnCO3产品指标的影响
由表2看出:随反应温度升高,MnCO3颗粒粒度增大,Mn质量分数降低。根据阿伦尼乌斯公式lnK=-Ea/RT可知,当体系温度变化很小时,活化能Ea的变化可忽略不计。因此,体系温度升高,反应速率K加快,溶液中分子动能增大,晶核生成速率和长大速率加快,颗粒尺寸增大、更规则;然而,NH3·H2O会有大量挥发,利用率降低,反而不利于Mn2+配合;随温度升高,沉淀与晶体生长速率加快,但过快的反应速率容易使颗粒包裹或吸附更多杂质元素,降低Mn质量分数。综合考虑,确定体系温度不宜高于70 ℃。
2.3 硫酸锰溶液流量对MnCO3产品指标的影响
体系pH=7.5,反应温度60 ℃,硫酸锰浓度2 mol/L,搅拌速度600 r/min,反应时间13 h,硫酸锰流量对MnCO3产品指标的影响试验结果见表3。
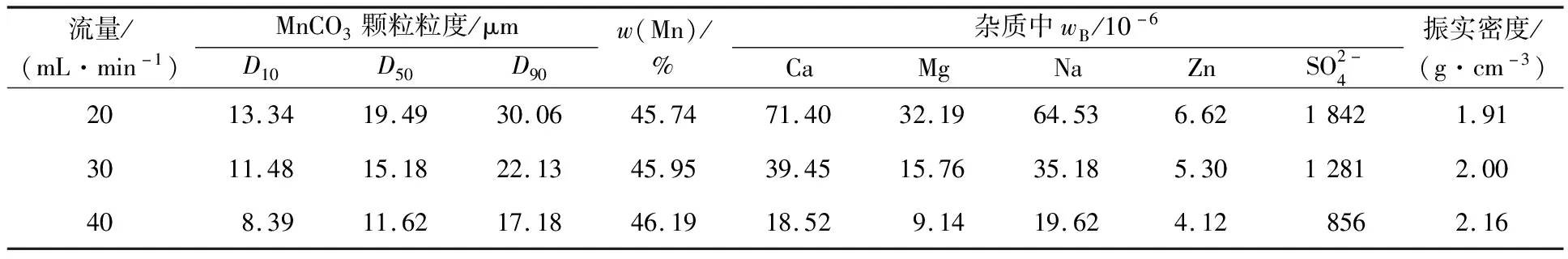
表3 硫酸锰溶液流量对产品指标的影响
由表3看出:随碳酸锰溶液流量增大,MnCO3颗粒粒度减小,Mn质量分数升高。流量增大,体系中Mn2+浓度升高,过饱和度增大,反应更有利于晶核生成,更多晶核的生成使产物平均粒径减小。硫酸锰溶液流动速度越快,越有利于反应物迅速充分混合,使溶液保持较高的过饱和度,弱化晶核生长时间上的差别,进而得到颗粒均匀的MnCO3。因此,确定硫酸锰溶液流量优选30 mL/min。
2.4 搅拌速度对MnCO3产品指标的影响
体系pH=7.5,反应温度60 ℃,硫酸锰溶液流量30 mL/min,硫酸锰浓度2 mol/L,反应时间13 h,搅拌速度对MnCO3产品指标的影响试验结果见表4。可以看出:随搅拌速度增大,MnCO3颗粒粒度逐渐减小,振实密度逐渐提高。搅拌强度较大时,晶体的生长控制由扩散控制转化为表面控制。搅拌速度越大,颗粒表面受到的剪切力越大,剪切与表面细小颗粒的溶解抑制了晶体进一步长大,导致颗粒微观形貌更单一、更致密,粒径分布更均匀,振实密度更大。

表4 搅拌速度对MnCO3产品指标的影响
2.5 工艺验证及产品表征
在上述单因素试验结果基础上确定综合验证试验适宜条件为:控制体系pH=7.5、反应温度60 ℃、硫酸锰溶液流量30 mL/min、搅拌速度600 r/min、硫酸锰溶液浓度2.0 mol/L、反应时间13 h。适宜条件下的验证试验结果见表5。产品粒度分布、SEM照片及XRD图谱分别见图2~4。

表5 适宜条件下MnCO3产品粒度、Mn及杂质质量分数及振实密度
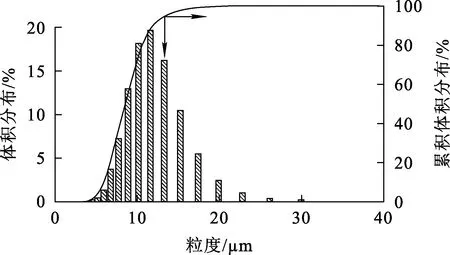
图2 MnCO3产品的粒度分布
由表5看出:适宜工艺条件下所制备类球形MnCO3颗粒粒径为11.13 μm,Mn质量分数为46.22%,杂质质量分数较低,达到了电池级,振实密度较高。由图2看出:最佳条件下所得MnCO3产品颗粒粒度分布范围窄,且颗粒大小均匀。由图3看出:颗粒微观形貌呈类球形,表面平滑、致密性高。由图4看出:产物的XRD图谱与标准图谱(PDF:44-1472)一致,基线平稳,衍射峰尖锐,特征峰明显,无其他杂质峰存在。

图3 MnCO3产品的SEM照片
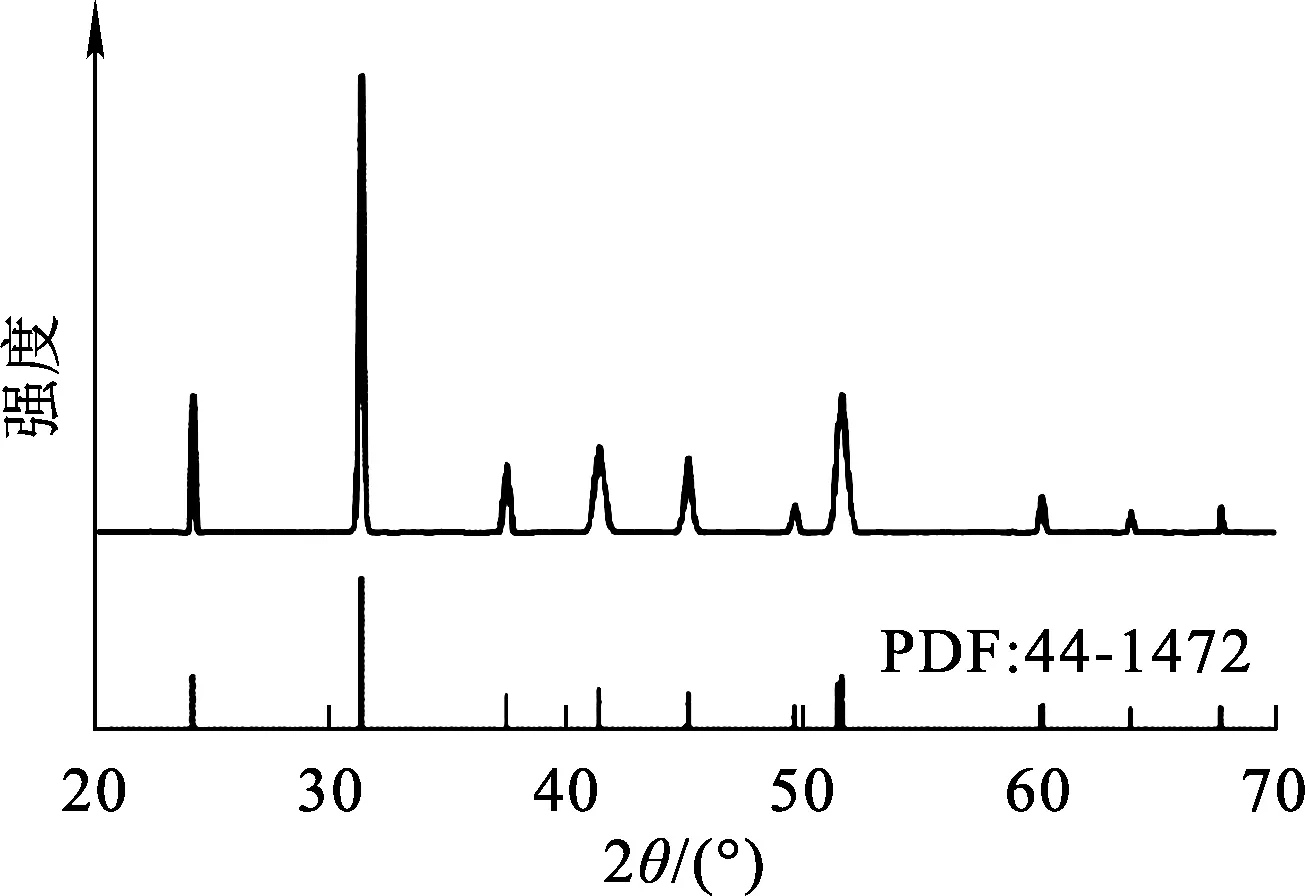
图4 MnCO3产品的XRD图谱
3 结论
以硫酸锰、碳酸铵及氨水为原料可以制备电池级类球形MnCO3。在体系pH=7.5、反应温度60 ℃、硫酸锰流量30 mL/min、搅拌速度600 r/min、硫酸锰浓度2.0 mol/L、反应时间13 h适宜条件下,所制备MnCO3呈类球形颗粒,颗粒粒径为11.13 μm且分布范围窄,振实密度为2.18 g/cm3,Mn质量分数为46.22%,其他杂质质量分数很低。

