淡紫灰链霉菌X33发酵提取物对采后柑橘绿霉病菌的抑制作用
林书华,汪林兰,罗 攀,张 斌,吴晓玉
(江西农业大学生物科学与工程学院 江西农业微生物资源开发与利用工程实验室江西省果蔬采后处理关键技术及质量安全协同创新中心 南昌 330045)
柑橘果肉组织柔嫩多汁且富含糖分,在贮藏和运输过程中果皮易受损而被病原菌侵染,引发采后柑橘病害。其中,柑橘绿霉病是引起柑橘果实腐败的主要病害之一,其致病菌为指状青霉(Penicillium digitatum)。目前,我国预防柑橘采后病害主要采用化学杀菌剂,如:邻苯基苯酚钠、噻苯咪唑、嘧霉胺等[1]。化学杀菌剂具有高效、广谱和使用方便等优势,然而,其安全性问题备受社会关注[2]。因微生物杀菌剂具有高效、低毒、无残留等特点,故众多学者正积极寻找能替代化学杀菌剂的采后柑橘生物防腐剂。
Liu 等[3]发现白色链霉菌(Streptomyces albμLus)发酵产物ε-聚赖氨酸(ε-PL)对指状青霉具有显著抑制效果,经质量浓度为200 mg/L 的ε-PL 处理后,对指状青霉细胞膜有损伤作用,破坏膜结构并诱导脂质过氧化,从而降低绿霉病的发病率。Liu 等[4]从柠檬克勒克酵母(Kloeckera apiculata)34-9 中分离的2-苯基乙醇 (PEA),通过竞争苯丙氨酸-tRNA 合成酶的活性位点来控制柑橘青霉病发生。Ouyang 等[5]用质量浓度为1.78 mg/mL 的植物精油——柠檬醛处理,导致指状青霉细胞膜的一系列变化,包括麦角固醇含量减少以及大量羊毛甾醇积累,抑制麦焦固醇合成基因ERG7,ERG11,ERG6,ERG3,ERG5 的表达。Xin等[6]从直立白薇(Cynanchum atratum Bunge)中分离出生物碱安托芬。安托芬通过破坏指状青霉细胞完整性,干扰能量代谢系统来抑制柑橘绿霉病菌。
本课题组从柑橘根系土壤中分离筛选到1 株柑橘绿霉病的拮抗菌,经鉴定,命名为淡紫灰链霉菌(Streptomyces lavendulae)X33。前期研究发现,其发酵液提取物对柑橘意大利青霉、白地霉、指状青霉等病原菌等均有良好杀菌效果,且无毒、极性强,易溶于水[7]。在随后的结构解析中发现提取物的活性成分为低聚赖氨酸类化合物[8]。本研究以指状青霉为研究对象,分析菌株X33 发酵提取物(Extract of fermentation broth from Streptomyces lavendulae X33,SLFE)对指状青霉的抑制作用,为SLFE 作为柑橘采后防腐剂的研究开发提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株 提取发酵液的菌株X33:淡紫灰链霉菌X33(Streptomyces lavendulae X33)。
采后柑橘绿霉病菌Pd165:指状青霉Pd165(Penicillium digitatum Pd165)。
以上菌株均由江西省农业微生物资源开发利用工程实验室分离、提供。
1.1.2 主要试剂、培养基 主要试剂:氯金酸、柠檬酸三钠、乙醇、浓硫酸、乙酸铅等试剂均为分析纯级,BCA 含量测试盒、丙酮酸试剂盒,南京建成生物工程研究所;基因组DNA 提取试剂盒,康为世纪公司。
发酵培养基(g/L):可溶性淀粉20,牛肉膏3,鱼粉蛋白胨10,NH4Cl 0.6,NaCl 10,CaCO30.02,初始pH 7.0。
PDA 培养基(g/L):土豆200,葡萄糖20,琼脂20,自然pH。
PDB 培养基:不含琼脂的PDA 培养基。
1.1.3 主要仪器及设备 Quanta 250 扫描电子显微镜,美国赛默飞世尔科技公司;SCIENTists-10N冷冻干燥机,宁波新芝生物科技股份有限公司;NanoDrop one 超微量分光光度计,美国赛默飞世尔科技公司;Eclipse Ti-S 倒置荧光显微镜,日本尼康仪器有限公司;DXR 激光共聚焦显微拉曼光谱仪,美国Thermo Scientificic 公司;T6 新世纪紫外可见分光光度计,北京普析通用仪器有限公司。
1.2 方法
1.2.1 SLFE 的提取与配制 基于课题组前期的提取方法,略有改进[9]。将菌株X33 接种于发酵培养基,28 ℃,180 r/min 振荡培养96 h,离心、收集上清液;利用D101 大孔树脂柱洗脱上清液,经薄层检测和抑菌活性追踪后,收集抑菌活性物质粗提液;粗提液再经C18 柱层析,纯水洗脱,将有抑菌活性的精提液冷冻干燥,获得粉末状物质为淡紫灰链霉菌X33 发酵液提取物 (SLFE),SLFE 称量后溶于无菌水,保存于4 ℃冰箱备用。
1.2.2 病菌Pd165 孢子悬液制备 用生理盐水将28 ℃培养5 d 的病菌Pd165 孢子洗入三角瓶,8 层无菌纱布过滤,除去菌丝,血球计数板计数,调整孢子悬液浓度为107个/mL。
1.2.3 SLFE 处理对病菌Pd165 生长的检测
1) 对病菌Pd165 菌丝干重的影响 将1 mL菌株Pd165 孢子悬液接入50 mL PDB 培养液,28℃,180 r/min 振荡培养至对数生长期(48 h),加入不同浓度的SLFE,以加等量无菌水为对照,继续培养96 h,过滤,收集菌丝体,干燥至恒重后称重。
2) 对病菌Pd165 产孢量的影响 参考曾志红等[10]的方法。取200 μL 菌株Pd165 孢子悬液,分别均匀涂布于含质量浓度1.2,2.4,4.8 mg/mL的SLFE 的PDA 平板上,对照组涂布等量无菌水。置于28 ℃,培养5 d 后,0.85%生理盐水将斜面孢子洗入三角瓶,8 层纱布过滤,制成孢子悬液,用血球计数板分别计算对照组(A1)、处理组(A2)的孢子数量,单位:个/mL。

1.2.4 SLFE 处理对菌株Pd165 菌丝体形态的观察 参考Ju 等[11]方法并略作修改。取200 μL 菌株Pd165 孢子悬液均匀涂布在SLFE 质量浓度为4.8 mg/mL 的PDA 平板上,对照组加入等量无菌水,取灭菌盖玻片45°倾斜插入平板,28 ℃培养,待菌丝爬片长满盖玻片时取出。将盖玻片置于2.5%的戊二醛溶液中,4 ℃避光固定12 h;磷酸缓冲液(0.1 mol/L pH 7)漂洗3 次,每次10 min;进行梯度脱水,乙醇体积分数分别为30%,50%,70%,80%,90%,95%,100%,每个体积分数处理6 min。
最后将处理好的盖玻片置于冷冻干燥机中干燥,喷金后扫描电子显微镜观察。
1.2.5 SLFE 处理对菌株Pd165 菌丝细胞完整性的观察 采用FDA-PI 双色荧光法检测指状青霉细胞完整性[12]。在PDA 培养基中加入4.8 mg/mL的SLFE、插片培养指状青霉(方法同1.2.4 节)。选取已长满病原菌的盖玻片,加入二乙酸荧光素(FDA)2.5 μmol/L,避光反应10 min,再加入10 μL 0.5 μmol/L 碘化丙啶(PI),避光反应10 min。将其置于荧光显微镜下观察。
1.2.6 表面增强拉曼光谱(SERS)在抑菌过程中的应用
1.2.6.1 SERS 基底的制备 在250 mL 的烧杯中加入0.01%氯金酸溶液100 mL,超声混匀,将其置于预热好的电炉上加热至沸腾。迅速加入0.7 mL 1%柠檬酸三钠溶液,待其颜色变成红棕色后,继续加热8 min,冷却至室温,避光保存备用[13]。
1.2.6.2 SERS 对细胞外漏物质的检测 采用1.2.3 节的方法培养菌丝体,通过真空抽滤收集约1 g 2日龄的菌丝体,并重悬于20 mL 0.85%的生理盐水中,4 ℃冷藏使菌丝饥饿24 h。分别加入质量浓度1.2,2.4,4.8 mg/mL 的SLFE,对照组(CK)加入等量无菌水。SLFE 与CK 分别处理120 min 后,取1 mL 悬浮液转移至EP 管中,并在12 000 r/min 冷冻离心5 min,收集上清液。将100 μL 上清液滴入含有400 μL 的胶体Au 纳米颗粒中,并充分混合,置于共聚焦显微拉曼光谱仪检测[14]。
1.2.7 SLFE 处理对菌株Pd165 菌丝内容物的测定 采用1.2.3 节的方法,分别取对照组和处理组的菌丝各0.5 g,置于含pH 7.0 PBS 2 mL 的研钵中,加入适量石英砂,冰浴研磨成匀浆,4 ℃,10 000 r/min 冷冻离心20 min,取上清液,用于测定可溶性蛋白、还原糖和丙酮酸的含量。
分别采用蒽酮比色法[15],二辛可宁酸法(Bicinchoninic acid method,BCA)法[16]和硫代巴比妥酸法[17]测定上述上清液中还原糖、可溶性蛋白和丙酮酸的含量。
1.2.8 SLFE 处理对与菌株Pd165 遗传物质的影响
1.2.8.1 荧光光谱法检测SLFE 对指状青霉DNA含量的影响 采用康为世纪基因组DNA 提取试剂盒提取病菌Pd165 DNA。采用超微量分光光度计检测提取DNA 的纯度和浓度。用0.01 mol/L Tris-HCl(pH 7.2)将真菌基因组DNA 稀释至60 μg/mL。将不同质量浓度的SLFE(0,1.2,2.4,4.8 mg/mL)加入到相同体积(60 μg/mL)的DNA 溶液中,黑暗处理1 h。采用荧光酶标仪在激发波长280 nm 下,测量混合物从360~500 nm 波长下的荧光光谱[18]。
1.2.8.2 SLFE 对细胞应答相关基因表达的影响根据有关丝状真菌细胞应答基因的报道[19-21],本研究选择并设计4 对荧光定量PCR 引物(表1)。提取处理组 (1.2 mg/mL) 和对照组菌丝体总RNA,经完整性检测合格后,反转录成cDNA,并进行荧光定量PCR 试验。20 μL 反应体系:2×T5 Fast qPCR 预混液10 μL、PCR 正向引物0.8 μL、PCR反向引物0.8 μL、cDNA 1 μL、ddH2O 7.4 μL。扩增条件:95 ℃预变性1 min,95 ℃变性15 s,60 ℃退火15 s,40 个循环;采用2-ΔΔCt法以actin 作为内参来量化每个样本的值。

表1 荧光定量PCR 基因扩增的引物序列Table 1 Primer sequences for gene amplification by fluorescence quantitative PCR
1.3 数据处理
所有试验设置3 组重复,数据以“平均值±标准差”表示。采用Origin 9.0 作图,DPS 7.05 进行数据分析。
2 结果与分析
2.1 SLFE 对菌株Pd165 菌丝干重与产孢量的影响
指状青霉菌丝的生长受到SLFE 显著抑制(图1)。不同质量浓度SLFE 处理组的菌丝干重均显著低于对照组 (菌丝干重3.82 mg/mL);随着SLEF 质量浓度增大,对指状青霉抑制作用增强;当SLFE 的质量浓度达到4.8 mg/mL 时,菌丝干重(2.13 mg/mL)较对照组(CK)降低1.69 mg/mL,降低了44.24%。

图1 SLFE 对指状青霉菌丝生长的影响Fig.1 Effect of SLFE on mycelial growth of P.digitatum
SLFE 处理菌株Pd165 后,其产孢量明显降低(表2)。与对照组(CK)相比,质量浓度为1.2,2.4,4.8 mg/mL 的SLFE 处理组产孢量分别为2.09×108,1.27×108,9.4×107个/mL,产孢抑制率分别为94.9%,97.0%,97.8%;各处理组产孢量均显著低于对照组(P<0.05);且SLFE 浓度越高,对指状青霉产孢能力的抑制更强。

表2 SLFE 对指状青霉产孢量的影响Table 2 Effect of SLFE on sporulation quantity of P.digitatum
上述结果表明:SLFE 对指状青霉的菌丝生长及产孢能力具有较好的抑制效果。
2.2 SLFE 对菌株Pd165 菌丝和孢子形态的影响
从图2可知,经SLFE 处理后的菌株Pd165形态发生明显改变。对照组的分生孢子为球形,形态规则且饱满(图2a),而处理组的分生孢子变形为不规则的椭圆,且孢子表面出现凹陷、皱缩(图2b);对照组的菌丝形态饱满、生长旺盛(图2c),而处理组菌丝细、干瘪,并发生折叠(图2d)。

图2 SLFE 对指状青霉分生孢子和菌丝形态的影响Fig.2 Effect of SLFE on morphology of the conidia and hyphae of P.digitatum
2.3 SLFE 对菌株Pd165 菌丝细胞完整性的影响
为探明SLFE 对指状青霉菌丝体细胞活性状态的影响,使用FDA-PI 双染色法对菌株Pd165菌丝体染色。当细胞膜完整时,PI 无法进入细胞着色,FDA 在胞内酯酶作用下形成荧光素,使完整细胞发出绿色荧光;当细胞膜受损时,FDA 形成的荧光素无法在细胞内积聚,无法发出绿色荧光,而PI可进入细胞,与胞内核酸物质作用生成红色荧光物,因而受损细胞呈红色荧光。将染色后的菌丝体置于荧光显微镜下观察。对照组菌丝体经染色后细胞显现绿色荧光(图3a),仅有微弱的红色荧光(图3c),而SLFE 处理组菌丝细胞大部分呈红色荧光(图3d),少数为绿色荧光(图3b)。结果表明:菌株Pd165 菌丝体经SLFE 处理后,细胞膜的完整性受到破坏。

图3 荧光显微镜观察指状青霉菌丝细胞膜的完整性Fig.3 Observation of the integrity of pathogenic P.digitatum membrane by laser confocal microscope
2.4 SLFE 对病菌Pd165 菌丝细胞物质外漏的影响
利用拉曼光谱进一步研究了SLFE 对病菌Pd165 菌丝细胞物质外泄的影响。与对照组相比,SLFE 处理后的菌株Pd165 胞外液在400~1 800 cm-1范围内呈现出显著的特征峰变化(图4)。其中,最明显的特征峰1 330 cm-1(核酸特征峰)[22]、1 129 cm-1(脂肪酸特征峰)[23]、1 570 cm-1(蛋白质酰胺II 特征峰)[24]在经不同浓度的SLFE 处理后,较对照组的峰值明显增强,且随SLFE 质量浓度增加,特征峰峰值增大。表明与对照组相比,SLFE 处理后胞外液中脂肪酸、蛋白质及核酸等大分子物质含量增加,推测可能是由于菌丝细胞膜受损,引发胞内大分子物质外泄。

图4 不同质量浓度SLFE 处理指状青霉的SERSFig.4 SERS spectra of P.digitatum treated with different concentrations of SLFE
2.5 SLFE 对菌株Pd165 菌丝内容物的影响
2.5.1 对病菌Pd165 菌丝还原糖含量的影响 病菌Pd165 经质量浓度1.2,2.4,4.8 mg/mL 的SLFE处理后,病菌菌丝体内还原糖含量分别为0.53%,0.39%,0.10%,均显著低于对照组(0.87%,图5a);且SLFE 质量浓度越高,菌丝还原糖含量越低;当SLFE 质量浓度为4.8 mg/mL 时,处理组菌丝总糖较对照组下降了81.13%。
2.5.2 对病菌Pd165 可溶性蛋白含量的影响 病菌Pd165 经不同浓度SLFE 处理后,各浓度处理组(1.2,2.4,4.8 mg/mL SLFE)菌丝可溶性蛋白含量分别为0.09,0.07,0.04 mg/g(图5b),较对照组(0.12 mg/g) 含量分别降低25.00%,41.67%,66.67%。SLFE 处理后菌株Pd165 菌丝体内可溶性蛋白含量显著减少,SLFE 质量浓度越高,可溶性蛋白含量下降越显著。
2.5.3 对病菌Pd165 菌丝丙酮酸含量的影响 病菌Pd165 菌丝体内丙酮酸含量随着SLFE 处理浓度的升高呈下降趋势(图5c)。对照组菌丝体丙酮酸含量为2.74 mg/g,而经4.8 mg/mL 的SLFE 处理后,菌丝体内丙酮酸含量为1.61 mg/g,含量降低率达到41.41%。

图5 SLFE 对指状青霉菌丝内容物的影响Fig.5 Effect of SLFE on mycelial ingredients of P.digitatum
2.6 SLFE 对菌株Pd165 遗传物质的影响
2.6.1 对病菌Pd165 基因组DNA 的影响 采用荧光光谱技术分析SLFE 与DNA 的体外结合情况[25]。与对照组相比,随着SLFE 质量浓度的增加,各处理组中均表现出明显的荧光猝灭 (图6),表明SLFE 可与DNA 结合,导致DNA 的结构和构象发生变化。

图6 SLFE 对指状青霉基因组DNA 的影响Fig.6 Effect of SLFE treatment on genetic DNA of P.digitatum
2.6.2 对细胞应答相关基因表达的影响 选取与细胞壁生物合成、能量代谢、氧化应激与产孢等有关的4 个基因:cej60377.1 (编码几丁质酶——CHI)、oko99898.1 (编码酰基辅酶A 脱氢酶——ACAD)、crl18986.1(编码过氧化物酶——POD)和kzn90160.1(编码BRLA),荧光定量PCR测定其基因表达量,结果见表3。经1.2 mg/mL SLFE 处理后,4 个基因的表达水平均显著高于对照组。
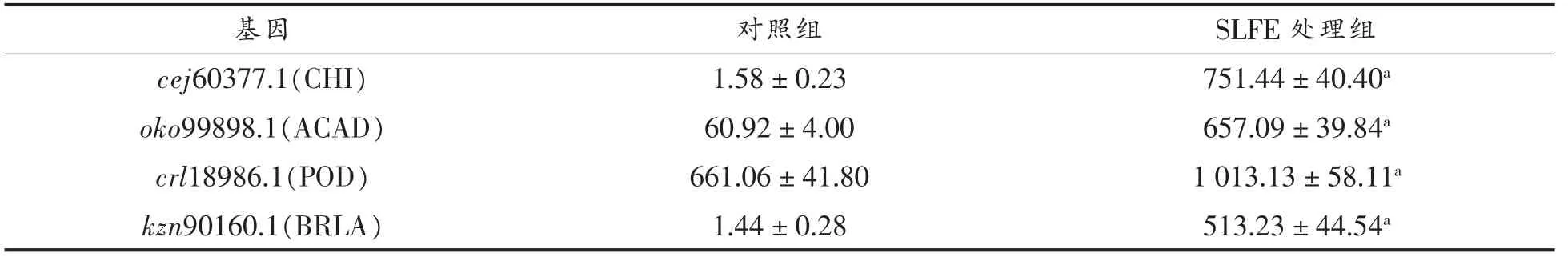
表3 SLFE 对指状青霉细胞应答相关基因表达的影响Table 3 Effects of SLFE on the expression of response-related genes in P.digitatum
3 讨论
与化学杀菌剂相比,SLFE 具有易溶于水、无毒、广谱、抗菌性强等优势。正常条件下,菌株Pd165 在PDB、PDA 培养基中可快速生长、产孢,而经SLFE 处理后,菌株Pd165 菌丝生长量和产孢量明显减少,且菌丝体和孢子形态被严重破坏,菌丝细而干瘪,并发生折叠,分生孢子变形为不规则的椭圆,且孢子表面出现凹陷、皱缩。1.2 mg/mL的SLFE 对病菌Pd165 产孢抑制率高达94.86%,且SLFE 的抑菌效果呈现剂量-效应关系。
为深入探讨SLFE 对菌株Pd165 的抑制机制,本研究使用FDA-PI 双染色法对病菌Pd165菌丝体染色,SLFE 处理组菌丝细胞大部分呈红色荧光,少数为绿色荧光,说明经SLFE 处理后的病菌Pd165 菌丝体细胞膜的完整性受到破坏。运用拉曼光谱检测SLFE 处理后的病菌Pd165 胞外液,其中代表脂肪酸、核酸和蛋白质的吸收峰:1 129,1 330,1 565 cm-1同时增强。由此更进一步证实由于细胞膜完整性被破坏,造成病菌Pd165胞内脂肪酸、核酸和蛋白质的外泄。这与黄飞[26]研究发现反式肉桂醛处理对意大利青霉菌丝体细胞膜结构具有损伤作用的研究结果相似。
通过检测菌株Pd165 菌丝体胞内的还原糖、可溶性蛋白、丙酮酸含量在添加不同质量浓度SLFE 后的变化,发现三者含量均显著降低,4.8 mg/mL 的SLFE 处理后,三者分别下降81.13%,66.67%和41.41%。还原糖和可溶性蛋白是细胞内重要组成成分,丙酮酸是参与生物体基础代谢的中间产物之一,在糖、脂肪、氨基酸的代谢联系中起着重要的枢纽作用,这3 种胞内物质含量的下降表明菌丝体合成代谢出现紊乱,无法维持正常的生长与生理功能。Chen 等[27]研究发现经7-脱甲氧基酪氨酸处理后的意大利青霉菌体胞内还原糖、可溶性蛋白含量显著降低,这与本研究结果一致。
Parveen 等[28]研究表明酵母细胞通过诱导CHI的过量表达,进而激活了细胞壁的代偿机制以克服α-萜品烯的毒性;Guo 等[29]研究表明2-甲氧基-1,4-萘醌上调了与能量产生相关的蛋白——ACAD,从而扰乱病菌Pd165 的代谢过程,以发挥抑菌作用;Fan 等[30]研究表明,NO 通过诱导抗氧化酶(SOD 和POD)基因的过表达,以保护狗牙根免受冷胁迫;王明爽[31]报道BrlA 的过量表达会导致病菌Pd165 菌丝停止生长和菌丝尖端直接形成分生孢子。本研究的荧光定量PCR 试验发现,SLFE处理病菌Pd165 后,菌株显著上调了上述4 种酶的基因表达量,推测病菌Pd165 受到SLFE 胁迫后,激活细胞壁代偿机制,导致细胞壁结构受损;酰基辅酶A 脱氢酶是参与催化脂肪酸与氨基酸分解代谢中的脱氢酶,其基因表达量上调加速了脂肪酸和氨基酸分解代谢,引起细胞合成代谢紊乱。过氧化物酶(POD)作为细胞内重要的内源活性氧清除剂,其基因的过表达可能是SLFE 处理激活了病菌Pd165 细胞内防御酶系,以增强细胞清除活性氧能力,防止细胞损伤;BrlA 是调节分生孢子形成的重要元件,其基因的过量表达可能是造成菌丝生长慢和分生孢子少的原因之一。此外,DNA结合试验发现SLFE 可与指状青霉DNA 结合导致破坏其结构与构象。
综上,SLFE 对柑橘病原菌菌株Pd165 的抑菌作用主要是引发细胞完整性受损,扰乱细胞内原有的稳态,使核酸、糖类、可溶性蛋白等内容物渗出;SLFE 可与DNA 结合,抑制DNA 功能的表达;同时诱导与细胞壁生物合成、能量代谢、氧化应激与产孢等有关的基因的过表达,最终达到杀菌作用。一些活性抗菌成分也有相似的抑菌机制,如α-水芹烯和壬醛对圆弧青霉的抑菌机制是攻击细胞膜和破坏菌丝结构[32]。石竹烯对热杀索丝菌的抑菌机理是攻击病菌细胞壁和细胞膜,使胞内物质外泄,影响细胞正常生长代谢;且与基因组DNA 结合,破坏其结构与构象,抑制病菌生长[33]。
4 结论
本研究将SLFE 作用于病菌Pd165,结果表明不同质量浓度的SLFE 对菌株Pd165 均有一定的抑制作用,且呈现剂量效应。SLFE 通过影响菌株Pd165 细胞结构的完整性,致使核酸、糖类、可溶性蛋白等细胞内容物外渗,诱导参与细胞应答反应的部分基因过量表达,从而达到抑菌、杀菌效果。SLFE 能抑制病菌Pd165 的生长,可用于柑橘采后绿霉病的防治,有望开发为环境友好型的新型生物防腐剂。

