茴拉西坦对局灶性脑缺血再灌注损伤模型大鼠的神经保护作用*
柴 娟,张潇潇,李 丹,徐沙丽
(华中科技大学同济医学院附属梨园医院神经内科,湖北 武汉 430077)
脑缺血再灌注(I/R)损伤是严重的健康问题[1],其损伤机制复杂,其中炎性损害影响较大,可能成为潜在的治疗靶点[2]。NLRP3 是重要的组织损伤传感器,线粒体受损释放线粒体DNA(mtDNA)和线粒体活性氧(mtROS)激活了NLRP3 炎性体[3],NLRP3 直接与衔接子分子ASC 结合,后者随后募集并激活半胱氨酸天冬氨酸蛋白酶-1前体(pro-caspase-1),促进NLRP3炎性小体的细胞质多蛋白复合物形成,该复合物能将前体白细胞介素1β(IL-1β)和前体白细胞介素18(IL-18)裂解成活性形式,启动和放大炎性反应[4]。NLRP3炎性体活性的功能障碍与多种疾病有关,如阿尔茨海默病、2型糖尿病、动脉粥样硬化和癌症[5],同时NLRP3炎性体的激活可促进脑I/R损伤的病理发展。激活转录因子4(ATF4)是主要的内质网应激(ERS)反应效应物,参与多种疾病的进程,其在细胞存活和死亡中的作用尚不完全清楚。严重或长期的ERS 后,PERK-elF2α-ATF4-CHOP 信号级联反应的激活是ERS 诱导凋亡细胞死亡的原因[6]。研究表明,在帕金森症细胞模型中,ATF4可抑制神经细胞的凋亡[7-8]。茴拉西坦具有神经保护作用,可保护模型大鼠和小鼠的大脑免受缺血性中风的侵袭[9]。茴拉西坦可缩小中风急性期缺血性脑梗死的面积,减少DNA片段化和线粒体细胞色素c释放并抑制脑中半胱氨酸天冬氨酸蛋白酶-3(caspase-3)的活性。本研究中探讨了茴拉西坦对局灶性脑I/ R 模型大鼠的神经保护作用及其作用机制,为脑I/ R 的治疗提供参考。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:5-0 尼龙单丝(北京奇诺科技有限公司);IMT-2 型倒置相差显微镜(日本Olympus 公司);StepOne Plus 型荧光定量PCR 仪(美国AB 公司);DYY-6C型电泳仪(北京市六一仪器厂)。
试药:茴拉西坦(批号为ED63652.36)、尼莫地平(批号为XS52963.36),均购自亚宝药业集团股份有限公司;聚L-赖氨酸(美国Sigma 公司,批号为SX85954);苏木素-伊红(HE)染色试剂(大连宝生物科技有限公司,批号为DF4569.36);Trizol 试剂(美国Invitrogen 公司,批号为SE56969.36);PrimeScriptRT 试剂盒(德国Merck 公司,批号为514489);iCycler IQ 多色检测系统(美国Bio-Rad 公司);蛋白酶抑制剂的RIPA裂解缓冲液(美国Sigma-Aldrich 公司,批号为ER47636);BCA 蛋白测定试剂盒(北京活力生物技术有限公司,批号为TY45858.36);SDS-PAGE 凝胶(加拿大TakaraBioInc.,批号为6569748);硝酸纤维素膜(美国Millipore公司,批号为WS152545.63);小鼠单克隆抗人ATF4、NLRP3 一级(1∶1 000,1∶2 000,批号分别为ED4526.98,ER8597.54),小鼠单克隆抗人类GAPDH(1∶500 0,批号为XD41586.96),HRP 偶联的山羊抗小鼠免疫球蛋白IgG(1∶5 000,批号为EC52564.74),均购自美国Santa Cruz Biotechnology公司;电发光ECL试剂盒(美国Cell Signaling Technology公司,批号为MN5254.67)。
动物:SD 大鼠100 只,SPF 级,雌雄各半,8~10 周龄,体质量280~300 g,由重庆医科大学实验动物中心提供,动物生产许可证号SCXK(渝)2020-0003。大鼠饲养环境为温度22~26 ℃,相对湿度40%~70%,人工黑暗和光照交替12 h/12 h。
1.2 实验方法
模型复制与分组、给药:将100 只SD 大鼠分为对照组(A 组,等体积0.9%氯化钠溶液)、模型组(B 组,等体积0.9%氯化钠溶液)、尼莫地平组(C组,50 mg/kg),以及茴拉西坦低、高剂量组(D1组、D2组,50,100 mg/kg)[10],各20只。腹腔注射戊巴比妥(50 mg/kg)麻醉大鼠,然后在腹中线颈部切口,向左暴露并结扎左颈总动脉和外颈动脉。将5-0 尼龙单丝的末端涂有聚L-赖氨酸的钝头插入颈内动脉,并向前进入大脑中动脉起源,直至遇到轻微阻力,局部脑血流量(CBF)较基线水平降低20%;闭塞1 h 后,缓慢抽出尼龙单丝实现再灌注,CBF为基线的75%表明局灶性脑I/ R 大鼠模型复制成功。建模成功后灌胃相应药物或等体积0.9%氯化钠溶液(每100 g体质量1 mL),每日1次,连续4周。
双侧贴纸去除时间、平衡木过杆时间、Longa 评分、脑梗死体积测定:进行贴纸去除及平衡木行走实验[8-9]。采用Longa 评分评价脑神经功能。4 分,不能自发行走,意识丧失;3 分,身体向左侧倾倒;2 分,自主运动时向左侧划圈;1分,不能伸展左侧前爪;0分,无神经功能损伤症状。测定脑梗死体积,并计算脑梗死体积百分比(右侧脑梗死面积× 切片厚度/ 右侧脑组织总体积×100%)。
脑病理组织学改变观察:取出脑组织,固定,脱水,包埋,切片,HE 染色,在显微镜下观察大鼠脑组织病理形态学。
ATF4 和NLRP3 mRNA 表达水平测定:取冻存的大鼠脑组织样本50 mg,采用Trizol 法提取 总RNA,鉴定完RNA 纯度和完整性后,采用逆转录制备cDNA。PCR反应条件为,95 ℃预变性10 s;94 ℃变性15 s,40 个循环;55 ℃退火30 s;70 ℃延伸30 s终止反应。读取循环阈值(Ct值),以2-ΔΔCt表示目的基因mRNA 的表达量。各组设3 个复孔,实验重复3 次。由RiboBio(中国广州)设计的ATF4,NLRP3引物。引物序列为ATF4,5'-GAAGCTCCTACGCCTTTG-3',5'-TCCTCCCTTCAACATTCTG-3';NLRP3,5'-AGGGTTCACAGTGGCTAAG-3',5'-GAGAGGAGAGGAAGAGGGAA-3';GAPDH,5'-TCCTCTGACTTCAACAGCGACAC-3',5'-CACCCTGTTGCTGTAGCCAAATTC-3'。
ATF4 和NLRP3 蛋白表达水平测定:取冻存的大鼠脑组织样本50 mg,加入含有蛋白酶抑制剂的RIPA 裂解缓冲液,以BCA 法测定蛋白含量。各组取20 μg,上样,10% SDS-PAGE 电泳后电转。用含0.1%Tween-20 Tris缓冲液的5%脱脂奶粉封闭2 h;加入1抗,4 ℃孵育过夜;加入HRP偶联的山羊抗小鼠IgG,室温振摇1 h;加入ECL 化学发光试剂,将PVDF 膜放入暗盒中,压上X 胶片,取出胶片后显影、定影、清洗;然后以Quantity One 软件将条带灰度值数字化,以目的条带(ATF4,NLRP3)与内参条带(GAPDH)灰度比值为各目的蛋白相对表达量。
1.3 统计学处理
2 结果
2.1 双侧贴纸去除时间、平衡木过杆时间、Longa 评分、脑梗死体积
与A 组比较,B 组大鼠双侧贴纸去除时间和平衡木过杆时间均显著延长,脑梗死体积增大,Longa 评分显著升高(P <0.05);与B 组比较,C 组、D1组和D2组大鼠双侧贴纸去除时间、平衡木过杆时间均显著缩短,脑梗死体积显著缩小,Longa 评分显著降低(P <0.05)。详见表1。
表1 各组大鼠双侧贴纸去除时间、平衡木过杆时间、Longa评分、脑梗死体积比较(,n=20)Tab.1 Comparison of bilateral sticker removal time,balance beam passing time,Longa score and cerebral infarction volume of rats in each group(,n=20)

表1 各组大鼠双侧贴纸去除时间、平衡木过杆时间、Longa评分、脑梗死体积比较(,n=20)Tab.1 Comparison of bilateral sticker removal time,balance beam passing time,Longa score and cerebral infarction volume of rats in each group(,n=20)
注:与A组比较,*P <0.05;与B组比较,#P <0.05。表2同。Note:Compared with those in group A,*P <0.05(for Tab.1 and Tab.2);Compared with those in group B,*P < 0.05(for Tab.1 and Tab.2).
2.2 脑组织病理形态学
A 组大鼠脑组织结构正常,神经细胞均匀分布,无异常;B 组大鼠脑组织出现空泡坏死灶,神经细胞体积变大(坏死),分布紊乱,可见显著炎性细胞浸润;C 组、D1组和D2组大鼠的脑组织结构均趋于正常,神经细胞坏死显著减少。详见图1。
2.3 脑组织ATF4 和NLRP3 mRNA 表达水平
与A组比较,B组大鼠脑组织ATF4 mRNA表达水平显著降低,NLRP3 mRNA表达水平显著升高(P <0.05);与B 组比较,C 组、D1组和D2组大鼠脑组织ATF4 mRNA表达水平均显著升高、NLRP3 mRNA 表达水平显著降低(P <0.05)。详见表2。
表2 各组大鼠脑组织ATF4和NLRP3 mRNA及蛋白表达水平比较(,n=20)Tab.2 Comparison of ATF4 and NLRP3 mRNA and protein expression levels in brain tissue of rats in each group(,n=20)
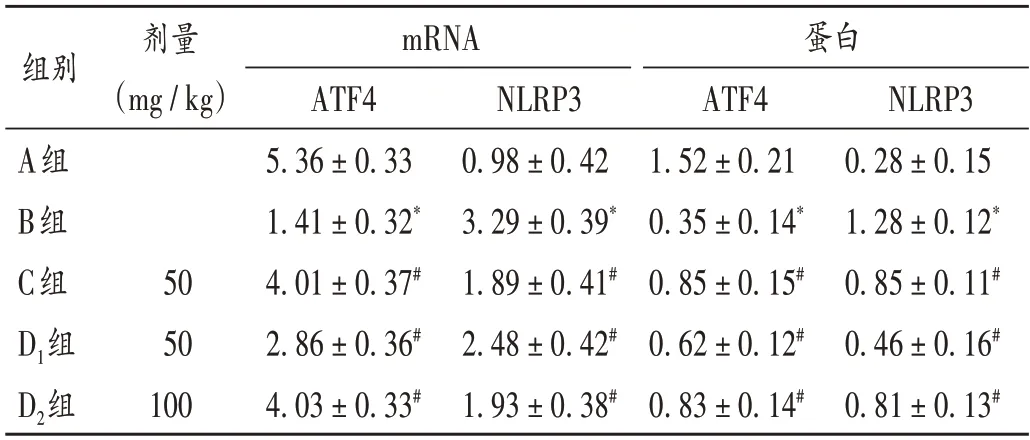
表2 各组大鼠脑组织ATF4和NLRP3 mRNA及蛋白表达水平比较(,n=20)Tab.2 Comparison of ATF4 and NLRP3 mRNA and protein expression levels in brain tissue of rats in each group(,n=20)
2.4 脑组织ATF4 和NLRP3 蛋白表达水平
与A 组比较,B 组大鼠脑组织ATF4 蛋白表达水平显著降低,NLRP3 蛋白表达水平显著升高(P <0.05);与B组比较,C组、D1组和D2组大鼠脑组织ATF4 蛋白表达水平均显著升高,NLRP3蛋白表达水平显著降低(P <0.05)。详见表3。
3 讨论
本研究结果显示,C 组、D1组和D2组大鼠双侧贴纸去除时间、平衡木过杆时间均短于模型组,脑梗死体积小于B 组,Longa 评分低于B 组(P <0.05)。表明茴拉西坦能缩小局灶性脑I/ R 模型大鼠脑梗死体积,其高剂量效果与尼莫地平相似。尼莫地平为钙拮抗剂,用于缺血性脑血管病、偏头痛、轻度蛛网膜下腔出血所致脑血管痉挛的治疗,是脑I/R 损伤的经典治疗药物[11]。茴拉西坦属拉西坦类脑细胞代谢药,能增强神经细胞突触内磷脂酶活性,并增加脑内三磷酸腺苷(ATP)的形成和转运,增加蛋白质和核糖核酸(RNA)的合成,促进大脑对氨基酸、磷脂、葡萄糖和氧的利用,增加机体反应性和兴奋性[12]。口服茴拉西坦可显著抑制硫代巴比妥酸反应性物质的生成,并减缓前脑I/ R 后大鼠脑中谷胱甘肽过氧化物酶(GPx)的流失[13]。本研究结果与上述研究结论一致。
茴拉西坦可降低大脑中动脉闭塞后大鼠的脑内细胞炎性反应和氧化损伤,对脑I/R 具有神经保护作用,其机制与减轻内质网应激介导的细胞凋亡有关[14]。本研究结果显示,对照组大鼠脑组织结构正常,神经细胞均匀分布,无异常;模型组大鼠脑组织出现空泡坏死灶,神经细胞体积变大(坏死),分布紊乱,可见明显炎性细胞浸润;尼莫地平组及茴拉西坦低、高剂量组大鼠脑组织结构趋于正常,神经细胞坏死明显减少。提示茴拉西坦能减轻灶性脑缺血再灌注大鼠脑神经炎性反应,与上述结论一致。
多项研究表明,活化的NLRP3 炎性小体及其相关细胞因子对脑I/ R 损伤有显著影响[15]。使用siRNA 敲除NLRP3 可减轻脑I/ R 损伤[16]。ATF4 属细胞保护因子,ATF4 上调在鱼藤素介导的神经细胞死亡中具有保护作用;ATF4 诱导的sestrin 2 上调是保护一氧化碳诱导肝脂肪变性的原因。目前,ATF4对脑I/R损伤的作用及其潜在机制均未完全阐明。动物实验结果表明,ATF4的过表达降低了脑I/R 损伤后IL-1β,IL-18,mtROS及活化的NLRP3 炎性小体水平[17]。可见,ATF4 可能通过抑制NLRP3炎性体的活化而在脑I/R 损伤中发挥神经保护作用。在短暂性脑缺血性损伤中,ATF4可能通过抑制核转录因子CHOP 而减轻内质网应激所致神经细胞凋亡[18]。本研究结果显示,尼莫地平组及茴拉西坦低、高剂量组大鼠脑组织ATF4 mRNA 和蛋白的表达水平均高于模型组,NLRP3 mRNA 和蛋白表达水平低于模型组(P <0.05),表明茴拉西坦通过促进局灶性脑I/ R 模型大鼠脑组织ATF4 的表达而抑制NLRP3 的表达,与上述结论一致。
综上所述,茴拉西坦对I/ R 模型大鼠具有一定神经保护作用,其机制与促进大鼠脑组织ATF4 表达、抑制NLRP3表达有关。

