中华鳖胚胎肝成纤维细胞的原代培养及其聚肌苷酸胞苷酸(Poly I:C)刺激模型构建
王水涛,何盛盛,江玲丽,高有领,*
(1.浙江万里学院 生物与环境学院,浙江 宁波 315100; 2.宁波卫生职业技术学院,浙江 宁波 315100)
中华鳖()营养丰富,富含不饱和脂肪酸、必需氨基酸、维生素和微量元素,具有良好的养殖效益,是我国重要的特种经济水生动物。近年来,随着消费市场的成熟,中华鳖养殖业发展十分迅速,2019年我国所有种类鳖的产量达到32.55万t,其中,中华鳖占了绝大部分,但频发的病害,严重制约中华鳖养殖业的可持续发展。危害中华鳖的病原种类繁多,其中,病毒性疾病由于缺乏有效的诊断方法和防治方法,危害性远高于其他病原引起的疾病。先前,对中华鳖病毒性疾病的研究主要集中在组织病理学、超微结构变化和电镜观察等方面,这些方法虽然能分离和鉴定出一些病毒病,但关于大部分病毒病的发生和致病机理尚不明确。病毒只能在天然宿主或其他合适的活细胞内繁殖,且病毒感染宿主时有种属特异性;因此,建立中华鳖源细胞系对其免疫学和病原微生物学研究来说都非常重要。目前,研究人员已在中华鳖的细胞系建立和培养条件优化方面取得了一些进展:李晓莉等建立了中华鳖肾、脾细胞系;郭海杰建立了中华鳖心细胞系,并对细胞培养条件进行了优化。与畜禽类和鱼类相比,国内外关于鳖类细胞研究的广度和深度还远远不够。而且,上述关于鳖的细胞原代培养方法均需从成体中采集组织块,并基于组织块迁移法开展。该类方法虽已被证实可行,但也存在着一些缺点,例如:由于成体难以彻底消毒,细胞污染的概率较大;且培养液中存在大块的组织块,易造成培养的细胞类型不单一。本实验拟使用无菌的鳖胚胎,采用胰蛋白酶消化结合细胞过滤器的方法,解决上述问题。
维甲酸诱导基因Ⅰ(RIG-Ⅰ)可以识别病毒RNA,激活干扰素生成通路并生成干扰素,从而发挥抗病毒的作用。在RIG-Ⅰ识别并区别对待外源病毒RNA和自身RNA的过程中,-甲基腺苷(mA)修饰发挥重要的作用。机体自身的RNA经过mA修饰以后,不会激活干扰素系统,而外源的病毒RNA未经mA修饰,可激活该系统,进而产生干扰素。在mA修饰环状RNA的过程中,mA甲基化识别蛋白(YTHDF2)具有重要的作用。RIG-Ⅰ识别病毒RNA后,其分子构象发生改变,与线粒体抗病毒信号蛋白(MAVS)产生作用。MAVS进入线粒体,激活干扰素调节因子(IRF),再经过一系列的生化反应,生成干扰素(IFN-α/β),并产生后续的抗病毒反应。鉴于中华鳖在该方向的研究尚存在空白,因此有必要针对上述因子开展相关研究。
综上,本实验旨在建立基于中华鳖胚胎肝成纤维细胞的体外分离培养体系,并在此基础上,进一步采用RNA病毒模拟物——聚肌苷酸胞苷酸(Poly I:C)刺激该细胞,研究其对细胞形态和干扰素生成通路相关因子的影响,最终构建基于中华鳖胚胎肝成纤维细胞Poly I:C的刺激模型,为深入研究中华鳖抗病毒免疫调控机制奠定基础。
1 材料与方法
1.1 实验材料
实验用中华鳖胚胎由本实验室自行孵化得到。
主要试剂包括:DMEM高糖培养基、D-Hanks缓冲液、胰蛋白酶、秋水仙素、二甲基亚砜(DMSO)和100×双抗(500 U·mL青霉素和500 U·mL链霉素),购于北京索莱宝科技有限公司;胎牛血清(FBS),购于Bovogen公司;一抗甘油醛-3-磷酸脱氢酶(GAPDH)、一抗RIG-Ⅰ、一抗MAVS、一抗干扰素调节因子1(IRF1)、二抗HRP-conjugated Goat Anti-Rabbit lgG、RIPA裂解液和TBST缓冲溶液,购于生工生物工程(上海)股份有限公司;Opti-MEM培养基、TriZol试剂、反转录试剂盒Revert Aid First Strand cDNA Synthesis Kit,购于美国Thermo Fisher公司;poly I:C,购于美国Sigma公司;Lipofectmine 3000试剂,购于美国Invitrogen公司;异丙醇,购于国药集团化学试剂有限公司;PCR反应试剂,购于日本Takara公司;实时荧光定量PCR试剂UltraSYBR Mixture,购于江苏康为世纪生物科技有限公司;台盼蓝染液、5×SDS-PAGE上样缓冲液、ECL化学发光试剂盒,购于上海碧云天生物技术有限公司。
DMEM高糖培养基和FBS按9∶1的比例混合后,再加入1%(体积分数)的100×双抗配制成完全培养基。
细胞冻存液由DMEM、FBS、DMSO按70%、20%、10%的比例(以质量分数计)配制。
1.2 原代培养
取孵化至第23期的中华鳖胚胎,用75%(体积分数)乙醇对壳表面进行消毒,然后移入细胞操作间,在无菌条件下用眼科剪剪破卵壳,取出胚胎肝组织,用D-Hanks缓冲液(含1×双抗)清洗2遍以去除血细胞。之后,将其移入装有500 μL 0.25%(质量分数,下同)胰蛋白酶的1.5 mL离心管中,用眼科弯头剪刀将组织块剪成约1 mm的块状,再将其转入15 mL离心管中,加入3.5 mL 0.25%胰蛋白酶,混合后,在细胞培养箱中31 ℃消化20 min(每隔5 min轻轻晃动1次),再加入5 mL完全培养基终止消化。消化后用40 μm细胞过滤器过滤至新的50 mL离心管中,之后转移至15 mL离心管中,1 000×离心10 min,弃上清后,将所得沉淀用适量的完全培养基悬浮后移入到25 cm的细胞培养瓶(T25)中,置细胞培养箱中31 ℃继续培养,随后逐日在DM4000型显微镜(德国Leica)下观察细胞贴壁和生长状况,每2 d更换一次培养液。
1.3 传代培养
观察原代细胞培养情况,待细胞铺满单层时,吸出旧培养基,用5 mL D-Hanks缓冲液清洗一次,加入1 mL 0.25%胰蛋白酶,于细胞培养箱中31 ℃消化3 min,之后拍打培养瓶侧壁使细胞脱壁,加入完全培养基重悬细胞,以1∶5的比例接种至75 cm的细胞培养瓶(T75),置于细胞培养箱中31 ℃培养。后续细胞传代均按1∶5的比例进行。
1.4 细胞冻存与复苏
选取形态均一、生长旺盛并处于指数生长期、细胞贴壁90%以上的1瓶细胞,利用0.25%胰蛋白酶使细胞脱落下来,随即将细胞与培养基转入15 mL离心管中,1 000×离心3 min以去除培养基与胰蛋白酶。加入适量预先配制好的细胞冻存液,轻轻吹打,混合均匀,显微镜观察计数后,调节冻存液剂量,使细胞浓度达到10mL,转移细胞至2 mL冻存管中,然后将其放在预冷的程序降温盒(需加入异丙醇)中进行冻存。冻存程序如下:4 ℃存放6 h,之后转移至-20 ℃放置24 h,再于-80 ℃放置24 h,最后转移至液氮中长期保存。
复苏时,从液氮中取出冻存的细胞,快速置于37 ℃水浴锅中,轻轻晃动冻存管使其快速解冻。完全融化的细胞悬液经1 000 ×室温离心5 min后弃上清,加入3 mL新鲜的完全培养基重悬细胞后,转移至T25培养瓶,置于细胞培养箱中31 ℃条件下培养。
取冻存前、后的细胞悬液,将其与0.4%(质量分数)台盼蓝染液按1∶4的比例混合后,滴加至血球计数板上进行细胞计数,在显微镜下观察:死细胞被染成蓝色,而活细胞则呈透明卵圆形。用活细胞占计数细胞的比例表示细胞存活率。
1.5 细胞生长曲线测定
将中华鳖胚胎肝成纤维细胞经消化后制成终浓度为2×10mL的细胞悬液,接种至24孔培养板中,于细胞培养箱中31 ℃条件下培养。自接种结束开始计时,于培养后8 d内每天用200 μL 0.25%胰蛋白酶消化细胞,并用血球计数板计数每孔细胞的数量,每隔2 d给细胞换液1次。实验重复3次,以培养时间为横坐标,以每1 mL培养液中的细胞数量为纵坐标,绘制生长曲线,并计算中华鳖细胞的倍增时间。
1.6 细胞染色体观察与分子鉴定
取稳定生长于6孔板48 h的第10代细胞,加入终浓度1 μg·mL的秋水仙素于细胞培养箱中31 ℃培养6 h,用200 μL 0.25%胰蛋白酶消化后回收细胞。经低渗、预固定、固定、染色、干燥、封片后观察。
选取生长良好的中华鳖胚胎肝成纤维细胞,消化后收集细胞沉淀,采用TriZol法提取细胞总RNA,使用Revert Aid First Strand cDNA Synthesis Kit试剂盒合成cDNA第一链。以cDNA为模板,参考曹代男等的方法对成纤维细胞做分子鉴定,以波形蛋白基因和肌动蛋白α2基因2作为鉴定因子,以基因作为对照因子(引物序列详见表1)。PCR反应体系:5 μL 2×GC Buffer Ⅱ,1.6 μL dNTP Mixture,0.4 μL cDNA,0.4 μL上游引物(10 μmol·μL),0.4 μL下游引物(10 μmol·μL),0.2 μL TaKaRa LA酶,2 μL ddHO。PCR反应程序:94 ℃ 4 min;94 ℃ 30 s,59 ℃ 30 s,72 ℃ 2 min,32个循环;72 ℃ 10 min,16 ℃保温。1%(质量分数)琼脂糖凝胶电泳检测PCR扩增产物。
1.7 Poly I:C转染细胞
将中华鳖胚胎肝成纤维细胞经消化后制成终浓度为1.5×10mL的细胞悬液,接种至12孔培养板中(每孔1 mL),待生长至约80%时更换新鲜的完全培养基。采用Lipofectmine 3000试剂进行Poly I:C转染,每孔加入1 μg Poly I:C,同时在对照组中加入相同体积的空白Opti-MEM培养基,转染组和对照组各设3个重复,于细胞培养箱中31 ℃培养24 h后收集各组细胞。收集时吸干培养基,加入200 μL RIPA裂解液,放置于冰上,在摇床上裂解处理30 min,转移裂解液至EP管中,并加入80 μL 5×SDS-PAGE上样缓冲液,100 ℃金属浴处理10 min后,3 000×、4 ℃离心10 min,然后吸取上清液用于Western blot检测。
用于实时荧光定量PCR检测的细胞采用6孔板进行Poly I:C转染,收集细胞时先吸干培养基,再加入1 mL TriZol试剂,冰上处理10 min后,按TriZol试剂说明书中的方法提取总RNA,按1.6节方法制备cDNA。
1.8 实时荧光定量PCR检测和Western blot检测
采用UltraSYBR Mixture试剂,以-为内参基因,使用MyiQ2 Two Color实时荧光定量PCR仪(美国Bio-Rad)测定-Ⅰ、和2的相对表达量(引物序列详见表1)。实时荧光定量PCR反应程序:95 ℃ 10 min;95 ℃ 10 s,58 ℃ 30 s,72 ℃ 30 s,39个循环;65 ℃ 5 s,95 ℃ 5 s。反应体系:6.25 μL 2×UltraSYBR Mixture,1.0 μL cDNA,0.25 μL上游引物(10 μmol·μL),0.25 μL下游引物(10 μmol·μL)和4.75 μL ddHO。
用10%(质量分数)的聚丙烯酰胺凝胶电泳分离条带,电泳结束后用湿法转至硝酸纤维素膜上,用含5%(体积分数)脱脂牛奶的TBST缓冲液封闭1 h,再加入一抗在4 ℃孵育过夜,之后用TBST缓冲液洗膜3次,每次10 min,再加入二抗于室温下孵育1 h,用TBST缓冲液洗膜3次后,利用ECL化学发光试剂盒进行显色,最后在Amershan Imager 680系统(瑞典GE Healthcare Bio-Sciences AB)上成像。
1.9 数据处理
实时荧光定量PCR的数据采用Livak等的方法计算。采用Image-Pro Plus软件量化Western blot图像条带的灰度值,获得的数据在SPSS 22.0软件中进行统计,并开展独立样本检验,显著性水平选定为α=0.05。

表1 引物序列
2 结果与分析
2.1 原代培养与传代培养
原代培养24 h后可观察到少量细胞贴壁,此时细胞多呈成纤维样,细胞体积较小,细胞间隙较大(图1)。148 h后,细胞在完全培养基中生长较好,贴壁细胞数目明显增加,基本铺满单层,此时可以进行传代培养。传代细胞形态上与原代细胞一致,但细胞突起开始拉长,体积逐渐变大。传代细胞增殖速度较快,2~3 d即可传代一次。随着传代的进行,细胞生长逐渐趋于稳定,至本研究成文时已成功传至20代。
2.2 细胞冻存与复苏
将冻存1个月的细胞从液氮中取出进行复苏,培养2 d后在显微镜下进行观察,细胞生长速度和形态与冻存前无明显差别,继续培养3~4 d,细胞可铺满单层,且可以进行传代培养。对冷冻前、后的细胞进行台盼蓝染色(图2),经统计,细胞存活率分别为(90.51±0.46)%和(82.95±0.61)%。

图1 原代培养和传代培养的中华鳖胚胎肝成纤维细胞形态Fig.1 Morphology of primary culture and subculture of fibroblast from embryonic liver of Chinese soft-shelled turtle

正常细胞染色后呈白色,死亡细胞染色后呈蓝色。Living cells display white color, while the dead ones display blue color.图2 中华鳖胚胎肝成纤维细胞冻存前(a)、后(b)台盼蓝染色结果Fig.2 Trypan blue staining of embryonic liver fibroblast of Chinese soft-shelled turtle before (a) and after (b) cryopreservation
2.3 细胞生长曲线测定
中华鳖胚胎肝成纤维细胞的生长曲线呈典型的“S”形(图3),符合细胞生长的一般规律。接种后细胞先处于潜伏期,2~7 d进入对数生长期,8 d起细胞虽有生长,但速度减慢。经计算,6代时细胞的倍增时间为59.9 h。
2.4 细胞染色体观察和分子鉴定
选取100个中期分裂相的成纤维细胞(第10代)进行染色体观察和数目统计,发现染色体数目在66条的比例为72%(图4)。PCR扩增后,获得基因条带和2基因条带(图5,分别对应于544 bp和628 bp处)。
2.5 Poly I:C转染对中华鳖胚胎肝成纤维细胞的影响
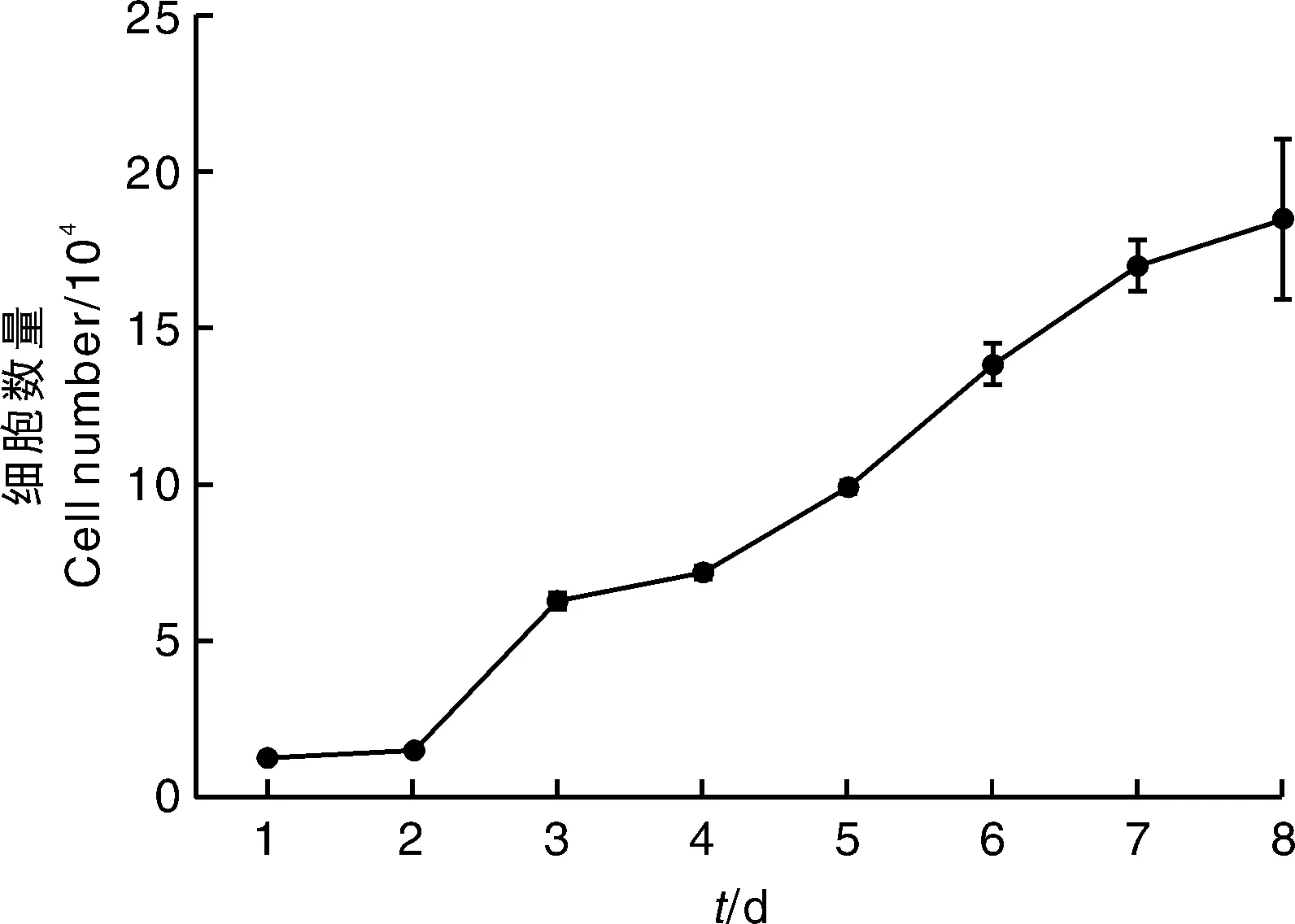
图3 中华鳖胚胎肝成纤维细胞的生长曲线Fig.3 Growth curve of embryonic liver fibroblast of Chinese soft-shelled turtle
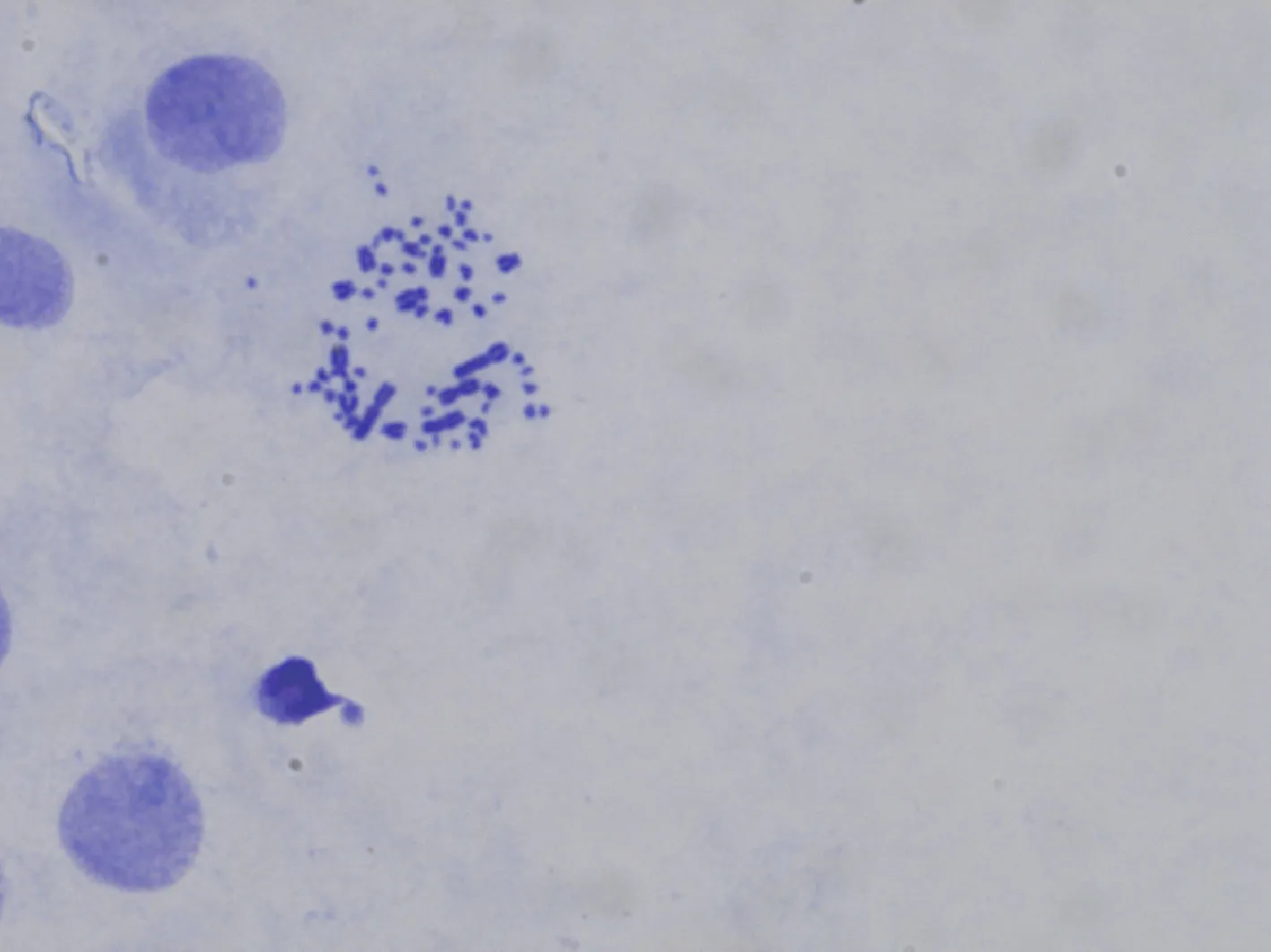
图4 中华鳖胚胎肝成纤维细胞染色体Fig.4 Chromosome of embryonic liver fibroblast of Chinese soft-shelled turtle

M,DNA分子量标准;1,ACTA2;2,VIM;3,GAPDH;4,H2O。M, DNA marker; 1, ACTA2; 2, VIM; 3, GAPDH; 4, H2O.图5 中华鳖胚胎肝成纤维细胞的分子鉴定Fig.5 Molecular identification of embryonic liver fibroblast of Chinese soft-shelled turtle
用Poly I:C转染中华鳖胚胎肝成纤维细胞,在31 ℃条件下培养24 h后,大量细胞逐渐收缩成圆形,漂浮在培养瓶表面,而对照组的细胞仍密集均匀分布,细胞贴壁良好(图6)。与对照组相比,Poly I:C转染显著上调了-Ⅰ基因的表达水平,而和2基因的表达量在Poly I:C转染组显著下调(图7)。与对照组相比,Poly I:C转染后,RIG-Ⅰ、MAVS蛋白表达水平显著增加,而IRF1蛋白表达水平无显著变化(图8、表2)。
3 讨论
目前,由于缺乏中华鳖来源的细胞系,中华鳖病毒学、免疫学,以及功能基因组学等方面的工作难以展开或进展缓慢。原代培养是细胞系建立中最为关键的一步,只有原代细胞分离成功,才有可能成功建立细胞系。目前,常用的原代细胞培养方法有直接提取法、消化分解法和组织块培养法。其中,常用于龟鳖类细胞原代培养的方法主要是2类:一类是组织迁移法,一类是胰蛋白酶消化法。两种方法均可成功获得可传代的细胞。胰蛋白酶消化法是一种常用的原代细胞培养方法,已在多个物种的原代培养中得到应用。本研究在胰蛋白酶消化法基础上进行改进,采用40 μm细胞过滤器从组织中分离原代细胞,成功从中华鳖胚胎中分离、培养出肝成纤维细胞,得到了形状、性能一致的细胞悬液,避免了培养液中大块组织块的存在,以及由此引起的多种细胞混杂,获得的细胞可确定为单一的成纤维细胞。而且,本实验分离培养出的细胞贴壁较快,细胞量大,生长情况良好。

图6 Poly I:C转染中华鳖胚胎肝成纤维细胞24 h后的形态Fig.6 Morphology of embryonic liver fibroblast of Chinese soft-shelled turtle transfected with Poly I:C for 24 h
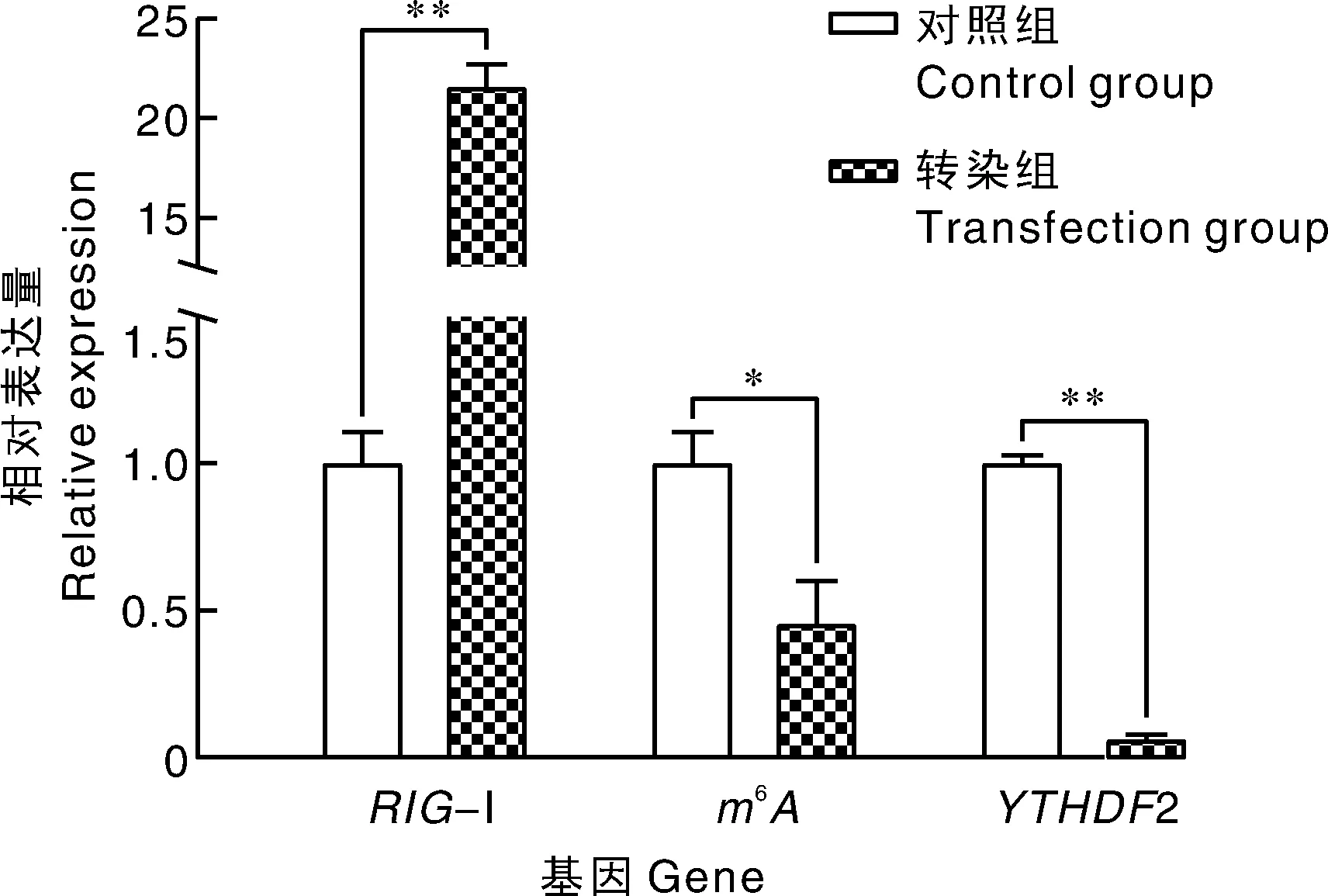
标*或**的分别表示对照组与转染组差异显著(P<0.05)或极显著(P<0.01)。* and ** indicate significant difference between the control group and the transfection group at P<0.05 and P<0.01, respectively.图7 Poly I:C转染对中华鳖胚胎肝成纤维细胞RIG-Ⅰ、m6A和YTHDF2基因相对表达量的影响Fig.7 Relative gene expression of RIG-Ⅰ, m6A and YTHDF2 in embryonic liver fibroblast of Chinese soft-shelled turtle transfected with Poly I:C
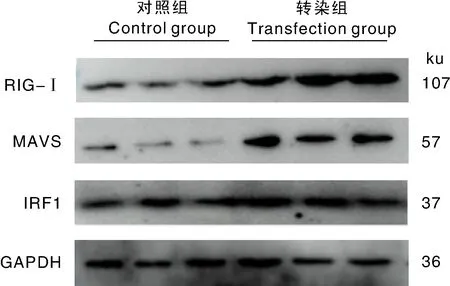
图8 Poly I:C转染对中华鳖胚胎肝成纤维细胞RIG-Ⅰ、MAVS和IRF1蛋白表达的影响Fig.8 Protein expression of RIG-Ⅰ, MAVS and IRF1 in embryonic liver fibroblast of Chinese soft-shelled turtle transfected with Poly I:C

表2 Western blot条带量化灰度值
在进行细胞原代培养操作时,如果组织灭菌不彻底,容易引起细胞培养污染。中华鳖胚胎以蛋的形式存在,作为原材料,具有蛋内无菌、蛋表面灭菌操作容易的特点,操作相对简便。此外,与成体相比,胚胎来源细胞分化能力强,活力好,生长快,传代代数更多。本试验获得的细胞已传20代,细胞活力正常。我们认为,选用鳖的胚胎来进行原代培养,是原代细胞培养成功的一个关键所在。
细胞体外培养会受到营养(糖、氨基酸、维生素等)和培养环境(温度、CO浓度、渗透压和pH等)的影响。中华鳖细胞培养中,常用的温度包括25 ℃、26 ℃、28 ℃、30 ℃和32 ℃。本实验参照郭海杰培养中华鳖心肌细胞的营养条件和环境,将培养温度设定为31 ℃,选用DMEM高糖培养基作为基础培养基,FBS质量分数为10%。结果显示,该条件下培养的中华鳖胚胎肝成纤维细胞贴壁和增殖迅速,传代后细胞状态稳定,按1∶5比例进行传代时,2~3 d即可传代一次。
本实验培养的细胞形态符合成纤维细胞形态学特征,初步鉴定为成纤维细胞。Wang等发现,锦鲤脑细胞在生长初期主要以成纤维细胞为主,但传代至第20代时上皮样细胞逐渐成为主要形态,因此仅凭形态学特征并不能准确判断其为成纤维细胞,通常还需要结合其他的特异性鉴定方法。关于成纤维细胞的鉴定,目前多采用免疫荧光的方法进行鉴定。除此之外,也可以通过PCR法进行鉴定。一般认为,波形蛋白基因和肌动蛋白基因2是成纤维细胞重要的分化标记基因。主要负责维持细胞骨架的完整性,通常只在间充质细胞中表达;2是细胞骨架微丝、微管,以及肌小节的主要组成部分,存在于细胞质中。曹代男等采用和2鉴定红耳龟胚胎的成纤维细胞。本实验检测到了和2的电泳条带,证实分离培养的细胞为成纤维细胞。
细胞核型正常是细胞研究工作的基础。针对细胞进行的克隆、基因编辑和转基因等研究都需要核型正常的细胞。本研究所获得的第10代细胞核型正常率为72%,表明培养的细胞状态较好,属于正常范畴。一般来说,随着细胞传代数的增加,细胞会越发衰老,核型异常的细胞比例会增大。本研究中细胞在第10代时核型正常比例仍较高,说明可用于后续研究。
干扰素生成通路的机制在前言中已做简要介绍,本研究涉及的因子包括RIG-Ⅰ、mA、YTHDF2、MAVS和IRF1。根据已知物种的作用机制,对干扰素生成具有正向调节作用的包括RIG-Ⅰ、MAVS和IRF1,具有反向调节作用的包括mA和YTHDF2。Poly I:C是一种模拟病毒RNA作用的双链RNA模拟物,是实验中常用的一种免疫刺激物。本研究中,Poly I:C转染提高了RIG-Ⅰ的基因和蛋白表达水平,同时上调了MAVS蛋白的表达水平,而和2基因的表达水平则显著降低。这表明,Poly I:C转染下,干扰素生成通路被激活,且促进了干扰素的生成,进而可产生抑制病毒的作用。由此可知,中华鳖干扰素生成通路的机制与其他物种存在一致性。Vats等证实,Poly I:C刺激能够显著提高水牛()成纤维细胞-Ⅰ基因的表达水平。在水生动物中,Chen等研究表明,Poly I:C刺激草鱼原代肾细胞24 h后,-Ⅰ基因的表达水平提高。Kim等研究发现,过表达2显著降低了Poly I:C诱导的干扰素调节因子3和干扰素基因-的表达水平。
本研究对干扰素生成通路进行Poly I:C刺激实验时,检测指标包括基因表达(-Ⅰ、和2)和蛋白表达(RIG-Ⅰ,MAVS和IRF1),除了RIG-Ⅰ同时进行荧光定量PCR和Western blot检测外,其他因子受限于现有的基因序列和抗体,均只进行一种检测,但是基因表达和蛋白表达的单一结果也能够说明因子的变化趋势。
综上,本实验成功建立了中华鳖胚胎肝成纤维细胞的体外分离培养体系,培养出的成纤维细胞具有可稳定传代、生长快和分化程度低等特点。在此基础上,采用Poly I:C转染的方法成功激活了细胞干扰素生成通路的相关因子,为后续该通路的研究提供了实验材料。

