Au-N共掺杂TiO2纳米管电极的制备与表征*
王理明,孟淑雅,李梦瑶,张 爽,宗秀雨,敖 冬,刘婷婷
(1. 西安工程大学 环境与化学工程学院, 西安 710048; 2. 陕西省现代建筑设计研究院, 西安 710021)
0 引 言
作为典型的光催化材料,TiO2具有较高的催化活性、稳定的化学性能和无毒价廉等一系列优点,是当前光催化及光电催化领域的重要研究热点[1]。然而,TiO2固有的禁带宽度(Eg=3.2 eV)较宽,对太阳光的利用效率低,且TiO2的光生电子-空穴对易复合,限制了TiO2的应用。目前,为了解决TiO2的实际应用问题,主要从减小其禁带宽度或者抑制其光生电子-空穴对复合这两个方面进行材料的掺杂改性,掺杂方法分为非金属掺杂[2-4]、金属掺杂[5-7]和共掺杂[8-9]。研究表明,仅通过单一元素掺杂对TiO2光催化活性的改善非常有限[10-11]。因此,如何对TiO2进行金属和非金属离子共掺杂,协同提高TiO2的光催化活性,也是近年来研究的重点[12-14]。吴奇等[15]采用阳极氧化和浸渍法制备了Fe、N共掺杂TiO2纳米管,吸收带较单一掺杂发生红移,且对罗丹明B的降解速率也明显提高。许美贤等[16]采用磁控溅射、阳极氧化以及气氛退火相结合的方法制备了Au负载N掺杂TiO2纳米管阵列,对甲基橙降解结果表明磁控溅射20 s Au条件下与N协同作用最好,有效抑制了电子-空穴对复合。这些研究为共掺杂TiO2纳米管光电催化材料的制备提供新思路。本课题组前期采用等离子体法制备了掺氮TiO2纳米管[17],为了进一步提高光电催化活性,采用光化学沉积法制备Au-N共掺杂TiO2纳米管,并通过SEM等结构表征、CV等电化学分析以及四环素的催化降解评价Au-N-TNT的光电催化性能。
1 实 验
1.1 Au-N共掺杂TiO2纳米管电极的制备
将经过超声预处理(80 ℃,60 min)的钛片作为阳极,H3PO4和NH4F混合体系作为电解液进行阳极氧化得到TiO2电极。采用光化学沉积法制备Au-TiO2电极: 将TiO2电极浸渍在一定浓度的氯金酸溶液中,高压汞灯(500 W)垂直照射1 h;光照完成后,依次用无水乙醇和去离子水冲洗;最后100 ℃真空干燥30 min后备用制得Au-TiO2电极。采用低温等离子体设备对Au-TiO2电极在掺氮功率10 W,掺氮时间90 s条件下进行等离子体掺氮得到Au-N共掺杂TiO2电极。最后将Au-N共掺杂TiO2电极置于马弗炉中(500 ℃)煅烧2 h,获得Au-N共掺杂TiO2纳米管电极。
1.2 Au-N共掺杂TiO2纳米管电极的表征与测试
采用Quanta-450-FEG场发射扫描电镜观察Au-N共掺杂TiO2纳米管电极的表面形貌;采用X-MAX50能谱仪分析电极表面元素;采用MiniFlex600 X射线衍射仪分析Au-N共掺杂TiO2纳米管电极的晶相结构;采用U-3310紫外-可见光谱仪测试Au-N共掺杂TiO2纳米管电极的光吸收性能,扫描波长范围为200~800 nm;采用上海辰华CH760e电化学工作站在三电极体系下进行循环伏安(CV)和瞬态光电流(I-t)分析;采用UV2450紫外-可见分光光度计测定Au-N共掺杂TiO2纳米管电极光电催化四环素过程中的紫外-可见吸收光谱。
1.3 光电催化四环素
光电催化实验在自制的反应系统中进行。四环素的测定:采用紫外可见分光光度计在378 nm处测定其吸光度A的变化,由标准曲线计算其浓度,由公式η=(C0-Ct)/C0×100%计算出四环素的降解率。
2 结果与讨论
2.1 SEM与EDS分析
图1为TiO2纳米管和Au-N共掺杂TiO2纳米管的SEM图。从图中可以看出,共掺杂前电极表面具有均匀分布的纳米管状结构,且结构较为清晰,管径约为90 nm。共掺杂后TiO2纳米管的管径与负载前没有明显差异,管口处可以观察到分散着大小不一的Au单质纳米颗粒。在当前Au和N负载量下,也不会破坏整个TiO2纳米管阵列的结构。

图1 未掺杂和Au-N共掺杂TiO2纳米管的SEM图
图2是Au-N共掺杂TiO2纳米管的EDS谱图。未掺杂N和Au时,TiO2纳米管表面仅含有Ti、O两种元素,且Ti、O元素含量比大于1∶2,这可能是由于阳极氧化制备的TiO2纳米管较薄,在检测过程中检测到基底中金属Ti元素所造成的。Au-N共掺杂TiO2纳米管表面主要成分为Ti和O元素。电极表面有微量的Au元素和少量N元素掺杂进入,原子百分比分别为0.20%和5.22%,共掺杂前后 O、Ti原子比下降。
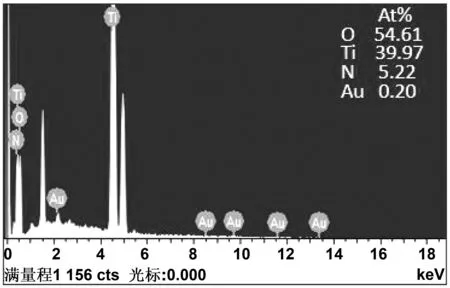
图2 Au-N共掺杂TiO2纳米管的EDS能谱图
2.2 XRD分析
图3为TiO2纳米管和在不同氯金酸浓度(0.02、0.2和2.0 mmol/L)中制备的Au-N共掺杂TiO2纳米管的XRD衍射图谱。由图像可知共掺杂前后样品在2θ=25.8°和53.9°都出现锐钛矿型TiO2特征峰,分别归属于锐钛矿型TiO2的(101)和(105)晶面。对于不同Au含量和N共掺杂TiO2纳米管的锐钛矿结构衍射峰位置一致,证明共掺杂后并没有改变TiO2纳米管表面的结构。另外,在Au-N共掺杂TiO2纳米管的XRD图谱中,2θ=44.4°和77.6°处出现的衍射峰对应于金属Au的(200)和(311)晶面。随着氯金酸浓度的增加,Au 的衍射峰强度逐渐加强,表明还原出的金单质也越来越多。
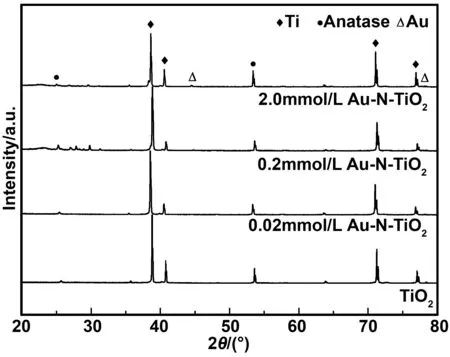
图3 Au-N共掺杂前后TiO2纳米管的XRD谱图
2.3 UV-VIS-DRS分析
图4为Au-N共掺杂前后TiO2纳米管的紫外-可见漫反射吸收光谱图。从图中可以看出,相对于纯TiO2纳米管,所有Au-N共掺杂TiO2纳米管在紫外和可见光范围(400~800 nm)的光吸收率都明显增加,且随着Au含量的增加,对紫外和可见光的吸收能力也在增加,其中0.2 mmol/L Au-N-TiO2纳米管的吸收能力最强,这可能是因为Au的局域表面等离子体共振引起光生电子在Au与TiO2之间的重新排布促进了光的吸收[18]。2.0 mmol/L Au-N-TiO2纳米管对可见光的吸收能力下降是因为过多沉积的金纳米颗粒对TiO2纳米管的轻微阻塞所致。从图中还可以发现,所有Au-N共掺杂TiO2纳米管在可见光范围吸收峰红移,同时吸光度也逐渐增强。这是因为随着氯金酸浓度的增大,Au尺寸也在不断增大,其在TiO2表面的电磁迟滞效应逐渐增强,导致吸收波长不断红移,使共掺杂TiO2纳米管在可见乃至近红外区具有光学活性[19]。
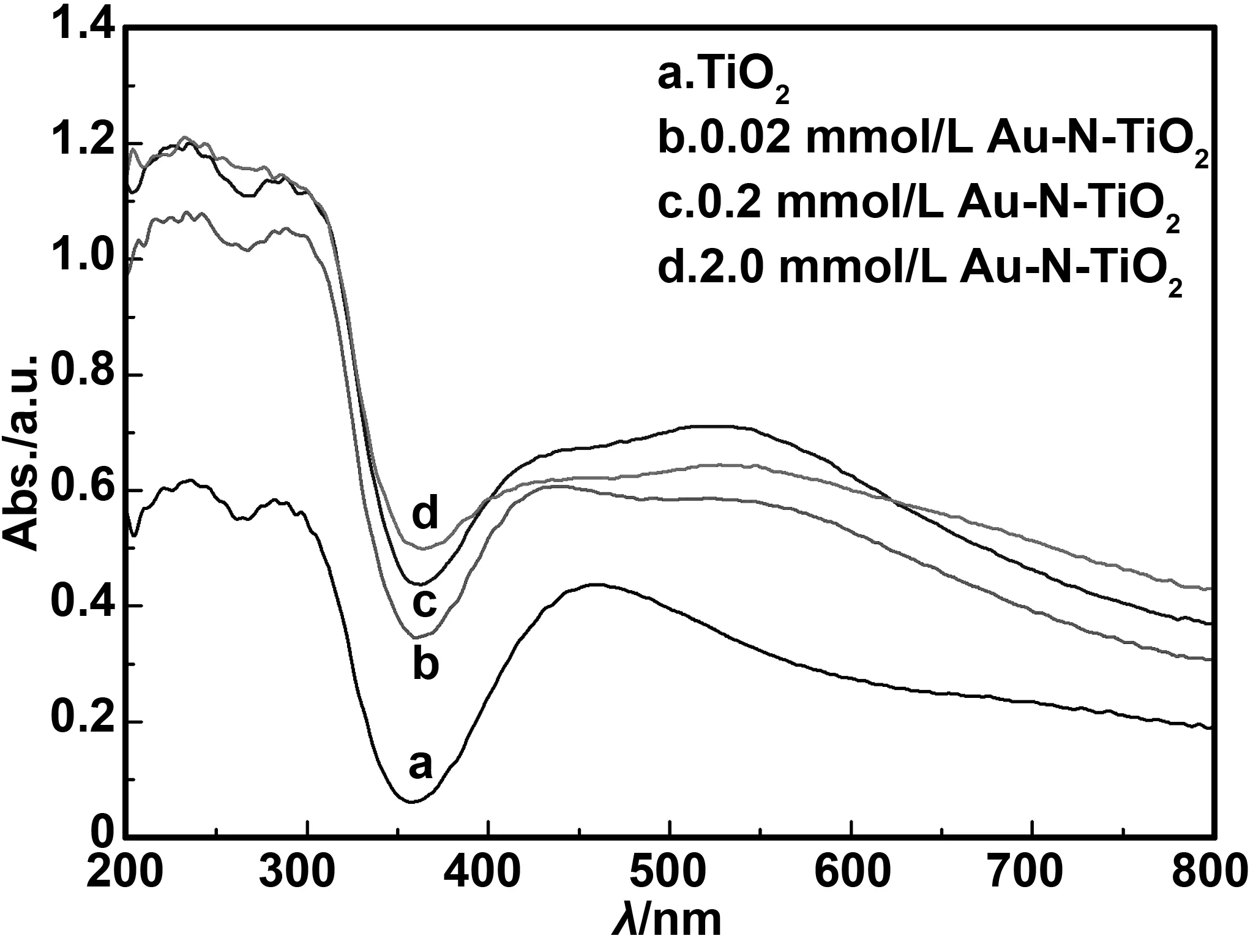
图4 Au-N共掺杂前后TiO2纳米管的UV-VIS-DRS图谱
2.4 CV分析分析
图5显示了电压为-1.0~1.0 V时,Au-N共掺杂前后TiO2纳米管在0.1 mol/L Na2SO4溶液中紫外光照下的循环伏安特性曲线图。从图中可以明显的看出各电极的氧化性质相似,氧化峰电位在0.75 V左右。此外,在光电催化过程中,0.2 mmol/LAu-N-TiO2电极周围的氧化还原峰电流值明显高于其他电极,这表明电极表面致密均匀,具有良好的导电性。因此,它可以生产更多的活性物质并改善电极的光电催化性能。
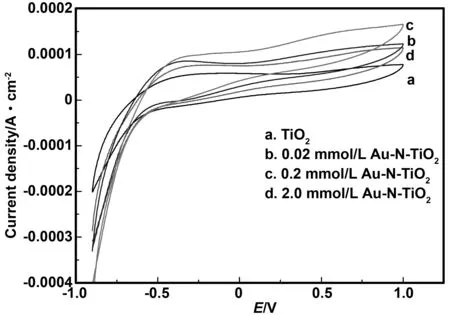
图5 Au-N共掺杂前后TiO2纳米管的CV图
2.5 I-t分析
图6为Au-N共掺杂前后TiO2纳米管在紫外光照和暗态交替过程中的瞬时光电流响应曲线图。可以发现,Au-N共掺杂TiO2纳米管电极在光照条件下的光电流密度约为纯TiO2纳米管的2~6 倍。这是因为Au与TiO2的有效接触可促进光生电子传递,减少光生电子-空穴对的复合,同时Au可在TiO2表面引起表面等离子共振效应,从而增强TiO2的光电催化性能提高其光电催化效果。从图中还可以发现,随着氯金酸浓度的增加,光电流密度增加,在氯金酸浓度为0.2 mmol/L时光电流密度达到最大值。但是当继续增加氯金酸浓度至2.0 mmol/L时,光电流密度有所减小。这可能是过量掺杂的Au纳米颗粒聚集在纳米管表面,反而为电子-空穴复合提供更多的位点,对光催化反应产生负面影响。
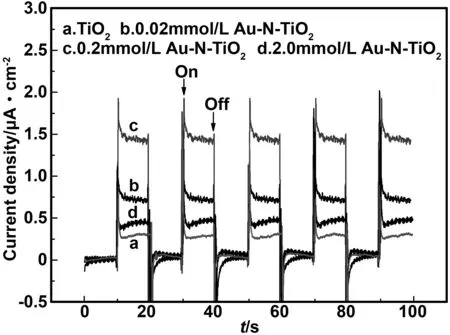
图6 Au-N共掺杂前后TiO2纳米管的瞬态光电流响应图
2.6 四环素紫外-可见吸收光谱
在本实验体系的最佳条件下(四环素浓度40 mg/L,初始pH值10,外加偏压20 V),Au-N共掺杂TiO2纳米管光电催化四环素过程中的紫外-可见吸收光谱如图7所示。从图中可以发现四环素在273和378 nm附近都有较强的紫外吸收峰。四环素是酮基和烯醇基共轭双键系统,具有可见光发色基团,因此在可见光区具有较强的紫外吸收[20]。在降解反应10 min时,378 nm处特征峰明显降低,反应30 min 后,特征峰消失。此外在反应过程中,273 nm附近的特征峰先逐渐升高再降低,说明四环素在降解过程中生成了中间产物,且中间产物被降解成更小的分子物质,当反应达到120 min时,特征峰基本平和,说明四环素基本降解充分。
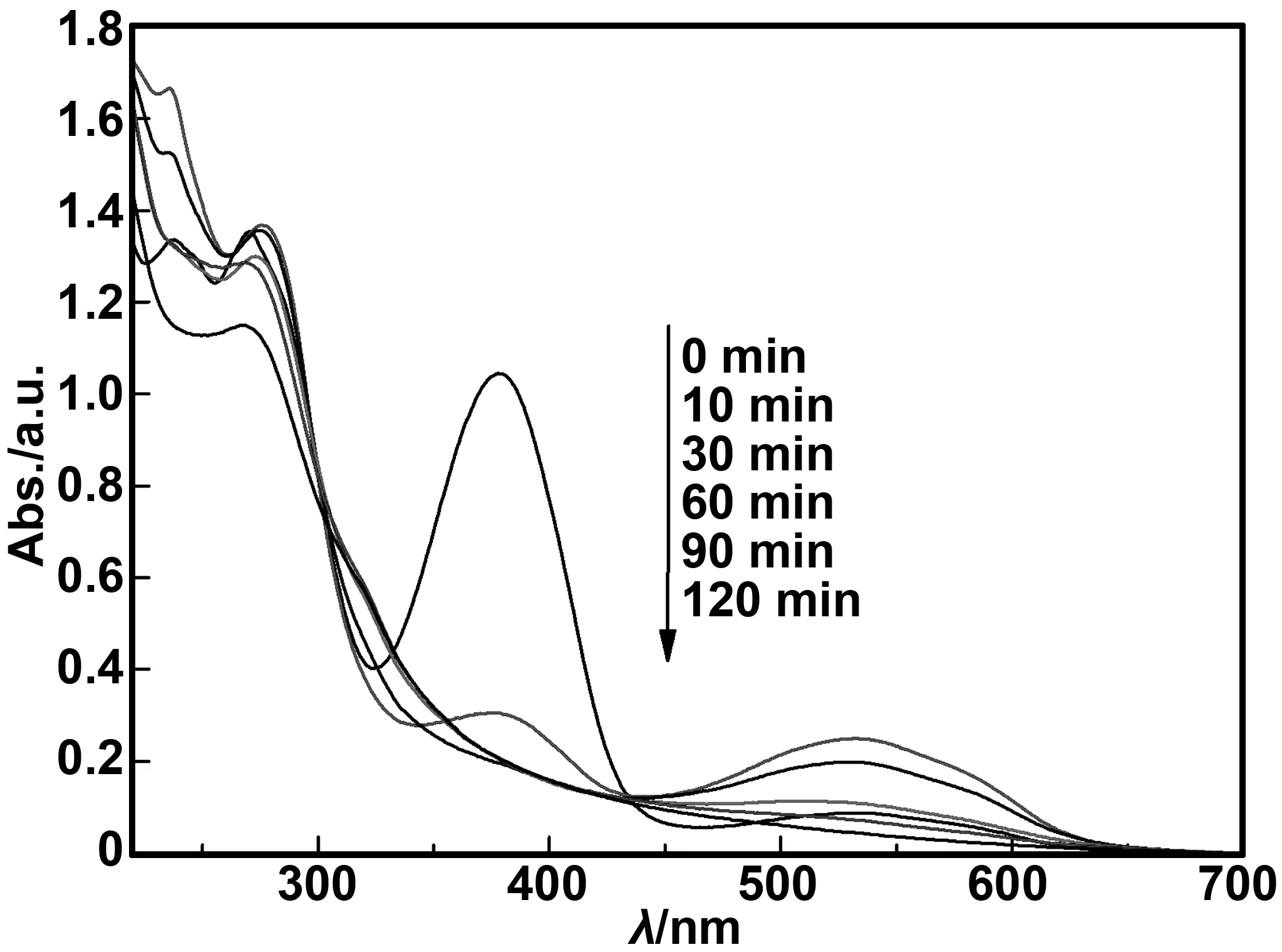
图7 不同降解时间四环素的紫外-可见光吸收光谱
2.7 光催化动力学分析
Au-N共掺杂TiO2纳米管光电催化降解四环素的过程符合一级反应动力学方程,表达式如下:
ln(C0/Ct)=kt
(1)
式中:C0为四环素初始浓度,mg/L;Ct为四环素瞬时浓度,mg/L;k为反应速率常数,min-1。
本研究分析了不同Au掺杂量的Au-N共掺杂TiO2纳米管在实验体系最佳条件下(四环素浓度40 mg/L,初始pH值10,外加偏压20 V)光电催化降解四环素的降解效果,并对反应过程进行降解动力学分析,拟合结果如图8和表1所示。

表1 不同Au掺杂量的Au-N共掺杂TiO2纳米管动力学方程及参数
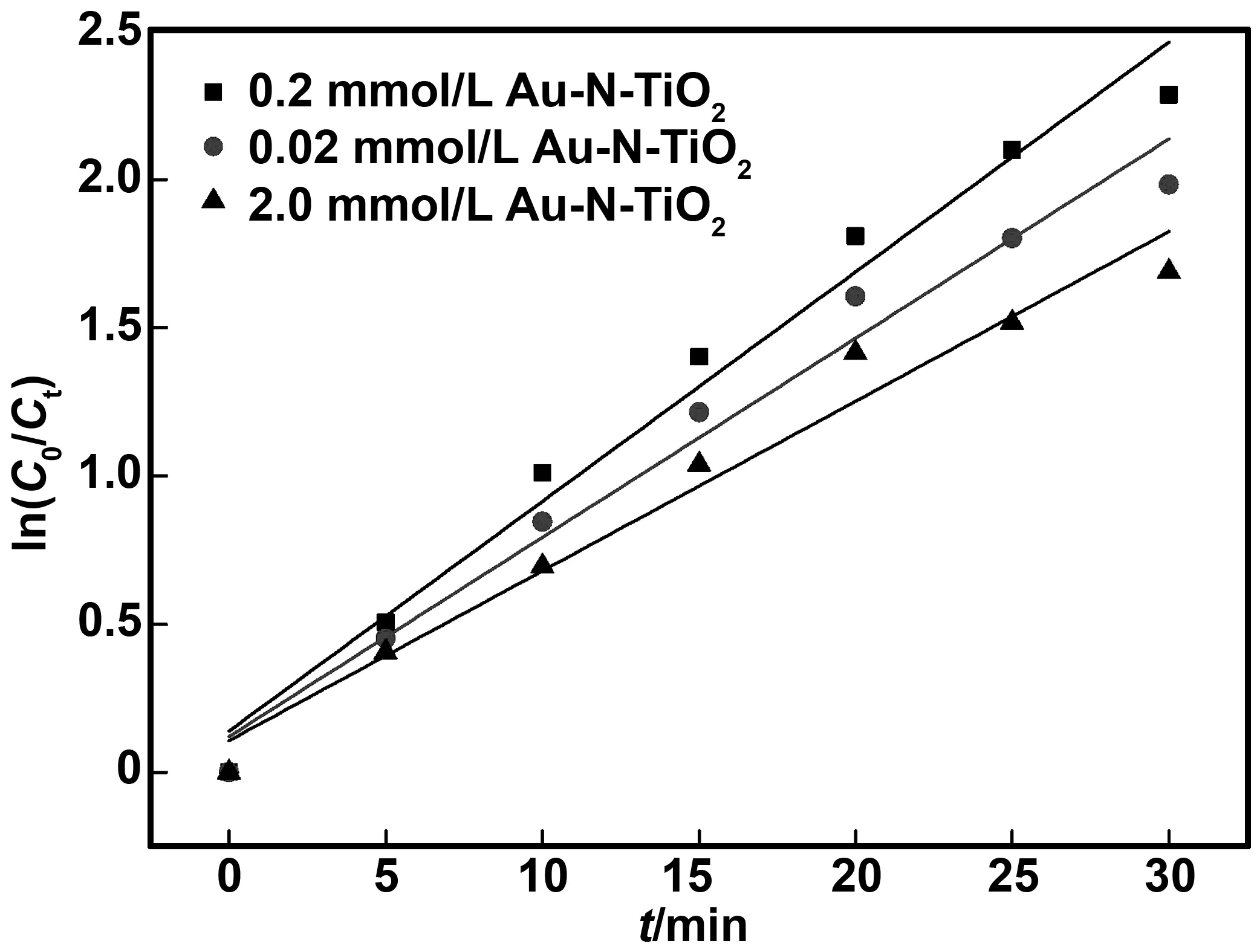
图8 不同Au掺杂量的Au-N共掺杂TiO2纳米管光催化降解动力学拟合图
由图8和表1可知:所有拟合曲线均呈线性,反应过程符合一级反应动力学。0.2 mmol/L Au-N-TiO2纳米管电极的光电催化降解速率最高,达到0.07744 min-1,表明其光电催化活性最好。
3 结 论
(1)采用等离子体法和光化学沉积法制备出Au-N共掺杂TiO2纳米管,掺杂后纳米管口处出现Au单质纳米颗粒,在紫外和可见光范围的光吸收率都明显增加,且在可见光范围吸收峰红移,同时吸光度也逐渐增强。
(2)循环伏安和光电流的结果表明共掺杂电极表面致密均匀,具有良好的导电性;光电流密度约为纯TiO2纳米管的6 倍。
(3)紫外-可见吸收光谱曲线显示,四环素378 nm处特征峰在反应30 min后消失;273 nm处特征峰随时间先逐渐升高再降低,120 min后基本平和,说明四环素基本降解。降解反应过程符合一级反应动力学,0.2 mmol/L Au-N-TiO2纳米管电极的光电催化降解速率最高,达到0.07744 min-1。
——潘桂棠光生的地质情怀

